基于Notch信号通路与突触可塑性探讨针刺治疗脑卒中后认知障碍*
陈丽敏,白艳杰,王岩,陈淑颖,张雍闯,李晓晓
1.河南中医药大学,河南 郑州 450046; 2.河南中医药大学第一附属医院,河南 郑州 450000
脑卒中后认知障碍(post-stroke cognitive impairment,PSCI)是血管性认知障碍的一种亚型,通常在脑卒中发病后出现,包含卒中后非痴呆型认知障碍至卒中后痴呆的一系列症状[1],主要表现为学习记忆障碍、失语、失认、失用等。我国PSCI患病率较高,国内一项社区现况调查显示,脑卒中患者中,PSCI 的发病率为80.97%,其中,卒中后非痴呆型认知障碍占48.91%,卒中后痴呆占32.05%[2]。此外,脑卒中复发常见于伴认知障碍的患者,简易智力状态检查量表评分越低的患者复发的可能性越大[3]。因此,PSCI严重影响患者的生活质量,对患者、家庭及社会都造成了沉重负担,甚至增加了脑卒中患者的病死率。
目前,PSCI的发病机制尚未明确,现有研究多集中于脑血管损伤机制、脑神经退行性变、炎症机制及氧自由基损伤机制等方面[4]。PSCI的临床用药主要参考阿尔茨海默病,阻碍疾病向痴呆转化,但药物疗效并不理想,且长期服用会出现不良反应。因此,寻求PSCI安全有效的治疗方法非常重要。有研究表明,突触可塑性的变化极大程度上影响了脑卒中后神经修复以及认知功能障碍的改善,且Notch信号通路与突触可塑性密切相关[5]。针灸治疗 PSCI 的主要机理为抑制炎症反应、调控神经细胞凋亡和自噬的过程、调节中枢胆碱能系统、提高突触可塑性、控制脑源性神经营养因子和生长控制因子分泌等[6]。本文以Notch信号通路为切入点,探讨针刺提高神经细胞的突触可塑性,以期为治疗PSCI提供新的生物学依据。
1 Notch信号通路与突触可塑性在治疗 PSCI 中的联系
1.1 Notch信号通路与脑卒中Notch信号通路主要由Notch配体(Delta-like1、3、4和Jagged1、2)、Notch受体(Notch1、2、3、4)、转录因子CSL、靶基因(Hes1、3、5和Hey)4部分组成[7]。Notch受体可以分为胞外区、跨膜区和胞内区,当相邻细胞通过“旁分泌”途径促进Notch配体与受体结合时,蛋白酶切水解Notch受体、胞内结构域(notch intracellular domain,NICD)在细胞核中与转录因子复合物CSL、辅助激活因子MAML等结合,形成功能性转录激活复合物,最后作用于靶基因,调控细胞的增殖、分化和凋亡[8-9]。在脑卒中发生后,Notch信号通路的不同配体、受体、靶基因等的表达水平会发生变化,使脑内组织发生一系列病理生理学改变,对机体产生有害或有益的影响。
脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)后,Notch1的激活可能会引起细胞凋亡、保护神经元、提高突触可塑性等。在细胞凋亡方面,大脑缺氧时刺激Notch1受体,游离的胞内区可能激活核因子-κB(nuclear factor kappa-B,NF-κB)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、p53及Pin1,诱导细胞凋亡[10-11]。与此相反,在脑内低氧时注入γ-分泌酶抑制剂,会阻止胞内区的形成,NF-κB表达减少,进一步证实胞内区能够上调NF-κB表达,促进神经元凋亡。在保护神经元和提高突触可塑性方面,有研究表明大脑轻度缺氧会使Notch1、Jagged1、Hes1和BDNF的表达水平升高,神经元突起延长,而使用抑制剂DAPT后,上述分子的表达急剧下降,且可抑制神经元突起的生长[12]。脑卒中发生后,Notch1蛋白的表达增加,海马神经元突触可塑性相对提高,而Notch1基因敲除的小鼠会出现树突棘数量的减少[13-14]。
脑卒中的发病过程中,Notch2的表达会降低血管平滑肌细胞的活性,使血管损伤后内膜的病变加剧。而Notch3的作用与之相反,它能通过调节丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)信号通路促进血管平滑肌细胞的增殖,保护脑血管[15]。但另一项研究显示,常染色体显性遗传性脑动脉病伴皮质下梗死和白质脑病(cerebral autosomal dominant arteriopathy with subcortical infarcts andleukoencephalopathy,CADASIL)是脑卒中的常见遗传因素。在CADASIL中,Notch3蛋白增加,脑动脉最大扩张能力下降,进而使脑血流量减少,加重脑损伤[16]。所以,脑卒中发病后,Notch3的激活对脑血管的具体作用机制仍需进一步探讨。在心脑血管疾病研究中,Notch4作用微小,文献相对较少[17]。
综上,Notch信号通路与脑卒中的进展紧密相连,而Notch1蛋白的表达与神经功能的保护有关。因此,调控Notch1的表达能够改善脑卒中后的功能障碍。
1.2 突触可塑性与PSCI在大脑结构中,突触主要有传递信息和储存信息两个功能。突触可塑性是人类学习和记忆的基石,包括结构可塑性和功能可塑性。海马体可以作为机体学习及记忆功能的“操控室”,其作用主要为形成记忆并储存[18-19]。脑卒中发生后,脑组织受损程度各异,神经系统被损害,激活各种细胞因子,导致突触发生病理性改变,同时大脑释放神经毒性物质,抑制神经电生理活动,造成突触的脱落及结构的改变,从而降低突触结构可塑性,影响突触的传递功能,引起学习、记忆能力下降等认知障碍[20]。
突触结构可塑性表现为突触数量、树突棘密度、平均面积、间隙距离、突触后致密物、突触界面曲率的变化及新突触的形成等[21]。突触功能可塑性可分为长时程增强和长时程抑制,能够反应受损突触的传递效率。长时程增强表现为两个神经元信号传输过程中的一种持续增强现象,能够促进受损突触的功能恢复。长时程抑制与长时程增强的功能相反,其中长时程抑制表现为持续的刺激降低突触的效率,不利于突触功能的重建[22]。长时程增强是功能可塑性研究最多的一种形式,可以分为早期长时程增强和晚期长时程增强,突触蛋白大部分在晚期长时程增强中合成并运输,主要包括突触素(synaptophysin,SYP)、神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、生长相关蛋白-43(growth associated protein,GAP-43)、神经细胞黏附分子(neural cell adhesion molecule,NCAM)等,它们不仅能够增加树突棘的数量,促进新突触间的相互联系,而且能提高突触间的传递效率[23-24]。因此,脑卒中后认知功能的改变与突触结构功能被破坏有关,提高海马区神经突触可塑性是改善PSCI的有效手段。
2 针刺治疗PSCI
中医学将PSCI归属于“呆病”的范畴,主要表现为神智异常,由肾虚、痰浊、瘀血等引起,其病位在脑,涉及心、肝、脾、肾[25]。针灸作为中医治疗的常用手段,治疗PSCI经验丰富且疗效显著。
2.1 针刺调控Notch通路Notch通路激活后参与CIRI后的各种病理生理反应,特别是Notch1受体的激活,能够发挥保护脑组织的作用,与提高海马组织的学习记忆能力有关[26]。许多研究显示,针刺可以调控Notch信号通路,保护大脑,改善脑卒中后的功能障碍。Sha等[27]认为,电针针刺足三里和外关穴对大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)大鼠模型的CIRI具有保护作用,其机制可能是电针刺激穴位激活Notch1受体,促进miR-223的表达,进而增加神经干细胞(neural stem cells,NSCs)数量。Tao等[28]研究发现,电针足三里、曲池穴可以通过促进Notch信号传导增加BDNF和神经胶质细胞衍生的神经营养因子的分泌,促进海马NSCs的增殖和分化。在此之后,又有研究显示,电针MCAO大鼠百会穴、水沟穴可以上调大鼠海马齿状回区Notch1、Hes1的表达水平,促进NSCs的增殖[29]。
针刺除了能够刺激Notch通路,促进NSCs的增殖和分化,还能通过其他途径保护受损脑组织。Zhao等[30]认为,电针百会可以促进胞内区和HIF-1α的表达,抑制细胞凋亡,减轻CIRI。赵俊红等[31]发现,电针百会、人中穴能够减轻认知障碍,可能与Notch通路调控神经可塑性有关。虽无基础试验直接显示针刺可以通过调控Notch通路改变突触可塑性,进而改善PSCI,但是一项电针干预放射性脑损伤的实验表明,针刺百会、风府和双侧肾俞穴可以增加小鼠体内突触后致密蛋白95、SYP和BDNF的分泌,提高突触可塑性,改善小鼠学习记忆功能,这与针刺调节Notch信号通路密切相关[32]。见表1。

表1 针刺调控Notch通路改善脑损伤的机制
2.2 针刺调控突触可塑性海马区神经元的突触是大脑学习记忆的基础结构,许多基础实验显示,针刺可以通过调节突触的结构可塑性和功能可塑性改善受损大脑的认知功能障碍。在突触结构可塑性方面,一项动物实验采用于氏头穴丛刺法治疗MCAO大鼠后,电镜观察结果显示大鼠大脑缺血区突触小泡数量增加,突触间隙减小[33]。Xie等[34]通过针刺神庭穴和百会穴治疗MCAO大鼠,14 d后,发现经治疗的大鼠突触数目明显增多,突触小泡分布密集,突触间隙相对较小,并且神经功能缺损评分和行为学测试均有所改善。与以上研究结果相同,Wen等[35]认为滋养肝肾针灸疗法能够通过分泌BDNF、SYN改变突触结构,改善脑缺血后引起的认知障碍。
在突触功能可塑性方面,有研究发现,针刺足三里和百会可以促进多巴胺及其分泌物的释放,增加多巴胺受体的表达,进而易化LTP,改善认知功能[36]。Lin等[37]认为电针可以通过降低N-甲基-D-天冬氨酸受体亚型1(N-methyl-d-aspartate receptor subtype 1,NMDAR1)的表达和瞬时受体电位香草亚型1(Transient receptor potential Vanilla subtype 1,TRPV1)介导的神经毒性,减轻血管性痴呆大鼠模型中LTP的缺乏。随后,柳维林[38]发现,电针可能通过miRNA-129a/PRKG途径,增加CREB磷酸化,上调c-fos、c-jun的表达,进而修复树突结构、易化LTP,减轻学习记忆障碍。因此,针刺也可以通过提高突触的功能可塑性来改善PSCI。然而,针刺改善PSCI的相关研究尚未将Notch信号通路调控突触可塑性的机制阐明清楚,所以未来针刺治疗PSCI的基础研究需要向该方向发展。见表2。
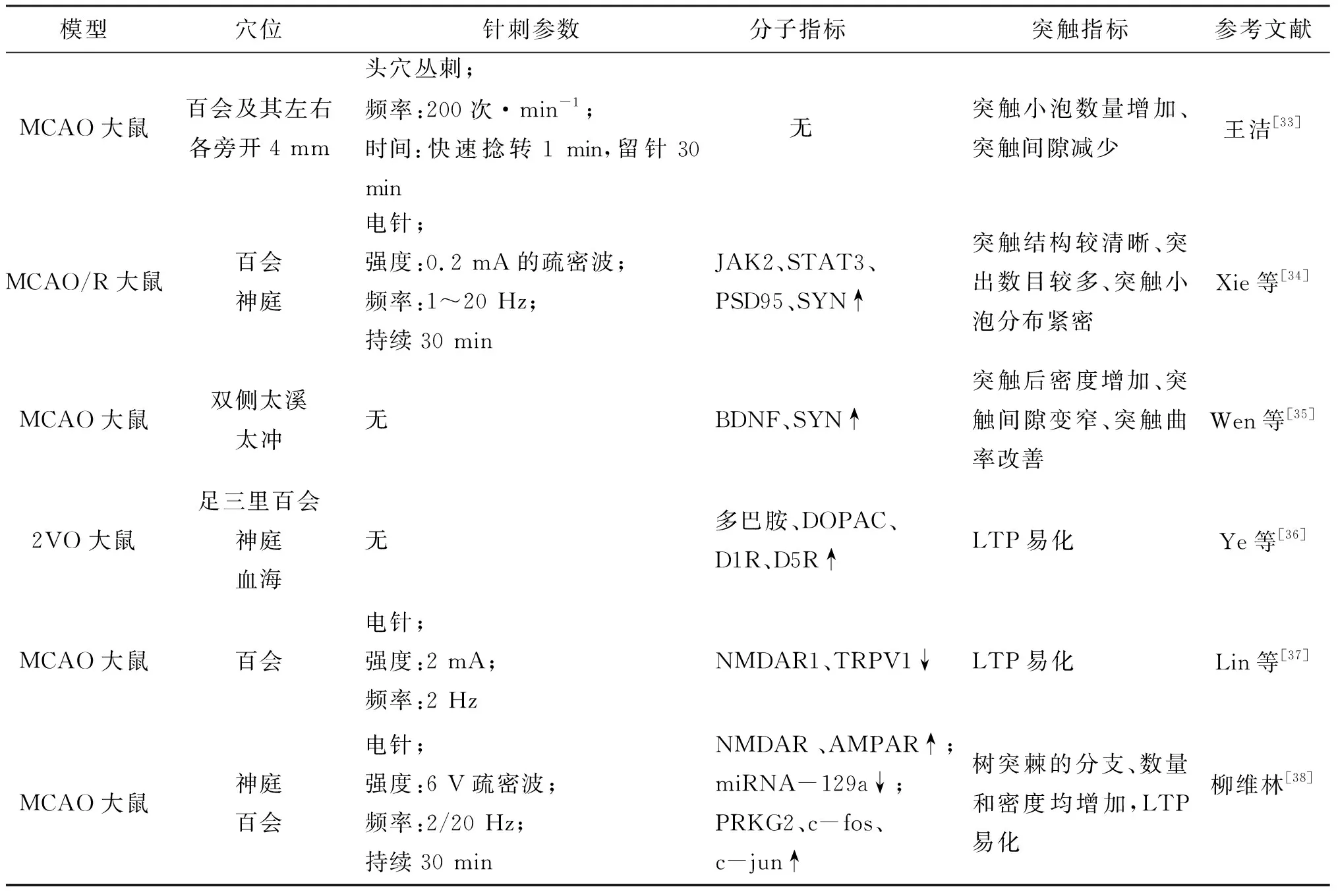
表2 针刺提高突触可塑性改善脑损伤的机制
3 通督醒神针调节Notch信号通路治疗 PSCI 的研究思路
大量实验和临床研究表明,通督醒神针在治疗脑卒中各种并发症方面疗效显著。本课题组前期的临床研究对患者进行百会、神庭、内关和神门穴针刺治疗,已经证实通督醒神针能够改善脑卒中后患者的认知功能和精神行为症状[39-40]。在中医学的理论之中,督脉是阳脉之海,可以统领十二经脉;脑为元神之府,可以控制机体活动;心主神明,可以调控机体的思维、意识和精神。百会和神庭是督脉穴位,因此刺激它们会使阳气运至全身,保证机体各种活动正常运行。内关穴属手厥阴心包经,神门穴属手少阴心经,二者都与心脏的功能有关。针刺二者会增强心脏泵血,为大脑供血供氧,促进大脑功能恢复,改善认知障碍。有研究表明,针刺督脉穴位能够增加与突触可塑性相关蛋白的表达,进而提高大脑的学习记忆能力[41]。脑卒中发病后,脑组织处于缺血缺氧状态,Notch1受体被激活,可能会引起细胞凋亡,促进神经干细胞的增殖分化,提高突触可塑性。
基于以上理论基础和相关研究,提示通督醒神针刺法有效治疗PSCI与针刺调节Notch信号通路及突触可塑性有很大的关联。因此有以下假说:通督醒神针刺法可激活Notch信号通路,增强海马区神经元Notch1、Jagged1、NICD、Hes1表达,进而提高突触结构和功能的可塑性,促进大脑学习记忆能力的恢复,改善PSCI。故在未来设计动物实验时,可用针刺MCAO大鼠的神庭、百会、内关、神门等穴位,采取常用病理学技术观察Notch信号通路和突触改变的相关指标。在分子层面上,使用免疫荧光、免疫印迹、定量聚合酶链反应等方法检测与该通路以及突触可塑性有关的蛋白和基因表达;在突触的变化方面,用高尔基染色法观察突触和树突的结构可塑性改变,用电生理技术检测LTP的增强并记录突触的功能可塑性改变。根据以上检测和统计学分析,推测该假说是否成立,进而探讨通督醒神针刺法治疗PSCI的病理生理学机制。
4 研究与展望
综上所述,CIRI会引起神经元凋亡、神经干细胞的增殖分化和突触重塑,而大脑海马区的突触又与机体的学习记忆功能密切相关。同时,CIRI会激活Notch信号通路,进而促进突触的重塑,但这不足以与大脑缺血缺氧导致的突触结构和功能的损害相抗衡,所以需要一种外界干预措施,促进Notch通路的进一步激活,提高海马区突触的可塑性。中医针刺疗法作为治疗PSCI的一种手段,在临床上被广泛接受,并且疗效显著,但是有关针刺的分子生物学研究相对较少。现有研究发现,对于PSCI的治疗,针刺不仅可以调控Notch信号通路,而且还能提高神经元的突触可塑性。此外,通督醒神针刺法治疗PSCI在临床上有一定的疗效,但是该针法的临床评价以及机制研究仍处于初步探索阶段。因此,未来可以设计样本量充足、设计合理的动物实验来验证通督醒神针是否能够通过调控Notch信号通路提高突触可塑性,进而改善PSCI,以丰富通督醒神针刺法治疗PSCI的理论基础。

