连续性肾脏替代治疗与普通血液透析治疗慢性肾病合并心力衰竭临床作用的异同
洪 明
广州市番禺区何贤纪念医院肾内科,广东 广州 511400
慢性肾病(CKD)患者随着肾功能的不断恶化,心衰的患病率明显增加,因此心力衰竭是该疾病最常见的并发症。血液透析是一种通过相关仪器将机体内代谢废物以及血液引流至体外的肾脏替代治疗方式,但该方式因其清除速度快,不能将肌酐以及低分子毒素等物质有效清除,致使远期疗效不佳[1]。连续性肾脏替代治疗(CRRT)是一种持续进行血液净化的肾脏替代疗法,用于该疾病的治疗可能有效。基于此,样本医院进行相关研究,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2019 年4 月—2020 年9 月广州市番禺区何贤纪念医院收治的53 例CKD 合并心力衰竭患者,按照随机数表法将分为两组,对照组26例给予普通血液透析治疗,观察组27 例给予CRRT 治疗,观察两组患者心功能和肾功能。纳入标准:(1)符合慢性肾病[2]诊断标准且合并心力衰竭[3]。(2)既往无CRRT 治疗史。(3)无精神障碍疾病。排除标准:(1)伴有肝、脑等严重病变。(2)伴有全身感染性疾病。(3)具有CRRT 治疗禁忌史。对照组男17 例,女9例;年龄45~60岁,平均年龄(53.36±3.01)岁;病程1~9 个月,平均病程(5.21±1.35)个月;原发病类型为慢性肾小球肾炎10例,高血压性肾病6例,糖尿病肾病7例,多囊肾3 例;体质量指数(BMI)17~23 kg/m2,平均BMI(19.41±2.37)kg/m2。观察组男18 例,女9 例;年龄45~60岁,平均年龄(53.96±2.98)岁;病程1~9 个月,平均病程(5.31±1.48)个月;原发病类型为慢性肾小球肾炎9例,高血压性肾病7 例,糖尿病肾病7 例,多囊肾4 例;BMI 17~23 kg/m2,平均BMI(19.51±2.28)kg/m2。两组患者上述一般资料具有可比性(P>0.05)。本研究已取得医院医学伦理委员会批准且经患者及家属知晓并签署知情同意书。
1.2 方法
均予以两组患者氧疗,持续心电监护以及常规药物治疗。治疗期间若有出血症状予以4~6 h 无肝素治疗,反之则用低分子肝素进行抗凝治疗。
对照组予以普通血液透析治疗:首先经颈动脉插管,建立血管通路。血流量为150~200 mL/min,透析液量为500 mL/min;持续1 h。待滤除液达1 000~1 600 mL 时,行血液透析,2 d/次。
观察组予以连续性肾脏替代治疗:以右股静脉为通道并进行置管,使用CRRT 治疗仪(空心纤维透析器,旭化成医疗器械,国械注准20153100879)。每次治疗8~12 h,置换液量为2.5~3.0 L/h;透析液量为300 mL/min;血流量为180~220 mL/min。以上治疗方式均持续4周。
1.3 观察指标和评价标准
观察两组患者心功能以及肾功能。(1)心功能:测试6 分钟步行距离(6 MWD);运用超声仪(HDII-IE 型)检测左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室射血分数(LVEF)。(2)肾功能:治疗前后,抽取5 mL 空腹静脉血,运用全自动生化仪(山东博科科学仪器,鲁械注准20192220157 BK-1200)检测尿素氮(BUN)、肌酐(sCr)、半胱氨酸蛋白酶抑制剂C(Cys-C)。
1.4 统计学方法
采用SPSS 22.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前后心功能情况
治疗前观察组的LVEF、LVEDD、LVESD和6 MWD与对照组的LVEF、LVEDD、LVESD和6 MWD相比较,差异无统计学意义(P>0.05);治疗后观察组的LVEF、6 MWD 较对照组LVEF、6 MWD 明显改善,差异有统计学意义(P<0.05);观察组的LVEDD、LVESD较对照组LVEDD、LVESD明显减小,差异有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后心功能情况(±s)
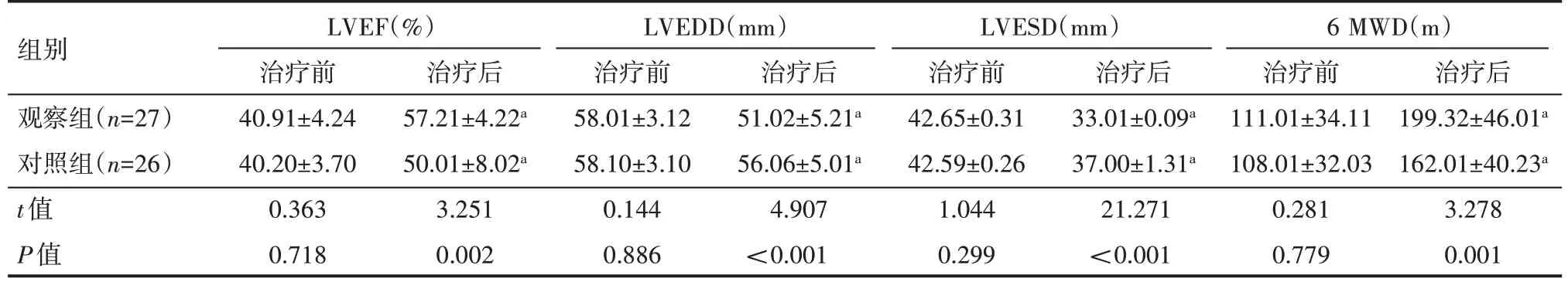
表1 两组患者治疗前后心功能情况(±s)
a表示与治疗前组内比较,P<0.05。
组别观察组(n=27)对照组(n=26)t值P值LVEF(%)治疗前40.91±4.24 40.20±3.70 0.363 0.718治疗后57.21±4.22a 50.01±8.02a 3.251 0.002 LVEDD(mm)治疗前58.01±3.12 58.10±3.10 0.144 0.886治疗后51.02±5.21a 56.06±5.01a 4.907<0.001 LVESD(mm)治疗前42.65±0.31 42.59±0.26 1.044 0.299治疗后33.01±0.09a 37.00±1.31a 21.271<0.001 6 MWD(m)治疗前111.01±34.11 108.01±32.03 0.281 0.779治疗后199.32±46.01a 162.01±40.23a 3.278 0.001
2.2 两组患者治疗前后肾功能情况
治疗前观察组的BUN、sCr、Cys-C 与对照组BUN、sCr、Cys-C 相比较,差异无统计学意义(P>0.05);治疗后,观察组的BUN、sCr、Cys-C 低于对照组BUN、sCr、Cys-C,差异有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后肾功能情况(±s)

表2 两组患者治疗前后肾功能情况(±s)
a表示与治疗前组内比较,P<0.05。
组别观察组(n=27)对照组(n=26)t值P值BUN(mmol/L)治疗前14.98±2.76 14.97±2.72 0.015 0.988治疗后10.47±3.01a 13.64±3.78a 3.754<0.001 sCr(μmol/L)治疗前151.87±26.75 152.04±27.01 0.026 0.980治疗后110.94±21.32a 138.46±24.57a 4.847<0.001 Cys-C(mg/L)治疗前2.58±0.64 2.51±0.72 0.416 0.678治疗后1.89±0.54a 2.34±0.69a 2.938 0.005
3 讨论
CKD 患者常合并心力衰竭,两者都与高发病率和死亡率有关。大量研究表明,肾功能与心血管风险之间存在负相关关系。结构性心脏病可在临床上表现为心力衰竭,是CKD 患者心血管疾病的主要原因,其患病率随着肾功能下降而增加[4-7]。一项横断面研究表明,随着估计肾小球滤过率(eGFR)的降低,左心室肥大(LVH)的患病率增加,在eGFR ≥60 mL/min·1.73 m2的患者中为32%,而 在 eGFR <30 mL/min·1.73 m2的 患 者 中 可 高 达 为75%[8]。使用具有钆增强的心脏磁共振成像的研究发现,弥漫性晚期钆增强与LVH 的程度相关,并通过组织学表明存在肌细胞紊乱和间质纤维化[9]。虽然明显的收缩功能障碍并不常见(在上述横断面超声心动图研究中仅影响8% 的患者)且与肾功能没有明显相关性,常见的表现为更细微的心室功能障碍(例如减少左心室变形、早期心肌舒张速度或减少可能导致舒张功能障碍的整体纵向应变),上述改变甚至在CKD 的早期阶段也可存在[10]。这些结构性的异常为在晚期CKD 患者中观察到的症状性心力衰竭、心律失常和心源性猝死的额外风险提供了解剖学基础[11]。相反,在因心力衰竭住院患者中,20%~68% 的心力衰竭患者患有中度至重度肾脏疾病。CKD 的存在与心力衰竭的不良预后相关,可用于对心力衰竭患者的风险进行分层[12]。心脏和肾脏之间的病理生理关系涉及许多不同的途径[13]。CKD 可能以直接损害心血管系统的方式扰乱体内平衡,或者肾脏和循环都可能受到“间接”危险因素的影响,例如糖尿病和吸烟[14]。此外,心力衰竭可能通过减少肾灌注而恶化CKD,导致肾静脉充血和激活交感神经系统和肾素—血管紧张素—醛固酮系统,这可能反过来导致炎症和氧化应激[15]。
CKD 是多重因素引起的以酸碱平衡失调、水电解质紊乱及体内代谢产物滞留等为主要临床表现的肾脏结构和功能障碍疾病,而心力衰竭是该疾病最常见的并发症,不仅加重患者病情,对其生命安全造成威胁,还加大治疗难度[16],因此积极有效的治疗方式于该类患者至关重要。血液透析通过运用扩散溶质以及对流的机制,采用布朗运动将体内血液引流至体外,并且通过弥散等原理,将透析药物按照从高到低的药物浓度进行无规律运动,清除代谢废物,达到缓解疾病的目的,亦是临床治疗该疾病最常见的治疗方式。但该方式清除速度快,而清除速度过快患者较易发生低血压以及血液灌注障碍等严重并发症,不仅使得血流动力学不稳定,还会降低肾上腺素等物质含量,进一步降低血压。CRRT 通过建立血液循环对患者体内的代谢物质进行持续清除,用于该类患者可能会弥补普通血液透析的不足。
本研究中观察组LVEDD、LVESD 低于对照组,LVEF高于对照组,6MWD 长于对照组,说明CRRT 可有效改善患者心功能。可能的原因是CRRT 治疗该疾病每次使用时间较短,清除体内代谢物质的速度较慢,并且还可将体内多余的炎性因子、毒质以及各类中分子物质一并进行清除,缓解液体潴留状态,使血流动力学保持稳定,增加心肌血液灌注量,减轻心脏前后负荷,降低LVEDD 以及LVESD,进而提高心脏射血能力,以此达到改善心功能的目的。
本研究中观察组BUN、sCr、Cys-C 均低于对照组,说明CRRT 治疗该疾病可有效改善患者肾功能,可能的原因是该方式能准确的控制液体的出入量,治疗时血液动力学稳定,而且还具有高流量血液以及高吸附的优势,可缓慢且具有连续性地过滤出机体内的大分子、小分子炎性物质、溶质以及水分等物质,溶质清除率高,可有效清除炎性介质,减轻炎性浸润,稳定内外循环,减轻脏器受损程度,进而改善肾功能。
综上所述,CRRT 治疗慢性肾病合并心力衰竭,可更好地改善及调节患者的心功能以及肾功能。

