石斛多糖提取和对体外黑色素抑制、抗干燥损伤的影响
卫梦尧,张小辉,李 飞,吴子锋,杨永志,丁金龙
(广东工业大学 生物医药学院,广东 广州 510006)
铁皮石斛(Dendrobium officinale) 是一种传统名贵中药材,其活性成分包括多糖、生物碱、多酚、微量元素和氨基酸等[1-3],其中多糖是其最主要的活性成分,2020 版《中国药典》中规定铁皮石斛中多糖含量不低于25%[4]。目前铁皮石斛多糖报道具有降血糖、抗肿瘤、保湿、保护肠胃、抗氧化和增强免疫力等作用[5-9],但在美白活性方面的报道较少[10]。
由于天然产物具有安全、温和、环保等优点,从天然植物中提取有美白和保湿功效成分来改善皮肤状态,已成为目前护肤产品开发的主要趋势[11]。酪氨酸酶是黑色素合成过程中最主要的限速酶,目前具有美白作用的植物化妆品主要通过抑制该酶来减少皮肤中黑色素形成[12]。近年来,文献报道发现多糖有抑制黑色素生成以及酪氨酸酶活性的作用[13-14]。天然产物中的多糖具有一定的吸湿保湿性能,具有开发为天然保湿剂的潜能[15],戚辉[16]用铁皮石斛水溶液进行保湿实验,表现了石斛多糖对皮肤具有保湿作用,而目前在细胞层面上反映石斛多糖保湿效果的报道较少。
已有文献报道铁皮石斛鲜条具有明显抗氧化和抑制酪氨酸酶活性作用[17]。陈默等[18]报道石斛提取物能明显抵御干燥对表皮细胞的损伤,使细胞活力增加,而石斛多糖作为铁皮石斛中最主要的成分,探究其在美白和保湿方面的活性能为石斛多糖的应用提供新思路。本文通过正交试验优化石斛多糖的提取工艺,并探究石斛多糖对B16细胞内酪氨酸酶的活性和细胞内黑色素含量的影响,通过建立HaCaT细胞干燥损伤模型,测定多糖对细胞干燥损伤的影响,以期为石斛多糖美白和保湿护肤功效产品的开发提供理论依据。
1 实验部分
1.1 试剂与仪器
铁皮石斛鲜茎,浙江;无水乙醇、硫酸、苯酚、磷酸,分析纯,广州化学试剂厂;胎牛血清、DMEM 培养基、青链霉素,美国 Gibco 公司;B16小鼠黑色素瘤细胞,武汉普诺赛生命科技有限公司;HaCaT细胞,北京北纳创联生物科技有限公司;噻唑蓝(MTT),上海阿拉丁公司。
RE-5 299旋转蒸发仪,日本岛津仪器有限公司;L6S型紫外分光光度计,上海仪电分析仪器有限公司;XH-C旋涡混匀器,常州越新仪器制造有限公司;DW-86L338超低温保存箱,中国海尔集团公司;Forma 3 111二氧化碳培养箱,美国赛默飞公司;BDSDM500倒置生物显微镜,无锡奥特光学有限公司;DW-40L508低温保存冰箱,中国海尔集团公司;Multiskan FC酶标仪,美国赛默飞公司;荧光倒置显微镜,日本OLYMPUS公司。
1.2 实验方法
1.2.1 石斛多糖的基本制备工艺流程
将铁皮石斛破碎后,水提,过滤,离心得上清液,将上清液减压浓缩后醇沉,离心弃上清,沉淀冷冻干燥得到石斛多糖[19]。
1.2.2 石斛多糖含量的测定及提取率的计算
采用苯酚−硫酸法[20]进行石斛多糖的测定,在波长490 nm处测定吸光度值,记录吸光度值,通过葡萄糖标准曲线计算多糖提取率。
1.2.3 石斛多糖提取的单因素试验
本文选用料液比、提取时间、提取次数和提取温度4个影响因素,考察影响因素对热水浸提石斛多糖提取率的影响。固定液料比1∶25,提取时间60 min,提取温度90 ℃,提取1次的基本条件,研究改变料液比(1∶15,1∶20,1∶25,1∶30)、提取时间(15,30,60,120 min)、提取次数(1,2,3,4)、提取温度(60,70,80,90 ℃)对石斛多糖提取率的影响。
1.2.4 正交试验法优化
铁皮石斛多糖提取工艺以多糖提取率为评价指标,考察热水浸提法中料液比、提取时间、提取次数和提取温度4个因素对石斛多糖提取率的影响。根据单因素实验结果确定各个因素水平,并进行L9(34) 正交试验,正交因素水平见表1。

表1 正交因素水平Table 1 Orthogonal factor and level
1.2.5 石斛多糖对B16细胞的影响
1) 细胞培养。
B16小鼠黑色素瘤细胞是一种能高表达黑色素的恶性黑色素瘤。用B16细胞建立细胞水平的评价模型,能更真实反映哺乳动物体内的酶活力变化规律[21-23]。取B16细胞复苏,置于37 ℃的CO2培养箱中培养,待细胞覆盖率达到80%~90%时,用适量胰酶消化,取 1 /4 细胞量进行传代培养,进行实验。
2) 石斛多糖对B16细胞活力的影响。
采用MTT法[24]测定细胞活力,取处于生长对数期的B16细胞以每孔5×104的细胞密度接种于96孔板,孵育24 h后,分别加入质量浓度为0,10,62.5,125,250,500 μg/mL的石斛多糖,继续孵育48 h后,加入MTT溶液,在570 nm的波长下,置于酶标仪上测定吸光度(OD)。
3) 石斛多糖对B16细胞黑色素的影响。
取处于生长对数期的B16细胞以每孔2×105的细胞密度接种于24孔板,孵育24 h后,分别加入质量浓度为0,10,125,500 μg/mL的石斛多糖和100 μg/mL的熊果苷溶液,孵育48 h后,弃上清,用PBS(磷酸缓冲盐溶液)清洗2遍,消化收集细胞,细胞悬液以10 000 r/min 离心10 min,弃上清并加入含10%DMSO的1mol/L NaOH 500 μL,于80 ℃水浴加热60 min,离心取上清液于405 nm的波长下,置于酶标仪上测定吸光度[25]。
将处于对数生长期的B16细胞以4×105个/mL接种于12孔板,24 h后,分别加入质量浓度为0,10,125,500 μg/mL石斛多糖和100 μg/mL的熊果苷溶液,孵育48 h后,弃上清,用PBS洗涤2次,采用L-多巴染色[26],用倒置荧光显微镜100倍拍照观察。
4) 石斛多糖对B16细胞酪氨酸酶活性的影响。
取处于生长对数期的B16细胞以每孔5×104的细胞密度接种于96孔板,孵育24 h后,分别加入质量浓度为0,10,62.5,125,250,500 μg/mL石斛多糖和100 μg/mL的熊果苷溶液,孵育48 h后,弃上清,用PBS冲洗2遍,加入1% TritonX-100 50 μL,放入−80 ℃冰箱冷冻1 h,随后在室温下融化,加入0.1%的L-DOPA溶液100 μL,在37 ℃反应1 h,在490 nm的波长下,置于酶标仪上测定吸光度[27]。
1.2.6 石斛多糖对HaCaT细胞活力的影响
人永生化表皮角质细胞系HaCaT是非肿瘤来源的人正常皮肤永生化角质形成细胞,具有培养条件简单和易于增殖培养等优点,将其用于抗干燥损伤实验,可从侧面反映样品在细胞层面上的保湿效果[28]。取HaCaT细胞复苏,置于37 ℃的CO2培养箱中培养,待细胞覆盖率达到80%~90%时,用适量胰酶消化,取1/4细胞量进行传代培养,进行实验。
采用MTT法[29]测定细胞活力,取处于生长对数期的HaCaT细胞以每孔5×104的细胞密度接种于96孔板,每孔100 μL,孵育24 h后,分别加入质量浓度为0,10,62.5,125,250,500 μg/mL的石斛多糖,继续孵育48 h后,加入MTT溶液,在570 nm的波长下,置于酶标仪上测定吸光度。
1.2.7 石斛多糖对HaCaT细胞干燥损伤的影响
从细胞的干燥损伤实验中检测细胞抵抗干燥死亡的能力,从而反映多糖的抗干燥作用。将处于对数生长期的 HaCaT 细胞以1 × 105个/mL的密度接种到96孔板,在0.4 m/s的干燥风速下,从孔中取出培养基,并将它们分别放在洁净工作台上5,10,15 和 20 min。然后加入培养基,继续孵育24 h。之后,吸出细胞培养基,加入MTT溶液,在570 nm的波长下,置于酶标仪上测定吸光度[30]。
实验分为空白对照组、透明质酸阳性对照组和多糖处理组,将处于对数生长期的 HaCaT 细胞以1 ×105个/mL的密度接种到 96 孔板,培养24 h后,除对照组外,以0.4 m/s的干燥风速,从孔中取出培养基,置于超净工作台上10 min,再加入100 μL不同质量浓度的多糖和100 μg/mL透明质酸,孵育 24 h,加入MTT溶液,在570 nm的波长下,置于酶标仪上测定吸光度。
1.2.8 统计学分析
采用SPSS 25.0软件进行统计学分析,所有数据均以±s表示,p<0.05为组间具有显著性差异,p<0.01为组间具有极显著差异。
2 结果与讨论
2.1 石斛多糖提取的单因素试验
不同因素对石斛多糖提取率的影响如图1所示,随着料液比的增加,多糖提取率先上升后趋向于稳定,料液比在1∶25时铁皮石斛多糖提取率最大;随着提取时间的增加,多糖提取率先上升后趋向于稳定,提取时间在60 min时铁皮石斛多糖提取率最大,提取时间再延长,多糖提取率基本趋于稳定;随着提取次数的增加,多糖提取率先上升后趋向于稳定,考虑到后续浓缩多糖溶液效率,选择提取2次较为适宜;随着提取温度的上升,多糖提取率先上升后下降,提取温度在70 ℃时铁皮石斛多糖提取率最大,温度再升高反而使得多糖提取率下降,这可能是由于温度过高导致糖醛酸分解。
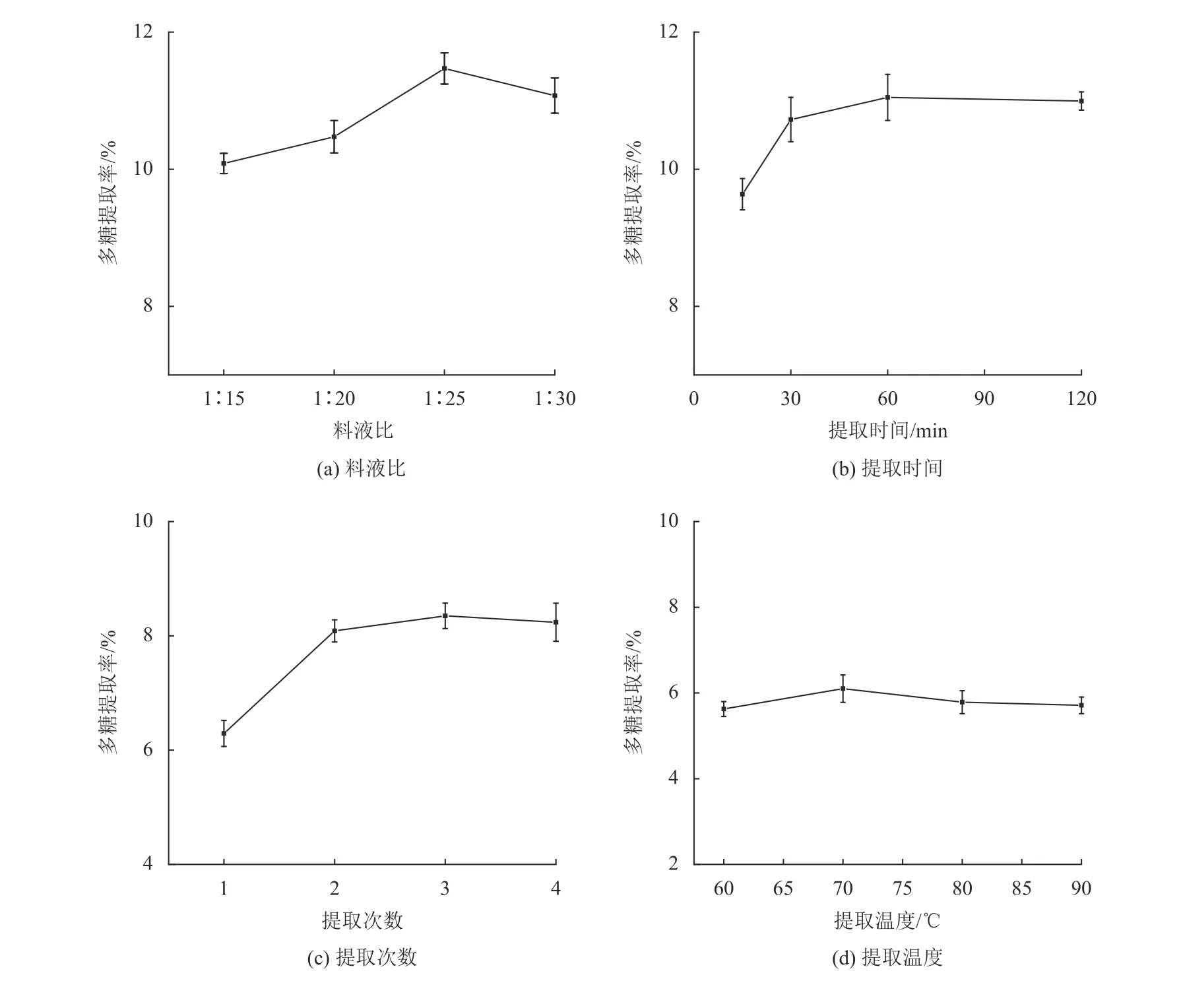
图1 不同因素对石斛多糖提取率的影响Fig.1 The influence of different factors on the extraction rate of Dendrobium polysaccharides
2.2 正交试验结果分析
2.2.1 正交试验
在单因素实验结果基础上,设计展开L9(34) 正交试验,正交试验结果见表2,方差分析结果见表3。从结果得出,试验指标中多糖提取率越大越好,从K值得出铁皮石斛多糖的最佳提取条件为A1B1C2D1,即提取时间60 min、料液比1∶20、提取次数2次、提取温度60 ℃。由方差分析结果可知,因素C对铁皮石斛多糖提取率有显著影响(p<0.05) ,因素A、B、D对石斛多糖提取率无显著影响(p>0.05) ,对石斛多糖提取率影响的主要顺序为C>B>D>A,即提取次数、料液比、提取温度、提取时间,与直观分析结果一致。
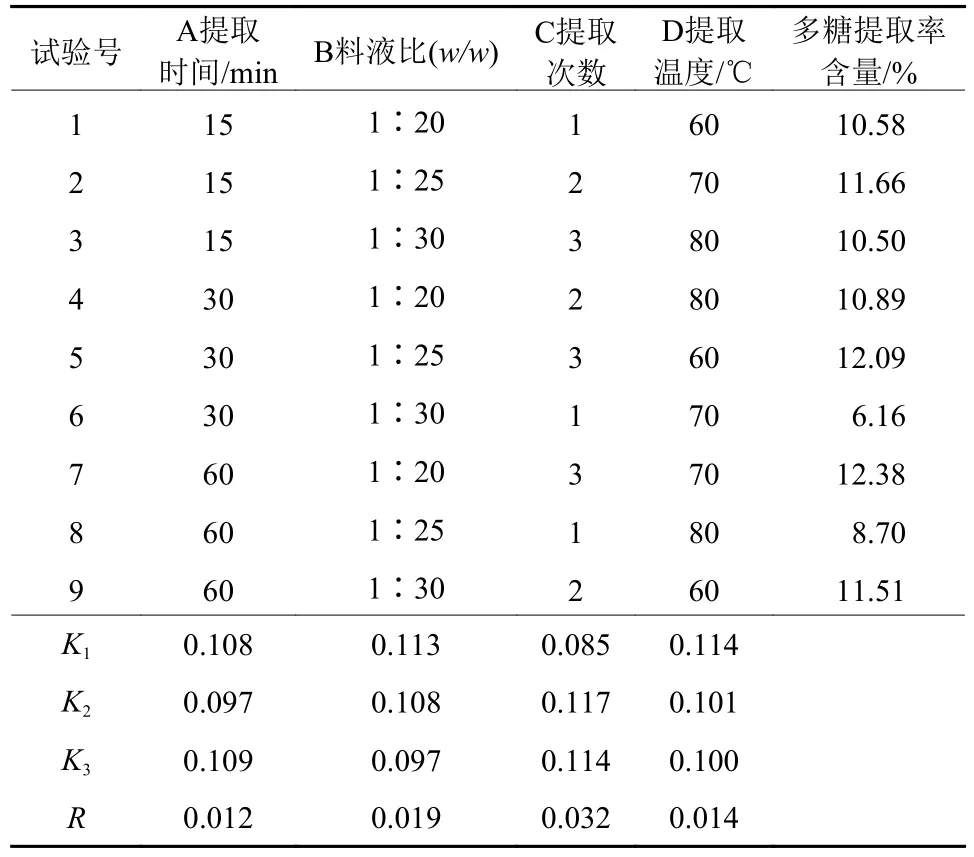
表2 正交试验结果Table 2 Orthogonal test results
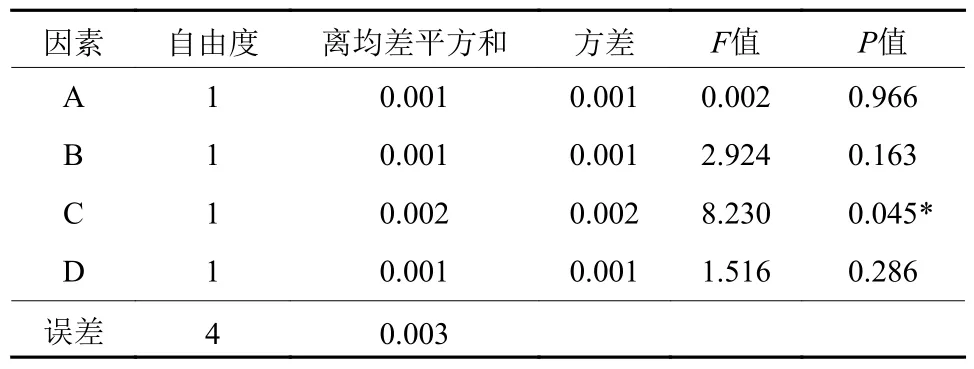
表3 方差分析1)Table 3 Analysis of variance
2.2.2 验证试验
利用正交试验得到的最优提取工艺(提取时间60 min、料液比1∶20、提取次数2次、提取温度60℃),重复3组石斛多糖提取试验。结果石斛多糖提取率为(12.45±0.09)%,这个结果与正交试验表中最高提取率12.38%接近,说明正交试验优选出来的最佳提取工艺条件准确可靠。
2.3 石斛多糖对B16细胞的影响
2.3.1 石斛多糖对B16细胞活力的影响
由图2可见,石斛多糖在试验质量浓度范围10~500 μg/mL 时,B16细胞活力均在90%以上,与空白对照组相比,差异无统计学意义(p>0.05)。说明石斛多糖在实验浓度范围内对B16细胞活力无明显影响,表明石斛多糖对B16细胞无毒性。
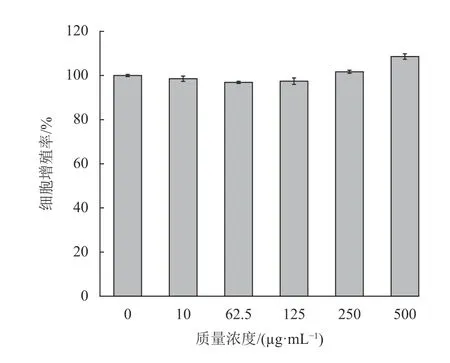
图2 石斛多糖对B16细胞活力的影响Fig.2 The effect of polysaccharides on the cell viability rate of B16 cells
2.3.2 石斛多糖对B16细胞黑色素含量的影响
石斛多糖对B16细胞内黑色素的含量影响如图3所示,实验结果表明高浓度的石斛多糖对细胞内黑色素的生成有一定的抑制作用(p<0.01)。且对细胞内的黑色素生成的抑制呈剂量依赖性,当石斛多糖质量浓度在500 μg/mL时黑色素的含量为(66.20±3.77)%,阳性对照熊果苷组的黑色素含量为(67.64±2.19)%,与熊果苷组相比,石斛多糖有抑制黑色素生成能力。
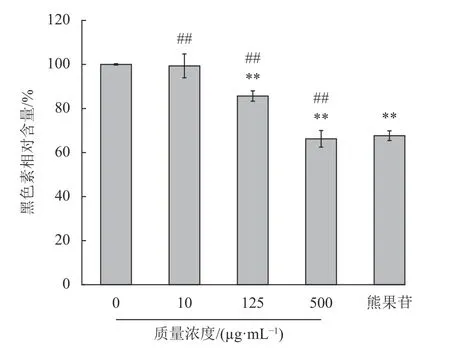
图3 石斛多糖对B16细胞黑色素相对含量的影响Fig.3 Effect of polysaccharides on the melanin content of B16 cells
细胞多巴染色结果如图4所示。相比于空白对照组,可以看到500 μg/mL的石斛多糖(DOP)和熊果苷组的黑色素生成量更少,并与上述对黑色素含量的影响结果相一致。
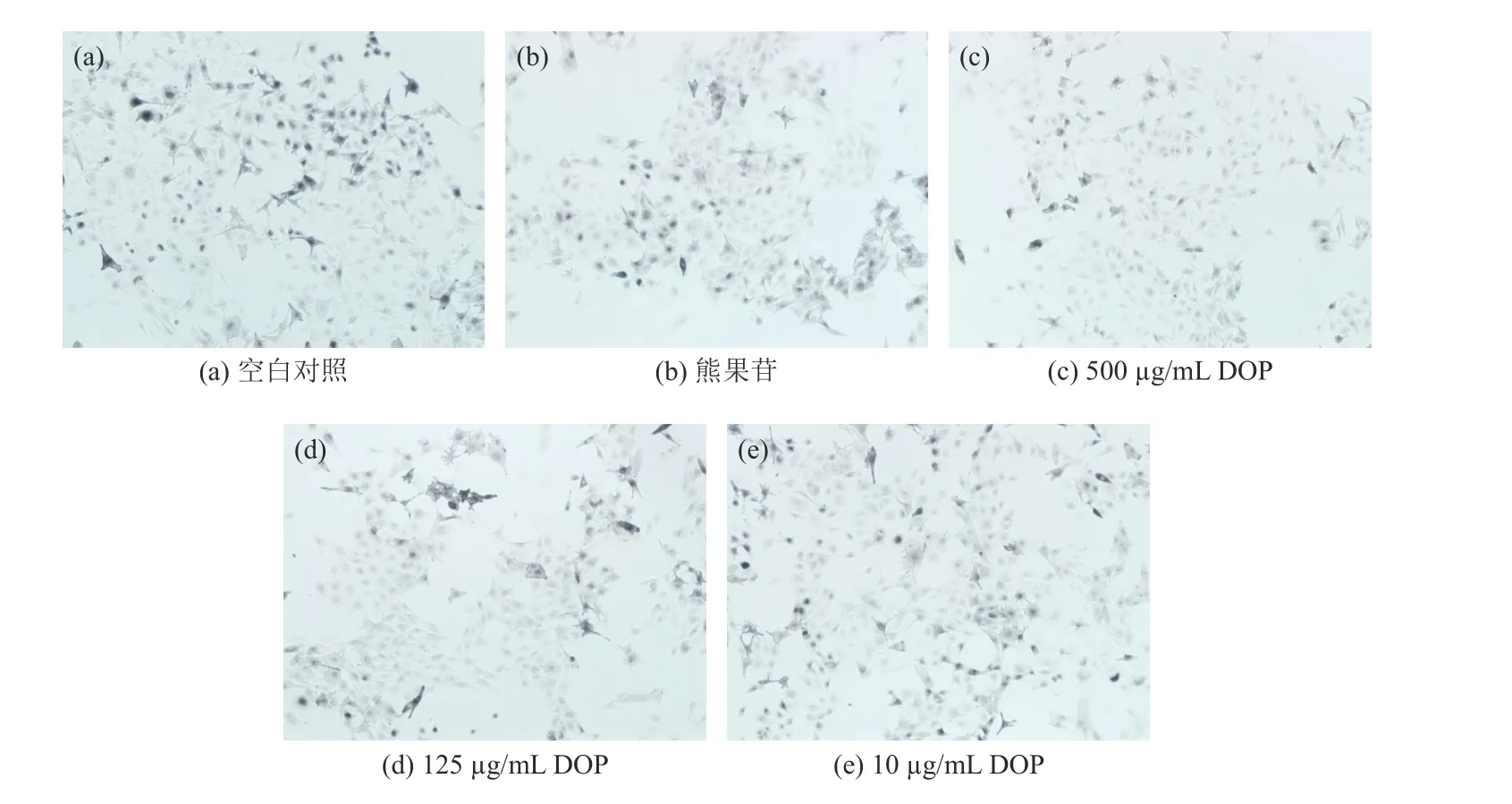
图4 B16 细胞的左旋多巴染色图像(100×)Fig.4 L-dopa staining image of B16 cells (100×)
2.3.3 石斛多糖对B16细胞酪氨酸酶活性的影响
酪氨酸酶是黑色素生成的关键酶,其活性越低,产生的黑色素含量越少[31]。实验结果如图5所示,石斛多糖和阳性对照熊果苷组均对酪氨酸酶活性有抑制效果(p<0.01)。石斛多糖在500 μg/mL时酪氨酸酶活性为(69.30±3.84)%;而熊果苷组的酪氨酸酶活性为(69.50±1.79)%,所以石斛多糖可以抑制酪氨酸酶的活性。陈金妹[17]研究发现,铁皮石斛水提物对酪氨酸酶活性有抑制作用,而多糖作为铁皮石斛水提物的最主要成分,可能是起抑制作用的重要成分。结合前人研究,推测石斛多糖可通过抑制酪氨酸酶的活性,从而抑制黑色素的生成。
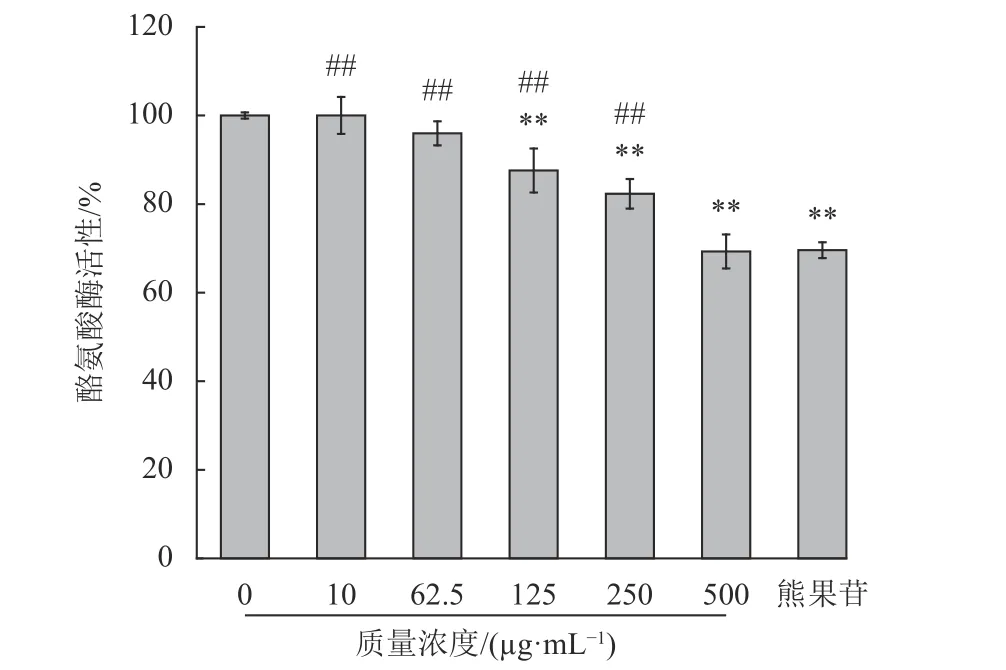
图5 石斛多糖对B16细胞酪氨酸酶活性的影响Fig.5 Effects of polysaccharides on tyrosinase activity of B16 cells
在实验浓度范围内,石斛多糖对B16细胞活力无影响,无细胞毒性;在多糖质量浓度为500 μg/mL时,酪氨酸酶活性为(69.30±3.84)%,黑色素含量为(66.20±3.77)%。多糖的浓度越大,其酪氨酸酶活性和黑色素含量就越低,且存在浓度依赖。
综合石斛多糖对酪氨酸酶活性与黑色素生成的影响,说明石斛多糖可以通过抑制黑色素合成的酪氨酸酶的活性[32],从而减少细胞内黑色素的生成量。
2.3.4 石斛多糖对HaCaT细胞活力的影响
由图6可见,石斛多糖在试验质量浓度范围10~500 μg/mL 时,HaCaT细胞活力均在90%以上,与空白对照组相比,差异无统计学意义(p>0.05) 。说明石斛多糖在实验浓度范围内对HaCaT细胞活力无明显影响,表明石斛多糖对HaCaT细胞无毒性。
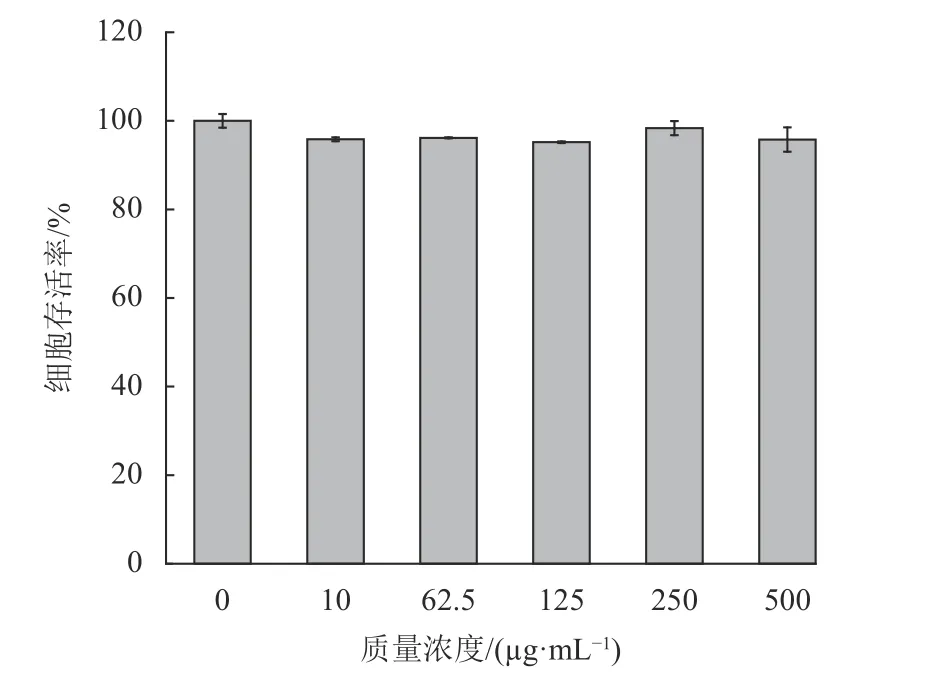
图6 石斛多糖对HaCaT活力的影响Fig.6 The effect of polysaccharides on the cell viability rate of HaCaT cells
2.3.5 石斛多糖对HaCaT细胞干燥损伤的影响
建立一个合适的细胞干燥损伤模型,检测细胞抵抗干燥的能力,从而反映多糖的保湿性能,细胞干燥死亡率越低,则多糖的保湿功效越好[15]。不同风干时间对细胞活力的影响如图7(a)所示,当干燥时间为10 min时,细胞存活率为(74.83±0.82)%,此时细胞的风干死亡结果更稳定,所以选择细胞干燥模型干燥10 min。
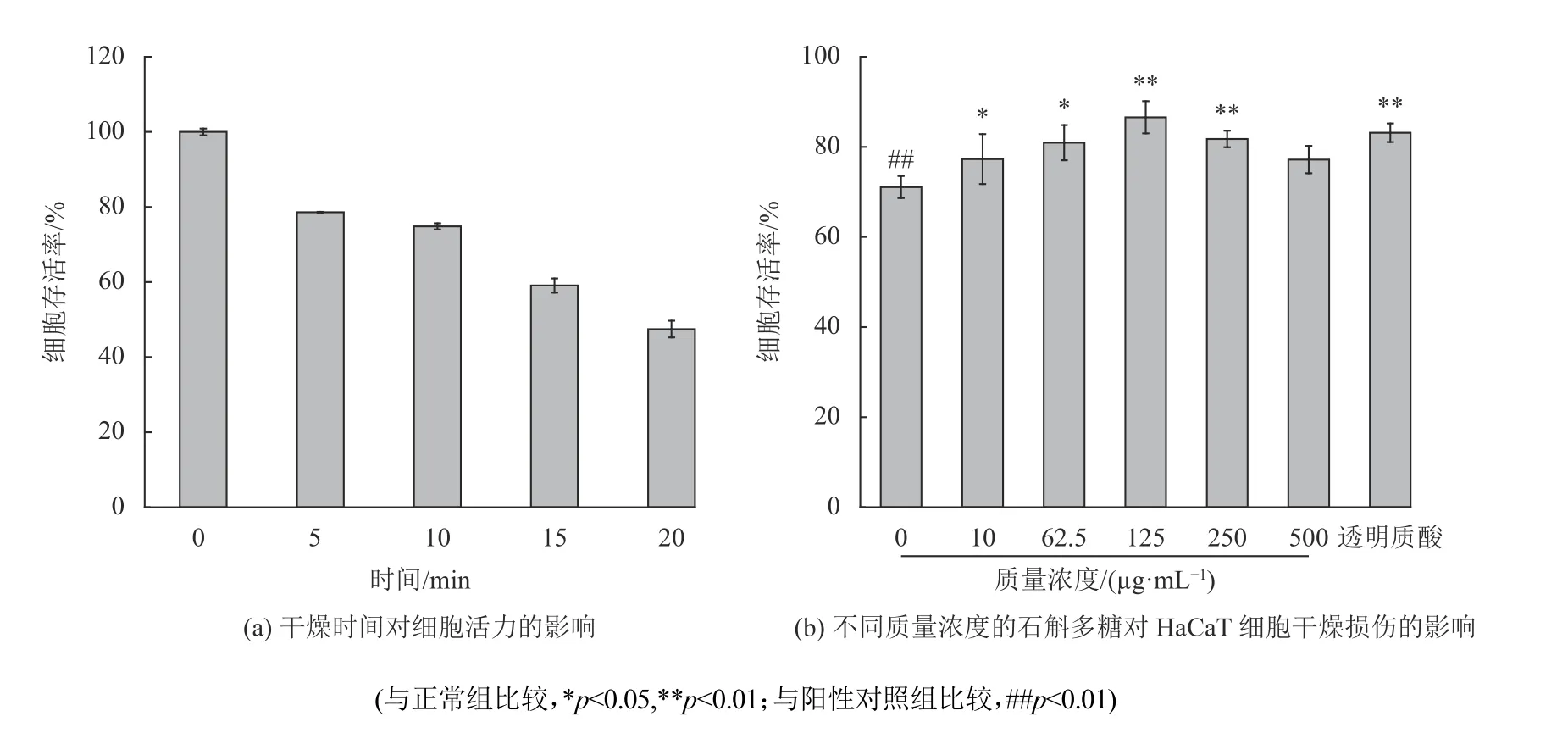
图7 石斛多糖对HaCaT细胞干燥损伤的影响Fig.7 The effect of polysaccharides on HaCaT cells desiccation injury
不同质量浓度的多糖对干燥损伤细胞的修复作用如图7(b)所示。与透明质酸阳性对照组相比,不同浓度的石斛多糖均减少了因干燥损伤导致的细胞死亡率。100 μg/mL的透明质酸阳性对照组细胞存活率为(86.14±2.10)%,而石斛多糖在125 μg/mL时的细胞存活率,由空白对照组的(71.07±2.44)%提高至(86.58±3.58)%。
纪漫[30]提取的龙眼核活性脂质对干燥损伤的HaCaT细胞有保护和修复作用,上调干燥损伤的HaCaT 细胞中的HA(透明质酸)和AQP3(水通道蛋白3)水平。陈默[18]等提取的铁皮石斛多糖提取物的保湿效果能显著抵御干燥对表皮细胞的损伤。结合实验结果,铁皮石斛中的多糖对细胞的干燥损伤修复起主要作用,可能也通过上调HA和AQP3水平提高细胞自身抗干燥损伤能力,在分子水平上促进干燥损伤细胞产生保湿物质,从而提高细胞自身抗干燥损伤能力,增强皮肤的保湿作用。
3 结论
(1) 采用水提醇沉法提取石斛多糖,优选铁皮石斛多糖提取工艺最佳条件,提取时间为60 min、料液比为1∶20、提取次数2次、提取温度为60 ℃;该工艺条件下石斛多糖的提取率为12.45%。
(2) 采用B16细胞模型,发现石斛多糖可以通过抑制黑色素合成关键酶的活性,从而减少细胞内黑色素的生成量。
(3) 建立HaCaT细胞干燥死亡模型,发现石斛多糖可以提高细胞在干燥损伤中的存活率,减少细胞干燥损伤造成的死亡。
(4) 本文研究结果可为铁皮石斛多糖的产业化开发和在美白保湿类产品中的应用提供参考和依据。

