土壤生物膜的生态功能及其研究方法综述
李宇佳 文翊 骆乐丹 赵升 欧阳凯


摘要:生物膜是指微生物附着于接触表面并分泌多糖基质、脂质蛋白和胞外DNA等物质包裹自身而形成的微生物微团聚体。生物膜的形成是微生物适应自然环境的一种生存策略。生物膜具有各种各样的功能特性(吸附性、抗药性、降解性等),在環境保护领域具有广大的应用前景。近年来,生物膜已经成为各大领域的研究热点,在工业、医学、水环境等领域都有其身影,但在土壤环境中的研究报道较少。主要介绍了土壤生物膜的组成及其形成过程,并对土壤生物膜高效摄取养分、抵御外部环境危害和充当胞外消化系统等重要生态功能进行综述;同时比较分析了几种常见的生物膜培养装置(微量滴定板、卡尔加里培养、生物膜环、流动池、微流体等)和检测技术(染色法、荧光原位杂交、光学相干断层扫描、激光共聚焦显微镜、原子力显微镜等)的优缺点;最后对生物膜在土壤环境相关方面的研究潜力提出展望,旨在深入理解土壤生物膜与土壤各组分之间的相互作用,为提高土壤微生物的生态环境效益提供理论依据。
关键词:土壤生物膜;生物膜功能;培养装置;检测技术
中图分类号:S154.3 文献标志码:A
文章编号:1002-1302(2023)10-0001-10
收稿日期:2022-07-30
基金项目:国家自然科学基金青年基金(编号:42007021);中国博士后科学基金(编号:2020M672498);湖南农业大学青年基金(编号:19QN39)。
作者简介:李宇佳(1997—),男,湖南娄底人,硕士,主要研究方向为土壤生物化学。E-mail:814708233@qq.com。
通信作者:欧阳凯,博士,副教授,主要研究方向为土壤矿物-有机物-微生物界面互作与环境、土壤生物膜的生态环境效应。E-mail:Kai_ouyang@hunau.edu.cn。
微生物在介质聚集,通过自身分泌物质相互联系形成一层胶状薄膜,即生物膜。在土壤生态系统中,几乎有99%的微生物以生物膜形式存在[1]。土壤环境是微生物的最大聚集地之一,微生物群落结构多种多样,为土壤生物膜的形成提供了良好的物质条件[2]。土壤微生物以土壤颗粒或植物根系作为界面进行吸附,释放土壤颗粒中的矿质元素或与植物进行物质交换,为土壤生物膜的生长发育提供营养物质[3]。土壤生物膜的形成可以对土壤结构和质量进行改良,增加土壤对外界不良环境的抵御能力,在提高农作物产量和保护农业环境方面有着重大的潜力[4]。
已有研究表明,单一或多物种形成的土壤生物膜能够定殖在矿物表面、土壤孔隙和植物根部等基质或界面上[5-7]。在生物膜的形成过程中,微生物通过分泌胞外聚合物将细胞聚合在一起,同时黏附在物质表面[8]。与单一物种形成的生物膜相比,多物种生物膜的竞争优势更明显,能更好地适应环境的变化。例如在缺水时期,多物种生物膜有更高的耐受性,并促进细菌水平基因的转移[9]。Koele 等研究了在不良外部环境条件下松树根际细菌生物膜对植物养分情况的影响,发现土壤中含碳物质的矿化速率随生物膜的生长而加快,植物根系获得更多的养分,以此来缓解外部环境的侵蚀[10]。土壤生物膜的发育会改变土壤的理化性质,例如土壤孔隙中生物膜的形成会堵塞或缩小孔隙,从而降低土壤的含水量和水分的入渗[11-12]。生物膜具有致密且稳定的结构,对土壤中的有毒有害物质具有较高的耐受能力,对作物的生长发育具有促进作用。土壤生物膜提高了微生物在环境胁迫下的存活率,在土壤的形成和发育过程中承担着至关重要的作用。
随着对土壤生物膜研究的深入,现已获得了一些重要的成就和突破。总结前人的研究不难发现,以往的绝大多数研究主要考察的是土壤中单一物种微生物形成的生物膜。如Ouyang等研究了腐殖酸介导下纳米颗粒对恶臭假单胞菌KT2440生物膜形成的影响,发现不同的生物膜形成阶段对纳米颗粒的耐受性不同,且腐殖酸能够减轻纳米颗粒对细菌生物膜形成的抑制作用[13]。Ma等将土壤矿物(蒙脱石、高岭石、针铁矿)与枯草芽孢杆菌两两混合培养,研究生物膜在矿物表面的形成状况,结果表明3种土壤矿物表面形成的生物膜具有显著的差异,且这种差异是由土壤矿物质表面的理化性质不同所造成[5]。Xing等研究在蒙脱石影响下Serratia marcescens S14对Cd2+的吸附效应,证实了低浓度Cd2+和蒙脱石或其组合能够促进生物膜形成;相较于游离态的细菌,生物膜对Cd2+的吸附量增加了15倍[14]。在自然状态下,土壤生物膜主要是以多种微生物相互聚集而形成。本文简要综述了土壤多物种生物膜的形成过程和功能及其对土壤改良、生态环境方面的影响;同时介绍了几种常用的多物种生物膜培养方法和检测技术及其优缺点,期望这些方法有助于加深对生物膜形成机制、结构、组成及功能的理解。
1 生物膜的形成及生态功能
Donlan等通过扫描电子显微镜和激光共聚焦扫描显微镜等仪器观测到了生物膜的形态和结构,他们将生物膜定义为一种包含在自身分泌的胞外聚合物(EPS)中的复杂生物群落[15]。自然界中的生物膜不是由单个微生物形成,而是由多种微生物相互聚合在一起,黏附于物体表面,并且能够通过基因表达来适应环境的变化。生物膜可以黏附在许多界面上,例如生物组织、医疗器械、污水管道、作物根系、土壤颗粒等各种自然或非自然界面[5,16-18]。与游离细菌相比,生物膜分泌的EPS能够为包裹在内的细菌提供营养物质、响应外界不良环境的刺激;同时也可作为生物膜外部消化系统增强细胞的代谢能力[7,19-20]。
1.1 土壤生物膜的组成和形成过程
土壤生物膜主要由两部分组成,即微生物细胞和分泌的EPS。从微生物黏附开始,随后产生和积累由1种或多种聚合物质组成的细胞外基质,如蛋白质、多糖、腐殖酸物质、细胞外DNA(eDNA),有时还有其他分子,如参与细胞间通讯的信号分子[8],其中含量占比最多的是多糖和蛋白质。
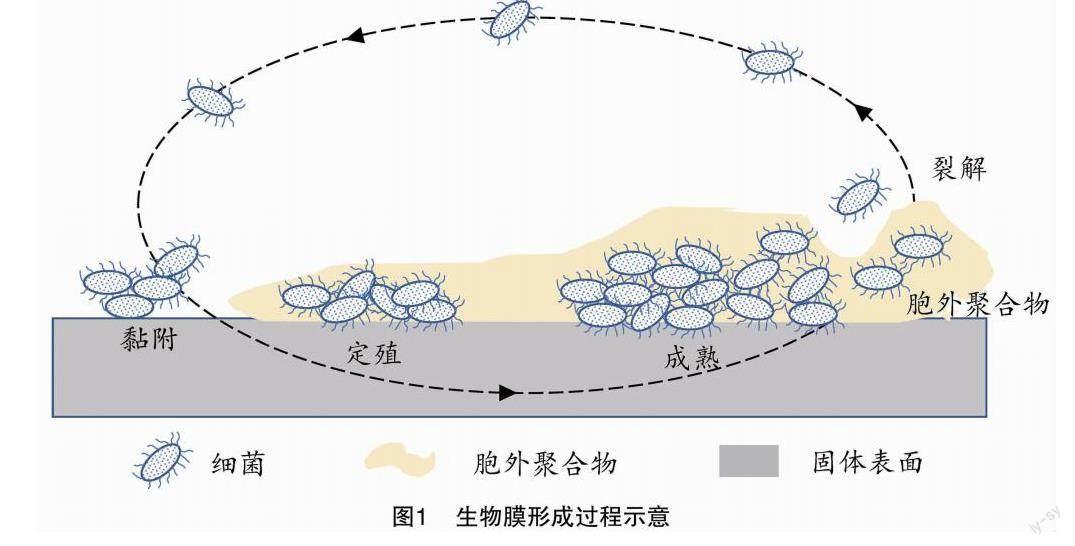
土壤生物膜的形成不是一个恒定的过程,它会根据外部环境的变化来作出相对应的动态响应。在自然生态环境中,土壤生物膜的形成是一个复杂并由多种微生物相互作用的过程,膜内各种微生物通过一系列的基因表达来应对外部环境的刺激。土壤生物膜的形成过程一般可划分成4个阶段(图1)。第一阶段为微生物的黏附。微生物在物质界面的黏附作用是生物膜形成的开始,微生物通过土壤空气的流动到达物质界面,经过布朗运动、鞭毛运动、物理化学运动等运动方式相互聚集在一起,同时分泌出多糖、鞭毛蛋白等胞外基质形成初步黏附[21]。起始阶段,由于胞外基质分泌较少导致细胞与物质界面联系不紧密,呈现的是可逆状态的黏附作用;但随着微生物分泌胞外物质(多糖、蛋白质、脂质和eDNA等)的增加,达到足以改变自身的形态特征时,生物膜与物质表面形成紧密的黏附,呈现出不可逆状态[8]。第二阶段为生物膜的初步形成。包裹在膜内的各种微生物快速地生长繁殖、分裂,并不断积累空气流动中的游离微生物,在界面上分散、扩大形成具有一定形态的菌落聚集体[22-23]。第三阶段为生物膜的成熟,各种微生物之间以胞外基质为基础相互联系,构建出成熟稳定的三维立体生物膜;这一阶段形成的生物膜具有特定的空间结构和功能,并且能够对外界的不良刺激做出响应[24]。第四阶段为生物膜的分解阶段。因在有限空间内养分的耗尽或有毒物质的超负荷造成生物膜结构崩塌,生物膜细胞发生解体回归游离状态进入外部环境,它们也可能在新的界面重新黏附形成新的生物膜,这一过程是生物膜的传播和更新[25]。
1.2 生物膜的功能
生物膜可以被看成是一座“围城”,胞外基质就是“城墙”,它能够保护膜内细胞避免遭外部极端环境的干扰。大量具有功能多样性的官能团存在于生物膜表面,为生物膜发育提供了许多好处,例如:营养物质的吸收、调控膜内物质的稳定以及对外界环境变化的响应等。生物膜的胞外消化系统存在于生物膜内部,由微生物分泌的胞外聚合物质和酶组成,通过它们来吸收外界的水分和养料物质,同时膜内的酶能够分解自身的基底物质来获取养分[26]。
1.2.1 高效摄取养分
生物膜形成后,微生物获取养分的效率要显著高于单个游离态微生物。生物膜摄取养分主要依赖于微生物细胞所分泌的EPS,EPS能促进外部环境与生物膜间的物质运输和能量交换,如养分吸收、气体排放以及各种离子、分子交换等[27]。
生物膜获取养分的过程十分复杂,细胞质、细胞壁和细胞外基质等不同部位的吸收机制和结合位点各不相同, 使环境中的阴离子和阳离子都能够被吸收,当生物膜内存在养分浓度梯度差时,营养物质以吸收位点为通道进入膜内细胞[28]。即使在浓度很低的营养环境条件下,生物膜也能通过这种吸附作用使微生物存活下来。生物膜的吸附作用是被动运输,在运输养分的同时也会有有毒物质的运输,有毒物质的积累会损害生物膜的结构甚至会造成其崩坏[29]。生物膜结构破坏后,部分细胞死亡或裂解,细胞残体会保存在胞外基质中被酶降解形成养分提供给其他细胞。Pinchuk等发现, 在枯草芽孢杆菌生物膜中,死亡细胞的DNA会被胞外酶分解形成磷源和碳源,为其他活性细胞提供能量[30]。相比于游离微生物,形成生物膜的微生物有更广泛的养分来源,生物膜中所有的成分都会留在细胞外基质中,形成有效的物质循环。
1.2.2 抵御外部环境胁迫
生物膜的EPS能够对金属阳离子进行阻隔作用,防止其进入膜内。Geng等通过研究发现,EPS能够聚集外部环境中的铅、镉、锌等重金属离子[31]。生物膜的形成会受到这种聚集作用影响,这种聚集作用也能促进生态环境中金属的运输。当过高的重金属离子浓度对细菌有损伤刺激时,生物膜会聚集铜、锌、铁、铝等重金属阳离子来进行络合作用或沉淀,减少其对生物膜的毒害[32]。
生物膜内含有大量的腐殖质和活化酶,能够增强微生物对干旱、高温等不利环境的耐受能力。在干旱环境下,疏水分子会不断地积累在生物膜基质中,减少生物膜中水分的流失,同时形成一层保护屏障来降低水分的蒸发以此来保护生物膜。Weaver等将缺水生物膜放回水分充足的环境中发现,原本因缺水而失活的酶重新活跃起来[33];对比未形成生物膜的浮游细菌,拥有胞外基质保护的膜内细菌有更高的干旱耐受性[34]。可见,生物膜的形成是微生物保护自身免受外部环境迫害的一种生存策略,不同微生物间相互作用分泌各种活性物质来抵御不良环境的危害,提高了微生物的存活机率。
1.2.3 充当胞外消化系统
生物膜内细胞分泌的胞外酶会存储在生物膜胞外基质中,胞外酶可以和胞外聚合物质相互作用[8]。游离态细菌分泌的胞外酶没有胞外基质进行依托,因此会随着细菌的移动而扩散,逐渐远离细胞,所以其胞外酶的作用效果并不明显;而生物膜分泌的胞外酶相对集中,可以更有效地利用胞外酶去降解物质而转化成自身所需的养分物质,胞外基质就像是生物膜的一个胞外代谢系统[35]。已经有多种细胞外酶被发现存在于陆地和水生生态系统中[36]。生物膜中的胞外酶是所有膜内微生物都可以驱使的,不局限于某一类微生物。Worm等通过研究蛋白水解和非蛋白水解铜绿假单胞菌形成的生物膜,发现蛋白水解细菌分泌的降解酶可以分解非蛋白水解细菌分泌的蛋白质,生物膜中所有微生物能够共享膜内细胞分泌的酶[37]。生物膜中不同种类的微生物分泌各种胞外酶进入胞外基质中,胞外酶的效果各不相同,极大地提高了生物膜中各种物质的消化效率,增加了养分来源。
除上述3种功能外,其他功能还包括吸附重金属离子[38]、降解抗生素[39]、提高土壤养分[40]等。生物膜已然成为研究热点,近些年也不断涌现出各种生物膜的培养装置以及檢测技术,有关生物膜的常见培养装置及关键测定技术总结如下。
2 生物膜的培养装置
生物膜的培养因对数据获取的精度要求不同而有所差异。以下介绍了几种培养装置,并将其优缺点简单的总结在表1中。
2.1 微量滴定板法
利用微量滴定板(图2)培养生物膜是最常用的方法[41]。将菌液置于微孔中,在适当温度下静置培养,细菌生物膜会在孔壁上形成。在不同时间段对附着在滴定板孔表面上的生物膜进行染色之前,需要将孔清洗并且去除浮游细菌。微量滴定板分析是通过测定所有附着的细胞来计算生物膜生物量。但是,生物量的一部分可能是沉积在孔底部的细胞,被胞外聚合物所隐藏。因此,这种方式所得到的数据并不太精确。
2.2 卡尔加里培养装置
在卡尔加里装置(图2)中,生物膜的形成是在盖子上进行,盖子由安装在含有生长培养基和微生物的微量滴定板孔中的销钉组成。生物膜附着在销钉上,这就避免了细胞的沉积,体现了生物膜的黏附。在该装置中,生物量定量需要用到超声波来回收细胞,这就造成了一定的限制。可能只有部分细胞能够通过超声波进行悬浮,通常在群落的 5%~90%之间[49-50];分离群体的生理特性也不能够完全反应出黏附细胞的生理特性,因为不同群体在材料上可能表现出不同的黏附和分离特性[51]。
2.3 生物膜环装置
生物膜环装置(图3)是一种用于研究生物膜形成早期阶段的方法[43,52],该装置主要基于细菌在表面形成生物膜时固定微球的能力。将细菌悬浮液与顺磁性微球混合,然后装入微量滴定板的孔中进行培养,在不同时间点进行直接测量,无需任何染色和清洗步骤。首先,在孔上覆盖一层对比液(一种惰性不透明油),能够使用专门的生物膜环扫描仪器读取微量滴定板;然后将滴定板放置在一个由单个磁铁组成的块上,在孔底部中间放置1 min。磁铁作用后,游离(未堵塞)的磁性微珠集中在孔底部中心位置,形成一个黑色圆点或圆环;而被细胞固定的则保持在原位置。生物膜环装置不需要对最初接种物进行干预,如染色或固定,从而避免了人员操作上的结果偏差。但与微量滴定板一样,生物膜环装置对重力沉降很敏感,然而由于其主要用于早期生物膜形成时,这个问题可能不那么重要。
2.4 流室法
流室法是一种动态培养生物膜的方式,由通过管道连接的2个液室组成(图4)。启动流动泵, 将适当浓度的菌液通过玻片,使细菌能够依附在玻片表面,培养液从一个液室流出,穿过流动池,然后被另一个液室收集,黏附在玻片上的细菌逐渐向生物膜发展。在这种流动的方式中,培养液会对生物膜产生一种冲刷力,即剪切力,对生物膜的生长和发育产生相当重要的作用[44]。同时,生物膜的生长状况可以利用显微镜进行实时监测。流室法由于剪切力的存在所以会淘汰掉黏附能力弱的细菌,形成的生物膜量相对来说较少,并且保持装置良好的气密性并防止渗漏是一大难点。但流室法可以直接接触生物膜并取样,能够对生物膜的生长状况进行实时监测,如细菌的黏附、初始菌落的形成和成熟生物膜结构的建立等。
2.5 微流体装置
微流体提供了一个封闭的系统,生物膜可以与水动力环境相互作用,并能够开发数学模型来解释这些相互作用的影响;同时,也可以揭示水动力条件对生物膜发育的影响[46]。目前,现有的微流控装置可以分为连续流动装置、纸基装置和数字微流控装置[53],由通道、腔室、多孔壁、夹缝等结构组成的微流体可制成人工微观生态系统。微流控系统中的捕获设备通常是光学显微镜(常规、荧光或共聚焦激光显微镜),为了追踪微生物细胞,显微镜需要自动聚焦和焦点偏移补偿或者收集高分辨率图像数据,通过对图像和数据的处理获取所需信息[47]。与传统的方法相比,微流控的精度可达亚细胞,因此可从单细胞尺度上实现不同物理化学特性的生境[54];液体流动的性质能够调节养分、空气、温度等环境因素与生物膜之间的相互作用[55]。
3 生物膜的检测技术
生物膜的生物量和活力可以通过微生物学或分子学方法来检测,主要依赖于生物膜的物理和化学特性;显微镜技术可以更直观地描述生物膜的空间结构、异质性及其与群落功能的联系。表2总结了常用到的生物膜检测技术及其优缺点。
3.1 染色法
如图5所示,利用生物膜内物质(如EPS)对某些染料或荧光染料的特异性结合和吸附,可以通过染色的办法对生物膜进行间接性定量测定。这种检测方法可对活细胞、死细胞以及生物膜基质中存在的一些成分进行染色,因此非常适合于定量生物膜总生物量[56]。染色法适用于各种生物膜生物量的测定,但在洗涤染液过程中如操作不当可能会分离和去除固着的细菌细胞,导致数据产生人工误差,因此洗涤时需要控制好冲洗强度。
3.2 荧光原位杂交(fluorescent in situ hydridization,FISH)
荧光原位杂交(图6)利用荧光染料直接或间接标记核酸探针,待标记的探针与样本的核酸序列碱基互补杂交后,将其置于显微镜下观察。荧光染料的多样性使得生物膜的观察更具选择性。这种技术的应用能够让我们更深层次地对生物膜内部物质的分布有所认识[21],同时也能明确生物膜应对外界环境变化时基因的表达和调控。荧光原位杂交能够通过使用组合标记技术识别更多的物种,其中每个物种用多个荧光探针标记,然后光谱成像,对多物种生物膜形成的研究具有重大的意义。
3.3 光学相干断层扫描(optical coherence tomography,OCT)
光学相干断层扫描(图7)是近年来发展较快的一种最具发展前景的新型层析成像技术,利用宽带光源的低时间相干性分辨检测样品不同深度的反射光或背散射光,以获取样品的断层扫描图像。它能够检测生物膜不同深度层面的入射信号,通过扫描可以得到生物膜的三维结构图像,具有快速、无接触、无损伤、成像分辨率高的优点。Dreszer等对超滤膜表面生物膜应用OCT进行了觀测,发现生物膜呈“蘑菇”状突起结构,且生物膜厚度的局部差异是由这种突起结构所引起[68]。
3.4 激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)
激光共聚焦掃描显微镜(图8)出现在20世纪后期,是一种广泛应用的新技术。它将一些现代科学技术(如激光、电子摄像、计算机图像处理等)相结合,是研究生物膜常用和有效的原位观测仪器。
CLSM在传统荧光多功能显微镜成像的基础上安装了激光扫描装置,通过紫外线或可见光触发荧光探测器,并利用计算机对所观测的对象进行数码影像处理观察、数据分析并传输,由此获得了生物膜内微观构造的荧光图像信息。其最大的优势是可以对生物膜进行断层扫描和成像,无损伤地观测和分析生物膜的三维空间结构[62],能够得到生物膜的厚度、粗糙度等信息。Xue等分别将铜绿假单胞菌和突变菌形成的生物膜进行染色,用激光共聚焦显微镜成像后发现,与铜绿假单胞菌生物膜相比,突变菌生物膜的厚度显著降低,粗糙度显著增加[69]。
3.5 原子力显微镜(atomic force microscope,AFM)
原子力显微镜是一种功能强大的、无损生物样品的纳米到微米级成像技术(图9),通过测量生物试样表面与一些微力敏感元件间的极轻微的原子间作用力,来探究生物膜表面的构造和特性。原子力显微镜通过扫描样本可以再现生物膜的三维结构图;样品不需要进行前处理,没有二次伤害;能够测定生物膜细胞水平或分子水平上的硬度、弹性、黏性等机械结构[70]。Oh等利用原子力显微镜对生物膜的压痕进行测定,结果表明成熟的生物膜会积累胞外聚合物,促使生物膜细胞的弹性和黏性得以增强[71]。Steinberger 等在纳米级尺度上利用原子力显微镜对铜绿假单胞菌生物膜进行观察发现,在低浓度环境条件下,细菌主要以增加菌体长度的策略来应对外界环境的刺激[72]。
4 结论与展望
微生物是地球生命系统中的重要组分,由微生物聚集形成的生物膜对人类的健康、工业效率和农业环境有着重要的影响。土壤环境的空间和化学异质性使得在土壤颗粒尺度上观测生物膜形成的难度增大,也几乎不可能在原位观察土壤生物膜,因此土壤生物膜的发育信息和生理学性质常通过模拟体系来获得。为最大程度地模拟土壤生物膜在自然条件下的发育过程,研究者们构建了各式各样的生物膜反应器,比如文中提到过的卡尔加里培养、流动法等[42,49-50]。利用这些模拟体系结合光学显微镜技术可以得到生物膜结构、功能、物种多样性以及生理学性质等信息,这对于了解土壤生物膜至关重要。
本实验室前期探究了生物膜对天然及工程纳米颗粒的响应,采用了染色法、傅里叶变换红外光谱(FTIR)、激光共聚焦显微镜(CLSM)、高分辨率的电子显微镜(SEM、AFM)、等温滴定微量热仪(ITC)、石英晶体微天平(QCM-D)等现代分析手段,对土壤环境中纳米颗粒及微生物效应进行了评估,结果表明,低浓度纳米颗粒刺激细菌释放更多信号分子来促进生物膜形成[73],成熟生物膜对纳米颗粒有更强的耐受性[13];细胞毒性的产生是由于纳米颗粒与细菌细胞直接接触和内生化进入细胞所引起且纳米颗粒能够加速成熟生物膜中细胞的解体[73-74]。
以往针对单一物种形成的生物膜展开了较多研究,但是在自然界中多物种生物膜的存在形式才是常态,目前我们所获取的有关多物种生物膜的信息还十分缺乏。结合笔者所在课题组前期研究成果以及目前土壤多物种生物膜研究面临的问题,未来需要从以下几个方面展开研究:(1) 进行多物种生物膜与土壤矿物的相互作用研究,探索矿物对多物种生物膜中微生物间的竞争、协作、信息传递等的影响;(2) 多物种生物膜的形成对土壤团聚体形成、稳定性,土壤肥力的保持和养分循环的作用;(3) 多物种生物膜对有毒物质(如重金属等)、有机污染物(如抗生素等)的吸附和降解机制,揭示生物膜的生态环境效益;(4) 采用更加先进的研究技术手段,如拉曼光谱技术、同步辐射光谱技术、组学技术等对多物种生物膜的形貌、热力学特征、EPS组成及其功能、基因调控机制等方面进行研究,这些技术对研究多物种生物膜结构和功能有着重要作用;同时,也将加深我们对多物种生物膜的发育和演变的了解。
参考文献:
[1]Vu B,Chen M,Crawford R,et al. Bacterial extracellular polysaccharides involved in biofilm formation[J]. Molecules,2009,14(7):2535-2554.
[2]Burmlle M,Ren D W,Bjarnsholt T,et al. Interactions in multispecies biofilms:do they actually matter?[J]. Trends in Microbiology,2014,22(2):84-91.
[3]Nannipieri P,Ascher J,Ceccherini M T,et al. Microbial diversity and soil functions[J]. European Journal of Soil Science,2017,68(1):12-26.
[4]Barea J M,Pozo M J,Azcón R,et al. Microbial co-operation in the rhizosphere[J]. Journal of Experimental Botany,2005,56(417):1761-1778.
[5]Ma W T,Peng D H,Walker S L,et al. Bacillus subtilis biofilm development in the presence of soil clay minerals and iron oxides[J]. NPJ Biofilms and Microbiomes,2017,3:4.
[6]Velmourougane K,Prasanna R. Influence of l-amino acids on aggregation and biofilm formation in Azotobacter chroococcum and Trichoderma viride[J]. Journal of Applied Microbiology,2017,123(4):977-991.
[7]張 铭,蔡 鹏,吴一超,等. 细菌胞外聚合物:基于土壤生态功能的视角[J]. 土壤学报,2022,59(2):308-323.
[8]Flemming H C,Wingender J. The biofilm matrix[J]. Nature Reviews Microbiology,2010,8(9):623-633.
[9]Sutherland I. Biofilm exopolysaccharides:a strong and sticky framework[J]. Microbiology,2001,147(1):3-9.
[10]Koele N,Turpault M P,Hildebrand E E,et al. Interactions between mycorrhizal fungi and mycorrhizosphere bacteria during mineral weathering:budget analysis and bacterial quantification[J]. Soil Biology and Biochemistry,2009,41(9):1935-1942.
[11]Burns R G,Dick R P. Enzymes in the environment:activity,ecology,and applications[M]. New York:Marcel Dekker,2002.
[12]Sutherland I W. The biofilm matrix—An immobilized but dynamic microbial environment[J]. Trends in Microbiology,2001,9(5):222-227.
[13]Ouyang K,Yu X Y,Zhu Y L,et al. Effects of humic acid on the interactions between zinc oxide nanoparticles and bacterial biofilms[J]. Environmental Pollution,2017,231:1104-1111.
[14]Xing Y H,Luo X S,Liu S,et al. Synergistic effect of biofilm growth and cadmium adsorption via compositional changes of extracellular matrix in montmorillonite system[J]. Bioresource Technology,2020,315:123742.
[15]Donlan R M,Costerton J W. Biofilms:survival mechanisms of clinically relevant microorganisms[J]. Clinical Microbiology Reviews,2002,15(2):167-193.
[16]Camargo S E A,Xia X Y,Fares C,et al. Nanostructured surfaces to promote osteoblast proliferation and minimize bacterial adhesion on titanium[J]. Materials,2021,14(16):4357.
[17]Li Y Z,Li X,Hao Y,et al. Biological and physiochemical methods of biofilm adhesion resistance control of medical-context surface[J]. International Journal of Biological Sciences,2021,17(7):1769-1781.
[18]葛占标,殷涂童,周倩倩,等. 产生物膜芽胞杆菌阻控叶菜吸收镉、铅及其修复菜地土壤的作用[J]. 南京农业大学学报,2020,43(1):80-88.
[19]Stenlkke Madsen J,Burmlle M,Hansen L H,et al. The interconnection between biofilm formation and horizontal gene transfer[J]. FEMS Immunology & Medical Microbiology,2012,65(2):183-195.
[20]Srensen S J,Bailey M,Hansen L H,et al. Studying plasmid horizontal transfer in situ:a critical review[J]. Nature Reviews Microbiology,2005,3(9):700-710.
[21]Thurnheer T,Gmür R,Guggenheim B. Multiplex FISH analysis of a six-species bacterial biofilm[J]. Journal of Microbiological Methods,2004,56(1):37-47.
[22]Borlee B R,Goldman A D,Murakami K,et al. Pseudomonas aeruginosauses a cyclic-di-GMP-regulated adhesin to reinforce the biofilm extracellular matrix[J]. Molecular Microbiology,2010,75(4):827-842.
[23]Stoodley P,Sauer K,Davies D G,et al. Biofilms as complex differentiated communities[J]. Annual Review of Microbiology,2002,56:187-209.
[24]Danese P N,Pratt L A,Kolter R. Exopolysaccharide production is required for development of Escherichia coli K-12 biofilm architecture[J]. Journal of Bacteriology,2000,182(12):3593-3596.
[25]McDougald D,Rice S A,Barraud N,et al. Should we stay or should we go:mechanisms and ecological consequences for biofilm dispersal[J]. Nature Reviews Microbiology,2012,10(1):39-50.
[26]Flemming H C,Wingender J,Szewzyk U,et al. Biofilms:an emergent form of bacterial life[J]. Nature Reviews Microbiology,2016,14(9):563-575.
[27]Billings N,Birjiniuk A,Samad T S,et al. Material properties of biofilms—A review of methods for understanding permeability and mechanics[J]. Reports on Progress in Physics,2015,78(3):036601.
[28]Schaechter M. Encyclopedia of microbiology[M]. Pittsburgh:Academic Press,2009.
[29]Battin T J,Besemer K,Bengtsson M M,et al. The ecology and biogeochemistry of stream biofilms[J]. Nature Reviews Microbiology,2016,14(4):251-263.
[30]Pinchuk G E,Ammons C,Culley D E,et al. Utilization of DNA as a sole source of phosphorus,carbon,and energy by Shewanella spp.:ecological and physiological implications for dissimilatory metal reduction[J]. Applied and Environmental Microbiology,2008,74(4):1198-1208.
[31]Geng N,Xia Y F,Lu D B,et al. The bacterial community structure in epiphytic biofilm on submerged macrophyte Potamogetom crispus L. and its contribution to heavy metal accumulation in an urban industrial area in Hangzhou[J]. Journal of Hazardous Materials,2022,430:128455.
[32]Grumbein S,Opitz M,Lieleg O. Selected metal ions protect Bacillus subtilis biofilms from erosion[J]. Metallomics,2014,6(8):1441-1450.
[33]Weaver L,Webber J B,Hickson A C,et al. Biofilm resilience to desiccation in groundwater aquifers:a laboratory and field study[J]. Science of the Total Environment,2015,514:281-289.
[34]Adessi A,de Carvalho R C,De Philippis R,et al. Microbial extracellular polymeric substances improve water retention in dryland biological soil crusts[J]. Soil Biology and Biochemistry,2018,116:67-69.
[35]Tielen P,Kuhn H,Rosenau F,et al. Interaction between extracellular lipase LipA and the polysaccharide alginate of Pseudomonas aeruginosa[J]. BMC Microbiology,2013,13:159.
[36]Schmidt T M,Schaechter M. Topics in ecological and environmental microbiology[M]. Amsterdam:Elsevier,2012.
[37]Worm J,Jensen L E,Hansen T S,et al. Interactions between proteolytic and non-proteolytic Pseudomonas fluorescens affect protein degradation in a model community[J]. FEMS Microbiology Ecology,2000,32(2):103-109.
[38]Raklami A,Oufdou K,Tahiri A I,et al. Safe cultivation of Medicago sativa in metal-polluted soils from semi-arid regions assisted by heat-and metallo-resistant PGPR[J]. Microorganisms,2019,7(7):212.
[39]Sneha G,Birapu U K C,Puppala R,et al. Antimicrobial efficacy of lipopeptide antibiotic,lantibiotic and cationic bisbiguanide against Enterococcus faecalis biofilm:an in-vitro study[J]. Journal of Clinical and Diagnostic Research,2019,13(6):32-35.
[40]Lennon J T,Lehmkuhl B K. A trait-based approach to bacterial biofilms in soil[J]. Environmental Microbiology,2016,18(8):2732-2742.
[41]Sharma A,Vashistt J,Shrivastava R. Response surface modeling integrated microtiter plate assay for Mycobacterium fortuitum biofilm quantification[J]. Biofouling,2021,37(8):830-843.
[42]Diepoltová A,Konecˇná K,Jandourek O,et al. Study of the impact of cultivation conditions and peg surface modification on the in vitro biofilm formation of Staphylococcus aureus and Staphylococcus epidermidis in a system analogous to the Calgary biofilm device[J]. Journal of Medical Microbiology,2021,70(5):10.1099/jmm.0.001371.
[43]Chavant P,Gaillard-Martinie B,Talon R,et al. A new device for rapid evaluation of biofilm formation potential by bacteria[J]. Journal of Microbiological Methods,2007,68(3):605-612.
[44]Tsai Y P,Pai T Y,Qiu J M. The impacts of the AOC concentration on biofilm formation under higher shear force condition[J]. Journal of Biotechnology,2004,111(2):155-167.
[45]Lewandowski Z,Beyenal H,Stookey D. Reproducibility of biofilm processes and the meaning of steady state in biofilm reactors[J]. Water Science and Technology:a Journal of the International Association on Water Pollution Research,2004,49(11/12):359-364.
[46]Cai P,Sun X J,Wu Y C,et al. Soil biofilms:microbial interactions,challenges,and advanced techniques for ex-situ characterization[J]. Soil Ecology Letters,2019,1(3):85-93.
[47]Oliveira N M,Martinez-Garcia E,Xavier J,et al. Biofilm formation as a response to ecological competition[J]. PLoS Biology,2015,13(7):e1002191.
[48]Aleklett K,Kiers E T,Ohlsson P,et al. Build your own soil:exploring microfluidics to create microbial habitat structures[J]. The ISME Journal,2018,12(2):312-319.
[49]Edmonds J M,Collett P J,Valdes E R,et al. Surface sampling of spores in dry-deposition aerosols[J]. Applied and Environmental Microbiology,2009,75(1):39-44.
[50]Müller P,Guggenheim B,Attin T,et al. Potential of shock waves to remove calculus and biofilm[J]. Clinical Oral Investigations,2011,15(6):959-965.
[51]Grand I,Bellon-Fontaine M N,Herry J M,et al. Possible overestimation of surface disinfection efficiency by assessment methods based on liquid sampling procedures as demonstrated by in situ quantification of spore viability[J]. Applied and Environmental Microbiology,2011,77(17):6208-6214.
[52]Olivares E,Badel-Berchoux S,Provot C,et al. The BioFilm ring test:a rapid method for routine analysis of Pseudomonas aeruginosa biofilm formation kinetics[J]. Journal of Clinical Microbiology,2016,54(3):657-661.
[53]Liu Y G,Walther-Antonio M. Microfluidics:a new tool for microbial single cell analyses in human microbiome studies[J]. Biomicrofluidics,2017,11(6):061501.
[54]Damschen E I,Brudvig L A,Haddad N M,et al. The movement ecology and dynamics of plant communities in fragmented landscapes[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(49):19078-19083.
[55]Squires T M,Quake S R. Microfluidics:Fluid physics at the nanoliter scale[J]. Reviews of Modern Physics,2005,77(3):977-1026.
[56]Pitts B,Hamilton M A,Zelver N,et al. A microtiter-plate screening method for biofilm disinfection and removal[J]. Journal of Microbiological Methods,2003,54(2):269-276.
[57]Peeters E,Nelis H J,Coenye T. Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates[J]. Journal of Microbiological Methods,2008,72(2):157-165.
[58]Fontenete S,Leite M,Guimares N,et al. Towards fluorescence in vivo hybridization (FIVH) detection of H.pylori in gastric mucosa using advanced LNA probes[J]. PLoS One,2015,10(4):e0125494.
[59]Valm A M,Mark Welch J L,Rieken C W,et al. Systems-level analysis of microbial community organization through combinatorial labeling and spectral imaging[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(10):4152-4157.
[60]Wang M R. Optical Coherence Tomography and Its Non-medical Applications[M]. Amsterdam:Elsevier,2020.
[61]Zago E I,Samdani A J,Pereira G T R,et al. An assessment of the quality of optical coherence tomography image acquisition[J]. The International Journal of Cardiovascular Imaging,2020,36(6):1013-1020.
[62]Bridier A,Dubois-Brissonnet F,Boubetra A,et al. The biofilm architecture of sixty opportunistic pathogens deciphered using a high throughput CLSM method[J]. Journal of Microbiological Methods,2010,82(1):64-70.
[63]Villacorte L O,Ekowati Y,Neu T R,et al. Characterisation of algal organic matter produced by bloom-forming marine and freshwater algae[J]. Water Research,2015,73:216-230.
[64]Beaussart A,El-Kirat-Chatel S,Sullan R M A,et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy[J]. Nature Protocols,2014,9(5):1049-1055.
[65]Cabral V,Znaidi S,Walker L A,et al. Targeted changes of the cell wall proteome influence Candida albicans ability to form single-and multi-strain biofilms[J]. PLoS Pathogens,2014,10(12):e1004542.
[66]Oates A,Bowling F L,Boulton A J M,et al. The visualization of biofilms in chronic diabetic foot wounds using routine diagnostic microscopy methods[J]. Journal of Diabetes Research,2014,2014:153586.
[67]紀丹丹. 模拟体系中稻田土壤生物膜形成过程与结构和代谢特性研究[D]. 武汉:华中农业大学,2018.
[68]Dreszer C,Wexler A D,Drusová S,et al. In-situ biofilm characterization in membrane systems using Optical Coherence Tomography:formation,structure,detachment and impact of flux change[J]. Water Research,2014,67:243-254.
[69]Xue Z,Lee W H,Coburn K M,et al. Selective reactivity of
monochloramine with extracellular matrix components affects the disinfection of biofilm and detached clusters[J]. Environmental Science & Technology,2014,48(7):3832-3839.
[70]杨闪闪,黄巧云,蔡 鹏. 原子力显微镜(AFM)在细菌生物被膜研究中的应用[J]. 生物工程学报,2017,33(9):1399-1410.
[71]Oh Y J,Jo W,Yang Y,et al. Influence of culture conditions on Escherichia coli O157:H7 biofilm formation by atomic force microscopy[J]. Ultramicroscopy,2007,107(10/11):869-874.
[72]Steinberger R E,Allen A R,Hansma H G,et al. Elongation correlates with nutrient deprivation in Pseudomonas aeruginosa unsaturated biofilms[J]. Microbial Ecology,2002,43(4):416-423.
[73]Ouyang K,Mortimer M,Holden P A,et al. Towards a better understanding of Pseudomonas putida biofilm formation in the presence of ZnO nanoparticles (NPs):role of NP concentration[J]. Environment International,2020,137:105485.
[74]Ouyang K,Walker S L,Yu X Y,et al. Metabolism,survival,and gene expression of Pseudomonas putida to hematite nanoparticles mediated by surface-bound humic acid[J]. Environmental Science:Nano,2018,5(3):682-695.

