运动预适应促进GSH/Bcl-2合成及相互作用抑制阿霉素心脏损伤
王传志,张双双,郝月蓉,罗立杰,原阳*
运动预适应促进GSH/Bcl-2合成及相互作用抑制阿霉素心脏损伤
王传志1,张双双1,郝月蓉1,罗立杰2,原阳1*
(1. 青岛大学 体育学院,山东 青岛 266071;2. 济宁学院 体育学院,山东 济宁 273155)
目的:基于代谢组学分析,探究GSH与B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)相互作用在一次性运动预适应(exercise preconditioning,EP)抑制阿霉素(doxorubicin,DOX)治疗癌症产生心肌毒性中的作用机制。方法:40只19周龄雌性SD大鼠随机分为对照(control,C)组、DOX组、EP组、EP+DOX组,每组10只。DOX组注射DOX,EP组大鼠进行1次大强度间歇运动,EP+DOX组于EP后24 h注射DOX。通过心脏超声检测大鼠心功能;通过化学荧光免疫分析法检测心肌损伤标志物表达水平;通过组织学染色、透射电镜观察和分析大鼠心肌组织病理变化;通过Western Blot检测心肌凋亡及促存活基因相关蛋白表达;通过代谢组学分析探究心肌代谢物和代谢通路变化;通过免疫共沉淀法检测Bcl-2与GSH转运蛋白2-酮戊二酸载体(2-oxoglutarate carrier,OGC)的结合活性;通过免疫荧光双标法分析GSH与Bcl-2共定位水平。结果:DOX组大鼠心肌线粒体肿胀、外膜破裂、体积增大、线粒体嵴排列紊乱甚至断裂,线粒体基质内出现云絮状结构。与C组相比,DOX组大鼠心功能显著更低;心肌损伤指标血清c Tn I、LDH、丙二醛含量显著更高;心肌细胞损伤、纤维化、炎症症状明显;心肌细胞抗凋亡蛋白Bcl-2表达水平显著更低,Bad、Bax、Caspase3等凋亡蛋白表达显著更高;YAP磷酸化水平显著更高;GSH、NAD+代谢水平显著更低;Bcl-2与OGC结合程度显著更低;Bcl-2与GSH共定位水平显著更低。与DOX组相比,EP+DOX组上述指标均呈不同程度改善。结论:经典形式的EP通过促进GSH/Bcl-2相互作用,可以减轻DOX治疗引起的心肌细胞凋亡及氧化应激损伤,抑制炎症及纤维化,改善心功能。
运动预适应;阿霉素;心脏毒性;B细胞淋巴瘤-2;谷胱甘肽
国际癌症研究机构(international agency for research on cancer,IARC)发布的全球癌症2020年统计数据显示,女性乳腺癌发病率超越肺癌,已成为全球癌症发病率最高的癌种,约有230万新发病例,占全部新发病例的11.7%(Sung et al.,2021)。阿霉素(doxorubicin,DOX)作为一种广谱、高效、低廉的蒽环类抗癌一线用药,在乳腺癌化疗方案中处于核心地位(Pilco-Ferreto et al., 2016)。但研究发现,该药物由时间和剂量依赖性导致的心脏毒性,可造成严重的心肌病和充血性心力衰竭,临床应用受到限制(苏毅馨等,2020)。DOX的心脏毒性机制包括心肌氧化应激损伤、细胞凋亡和代谢异常,由于相关机制复杂,难以从精准药物干预靶点角度找到干预措施(Rawat et al., 2021)。右雷佐生(dexrazoxane,Dex)可在一定程度抑制DOX的心脏毒性,但有研究表明,与DOX连用可加重化疗骨髓抑制(Reichardt et al., 2018)。应用β-受体阻滞剂、血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitors,ACEI)、血管紧张素II受体阻滞剂(angiotensin receptor blocker,ARB)等间接治疗手段对DOX心脏毒性的疗效也有待进一步循证证据佐证(苏毅馨等,2020)。
运动对心血管机能的促进效果被广泛认可,关于运动心脏保护效应的抗氧化应激、凋亡、线粒体质量控制等机制的研究已较为充分,表明运动具备抗DOX损伤的潜力,作为补充疗法具有重要价值(Bernardo et al., 2018),经典形式的运动预适应(exercise preconditioning,EP)通过高强度间歇有氧运动造成心肌反复短暂的缺血缺氧,触发内源性保护效应,使心肌在随后持续性缺血缺氧损伤中得到保护,机制层面认为可能与线粒体能量代谢相关(原阳等,2015)。在DOX治疗前24 h进行1次运动可以预防心功能障碍,短期和长期运动可有效抑制急性单次剂量DOX(10~20 mg/kg体质量)所致的心脏氧化应激损伤和心肌细胞凋亡(Lien et al., 2015),但更多的相关物质代谢机制仍不明确。研究指出,运动联合精氨酸补剂可增强谷胱甘肽(glutathione, GSH)活性,促进抗凋亡因子B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)的表达,增强心肌细胞抗氧化应激损伤能力(Ranjbar, 2022)。但运动是否通过改善GSH代谢及GSH/Bcl-2相互作用促进GSH转运进入线粒体,发挥抗DOX心脏损伤的作用,还有待进一步证实。
心肌炎症、心肌纤维化、心力衰竭是DOX心脏毒性的主要表现形式,线粒体氧化应激损伤是诱导DOX心脏毒性的重要因素(Rawat et al., 2021)。GSH是生物体内含量最为丰富的抗氧化因子,可清除ROS以维持机体抗氧化防御水平,调节氧化还原依赖性细胞信号传导,主要通过线粒体膜内阴离子转运体2-酮戊二酸载体(2-oxoglutarate carrier,OGC)进入线粒体内发挥抗氧化作用(Wilkins et al., 2014),Bcl-2可通过与OGC相互作用促进GSH转运至线粒体,并协同GSH对抗线粒体氧化应激损伤(Wilkins et al., 2014)。此外,Bcl-2还可抑制GSH泄漏,改善Bax途径的细胞凋亡(Chong et al., 2020)。本研究在大鼠注射DOX前进行1次EP,从EP抗氧化应激损伤、抗凋亡角度分析EP抑制DOX心肌毒性的内在机制,为EP干预抑制DOX心脏毒性提供理论依据。
1 实验对象与方法
1.1 动物分组和运动干预方案
健康19周龄雌性SD大鼠40只,体质量为(300±20)g,购自斯贝福动物中心[合格证号:SCXK(京)2019-0010,中国北京]。动物分笼饲养于青岛大学医学部动物实验中心,随机分笼饲养(5只/笼),自由饮食,室温为22~24 ℃,相对空气湿度为40%~70%,光照时间为12 h/d。大鼠适应性喂养1周后,随机分为4组:对照(control, C)组、DOX组、EP组和EP+DOX组,10只/组,每天监测大鼠存活率。干预方案如图1所示,正式实验处理前,EP组和EP+DOX组进行连续5天的跑台适应性训练,速度为15 m/min,时间为15 min,坡度为0°;适应训练期间C组和DOX组置于跑台环境,适应性训练结束后休息2天进行正式实验。正式实验中,EP组和EP+DOX组进行1次大强度间歇性跑台运动,速度为25 m/min(75%V.O2max),运动10 min,休息10 min,重复4次,全程80 min(陈天然等,2021)。EP干预24 h后,EP+DOX组和DOX组腹腔注射DOX(20 mg/kg)(Kosoko et al., 2017; Saleh et al., 2022),各组大鼠5天后取材(Cao et al., 2014)。
1.2 动物取材与指标检测
1.2.1 心脏超声
采用心脏超声检测采集各组大鼠心脏功能指标。将大鼠放置于含有2%动物用吸入式麻醉气体异氟烷的麻醉机(瑞沃德R5835,中国)中进行麻醉,麻醉完毕后,将大鼠胸前毛发剃除暴露出心脏部位皮肤,固定于心肺功能测试和心电图(electrocardiogram,ECG)检测平台上,应用超声传导导电胶优化清晰度,使用高分辨率超声心动图成像系统(飞依诺V6,中国)检测心脏功能。在长轴视图中对心脏进行二维M-mode成像,并评估心脏功能。
图1 运动实验方案示意图
Figure 1.Exercise Experimental Protocol
1.2.2 血液样本和心肌组织样本采集与处理
腹腔注射戊巴比妥钠(40 mg/kg体质量)进行麻醉,将麻醉后大鼠仰卧位固定于解剖台,打开腹腔,腹主动脉取血5 mL,常温静置30 min后,放入低温离心机以4 000 r/min 离心10 min,提取血清,置于-20 ℃冰箱保存备用。
每组随机选取5只大鼠进行灌注固定:于心尖处插入灌注针,先注入1%的肝素2 mL,再快速灌注0.9%生理盐水230~250 mL,待流出血液基本无色后,取出心脏并用PBS洗净残留血液,放入4%多聚甲醛室温固定24 h。常规石蜡包埋,制作相邻切片,用于后续组织学染色,每组其余5只大鼠麻醉取血后,打开胸腔,取出心脏,-80 ℃保存,用于免疫印迹实验。
1.2.3 心肌形态观察与心肌损伤标志物检测
取约1 mm3心尖组织,戊二醛4 ℃固定,0.1 mol/L磷酸缓冲液PBS漂洗15 min×3次,1%锇酸溶液固定2 h。0.1 mol/L磷酸缓冲液漂洗10 min×2次,丙酮梯度脱水(30%、50%、70%、90%)各10 min,100%脱水10 min×3次,Epon812树脂浸透、包埋、聚合。超薄切片机切片(50~60 nm),铀染色30 min,铅染色10 min,透射电子显微镜下观察,采集图像分析心肌超微结构变化。
使用心肌肌钙蛋白I(cardiac troponin I,c Tn I)检测试剂盒(索莱宝科技有限公司,中国)检测c Tn I含量。使用乳酸脱氢酶检测试剂盒(lactate dehydrogenase,LDH;索莱宝科技有限公司,中国)测定LDH,按照试剂盒说明书操作,待测液混匀,室温静置5 min,酶标仪450 nm线性范围测定吸光度。采用丙二醛(Malondialdehyde,MDA)检测试剂盒(索莱宝科技有限公司,中国),检测心肌组织匀浆上清中MDA含量。
1.2.4 心肌组织病理学检测
1.2.4.1 心肌组织HE染色
心肌组织4%多聚甲醛后固定,OCT包埋冰冻切片厚度10 μm,每组5个切片:依次将切片放入二甲苯I 20 min—二甲苯II 20 min—无水乙醇II 5 min—无水乙醇II 5 min—75% 酒精5 min,用纯净水洗净(国药集团化学试剂有限公司,中国)。苏木素染色:切片入苏木素染色3~5 min,用纯净水清洗,分化液分化,用流水冲洗,直至核返蓝(碧云天生物技术有限公司,中国)。伊红染色:切片依次入85%、95%的梯度酒精脱水5 min,入伊红染液染色5 min(碧云天生物技术有限公司,中国)。脱水封片:切片依次放入无水乙醇I 5 min—无水乙醇II 5 min—二甲苯I 5 min—二甲苯 II 5 min透明,用中性树胶封片(国药集团化学试剂有限公司,中国),留作显微镜镜检和图像采集(Leica Microsystems Ltd,德国)分析。
1.2.4.2 心肌组织纤维化Masson染色
常规脱蜡至水,方法同前。切片浸入Masson A液中浸泡过夜(碧云天生物技术,中国),流水冲洗;切片放入Masson B液及Masson C液等比混合的染液,浸染1 min,流水冲洗,1%盐酸酒精分化,自来水洗;切片入Masson D液浸染6 min,纯净水漂洗;Masson E液浸染1 min,不水洗,稍沥干直接入Masson F液染色20~30 s;切片用1%冰醋酸漂洗分化,梯度酒精脱水、中性树胶封片,进行图像采集(Leica Microsystems Ltd,德国)并分析。
1.2.4.3 心肌组织免疫组化炎性标记物IL-1β染色
对于IL-1β免疫组织化学染色,切片在3% H2O2室温孵育10 min,PBS冲洗,山羊血清封闭,4 ℃加入IL-1β抗体孵育过夜。随后37 ℃二抗孵育15 min,组织PBS下清洗,0.05%二氨基联苯胺(diaminobenzidine,DAB)1 min分色与苏木精复染5 min。最后,经过脱水和渗透,中性树胶密封。显微镜(Nikon AIR HD25,日本)下观察IL-1β染色阳性的细胞,采用Image J进行图像处理,计算阳性区域面积。
1.2.5 心肌组织蛋白免疫印迹检测
利用蛋白质免疫印迹法(Western Blotting)测定大鼠心肌组织与凋亡相关蛋白的表达情况。大鼠心肌组织提取总蛋白,BCA蛋白质定量分析调整蛋白浓度。加上样缓冲液,100 ℃恒温加热10 min使蛋白变性。SDS凝胶电泳和转膜完毕后,5%脱脂牛奶封闭1 h,分别孵育一抗(Beclin1、Bcl-2、Bnip3、Bad、Bax、Caspase3、TNF-α、YAP,抗体稀释浓度均为1∶1 000,抗体购自塞维尔生物技术有限公司),4 ℃过夜,加HRP标记的二抗,室温孵育1 h。ECL发光,凝胶成像系统成像,采用Image J软件统计各蛋白表达水平。
1.2.6 心肌组织代谢组学LC-MS分析
取100 mg液氮研磨的组织样本,置于EP管中,加入500 μL的80%甲醇水溶液,涡旋振荡,冰浴静置5 min,15 000 g,4 ℃离心20 min;取一定量的上清液加质谱级的水稀释至甲醇含量为53%;15 000 g,4 ℃离心20 min,收集上清,进样LC-MS进行分析。
本研究中,使用色谱(Xselect HSS)分析大鼠心肌组织代谢物。采用T3色谱柱(2.1 mm×150.0 mm,2.5 μm)进行色谱分离。使用乙腈中含0.1% 甲酸的溶液作为流动相A,水中含0.1%甲酸的溶液作为流动相B。柱温50 ℃,流速0.4 mL/min,进行梯度洗脱。在质谱仪(Q Exactive™ HF,中国)上用电喷雾进行质谱分析。m/z范围设定为100~1 500的全景扫描模式。电离模式的条件设置如下:电喷雾毛细管电压3.2 kv;气体温度为550 ℃。
将下机数据(格式为.raw)文件导入Compound Discoverer 3.1软件进行处理,对每个代谢物进行保留时间、质荷比等参数的简单筛选,然后设置保留时间偏差0.2 min和质量偏差5 ppm对不同样品进行峰值比对和选取,使鉴定更准确,随后设置质量偏差5 ppm、信号强度偏差30%。信噪比、最小信号强度、加和离子等信息进行提取,同时对峰面积进行定量,再整合目标离子,然后通过分子离子峰和碎片离子进行分子式的预测并与mzCloud、mzVault和Masslist数据库进行比对,用空白样本去除背景离子,并对原始定量结果进行标准化处理,对代谢物进行定量。
1.2.7 免疫荧光双标法检测GSH与Bcl-2共定位
每组随机选取5个样本,石蜡切片(5 μm)室温下进行30 min×3次的二甲苯脱蜡,确保脱蜡完全,以防止石蜡的非特异性荧光干扰。梯度酒精依次通过10 min×2次的100%酒精、5 min×2次的95%酒精、5 min的85%酒精、5 min的75%酒精,水洗3 min×3次。PBS(1 mM)平衡5 min×3次后,室温10 min复合消化液消化,PBS浸洗5 min×4次,10%山羊血清封闭20 min,甩去封闭液,滴加不同源的兔抗大鼠GSH与小鼠抗大鼠Bcl-2一抗混合液,一抗浓度分别为1∶100。湿盒4 ℃过夜,复温10 min,PBS浸洗5 min×3次,滴加山羊抗兔FITC和山羊抗小鼠CY3混合二抗,稀释浓度分别为1∶100,37 ℃孵育1 h。PBST(PBS中添加1∶1 000的Tween 20)浸洗5 min×4次,滴加1∶1 000稀释的DAPI,室温条件下对细胞核复染10 min,PBS浸洗5 min×3次,滴加少量抗荧光猝灭封片液,盖玻片封片,2天内完成拍摄。利用PBS代替一抗作阴性对照。实验过程中,一抗孵育后所有步骤均避光进行。
采用共聚焦显微镜(Nikon AIR HD25,日本)进行图像采集,激光扫描参数保持一致。每张切片随机选取5个视野,每组25个视野。采集的图像包括红、绿、蓝3个通道,以及合成图。图像分析采用IMARIS X64 9.0.1软件,利用四象限散点图统计红绿荧光像素点离散情况。
进一步对阳性区域荧光强度、Bcl-2与GSH的共定位系数百分比(Manders’ co-localization coefficients)等数据进行统计。
1.2.8 免疫共沉淀检测Bcl-2与OGC的相互作用
心肌组织剪成细小碎片,IP细胞裂解液加入PMSF混匀,按照20 mg组织加入100~200 μL裂解液,玻璃匀浆器匀浆,匀浆后4 ℃在离心机中以14 000 g离心5 min,收集上清液备用。进行磁珠预处理,对磁珠进行混悬,取50 μL磁珠,加入400 μL PBST放于磁力架,进行磁性分离,弃上清,重复2次。将稀释好的400 μL抗体加入磁珠中,在4 ℃翻转混合仪混悬2 h,弃上清液搜集磁珠。加入400 μL PBST磁性分离,弃上清,重复4次。加入400 μL离心后的匀浆上清液,充分将磁珠与抗原抗体混合,4 ℃过夜,加入400 μL PBST洗4次,弃上清,加入1×loading buffer 在95~100 ℃煮沸5 min,采用Western Blot分析Bcl-2与OGC的结合关系。
1.3 数据统计与分析
代谢组数据使用KEGG数据库(https://www.genome.jp/kegg/pathway.html)、HMDB数据库(https://hmdb.ca/metabolites)和LIPID Map数据库(http://www.lipidmaps.org/)对鉴定到的代谢物进行注释。使用代谢组学数据处理软件对数据进行转换后进行主成分分析和偏最小二乘法判别分析,进而得到每个代谢物的VIP值。单变量分析部分,采用检验统计各代谢物在2组间统计学显著性,并计算代谢物在2组间的差异倍数(fold change,FC)。差异代谢物筛选的默认标准为>1,<0.05且≥2或≤0.5。
所有数据采用SPSS 25.0统计软件进行处理,实验结果以均值±标准差(±)表示,同时满足正态分布与方差齐性条件下,对指标进行单因素方差分析(one-way ANOVA),对方差不齐的数据,通过对数、倒数等转换满足条件后再进行分析。采用LSD事后检验比较组间差异性,以<0.05表示差异具有显著性。
2 结果
2.1 EP对DOX诱导心脏功能损伤的影响
大鼠心脏功能检测结果显示,与C组相比,DOX组射血分数(DOX组 vs C组,65.67%±7.58% vs 83.83%±6.96%,<0.01;图2B)、短轴缩短率(DOX组 vs C组,31.64%±5.52% vs 53.71%±8.83%,<0.01;图2C)、心脏收缩末期左室后壁厚度[DOX组 vs C组,(2.62±0.26)mm vs (3.56±0.33)mm,<0.01;图2D]、左心室收缩末期容积[DOX组 vs C组,(0.32±0.14)mL vs(0.13±0.07)mL,<0.05);图2E]、每搏输出量[DOX组 vs C组,(0.31±0.17)mL vs (0.61±0.36)mL,<0.01;图2F]显著更低。与DOX组相比,EP+DOX组上述指标均显著改善(<0.05)。
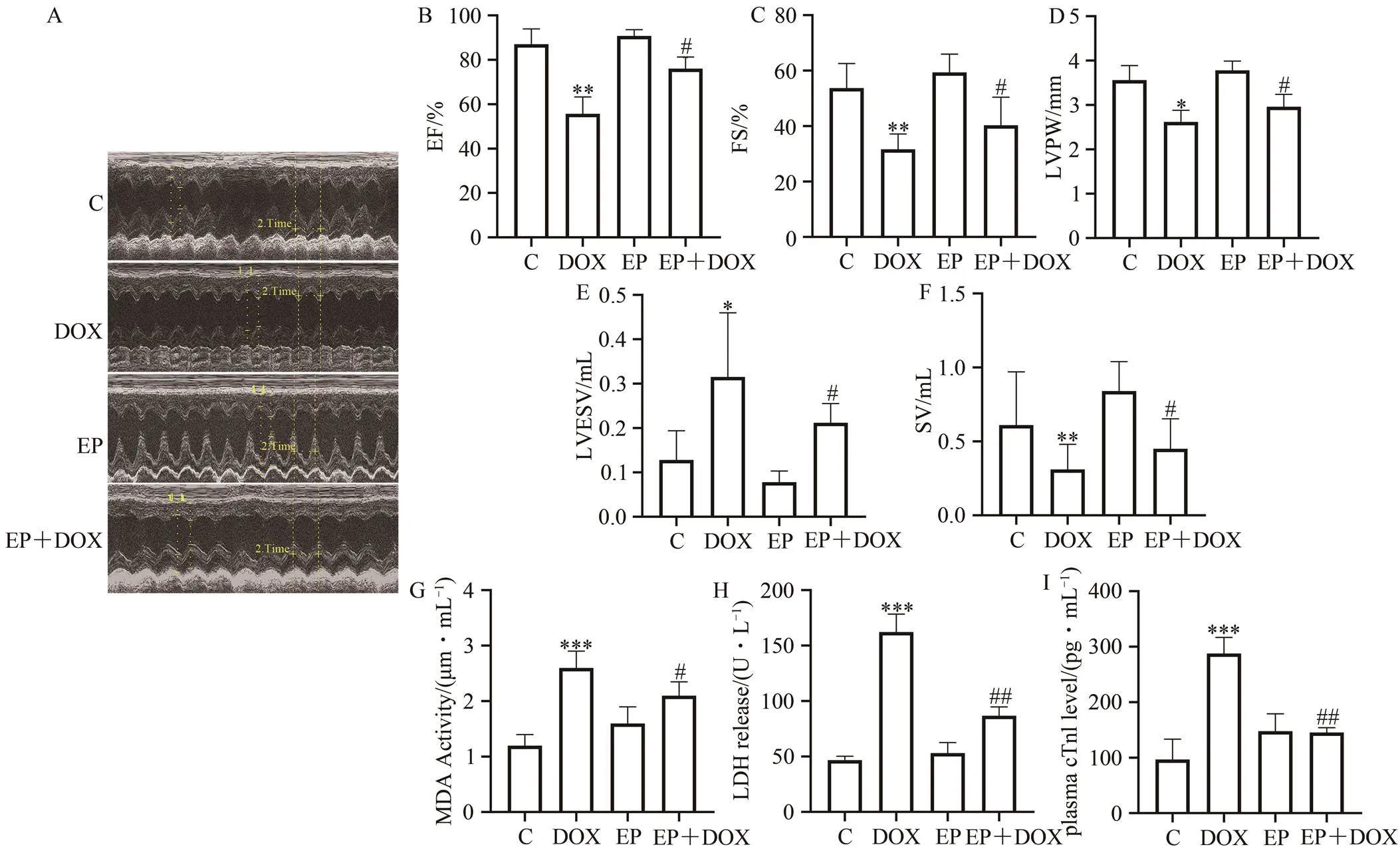
图2 运动预适应对阿霉素诱导的大鼠心功能的影响
Figure 2.Effect of Exercise Preconditioning on Heart Function Induced by Doxorubicin in Rats
注:A.心脏超声的代表性图像,2.Time表示一个心率周期内的第二次测试;EF.射血分数;FS.短轴缩短率;LVPW.心脏收缩末期左室后壁厚度;LVESV.左心室收缩末期容积;SV.每搏输出量;与C组相比,*<0.05,**<0.01,***<0.001;与DOX组相比,#<0.05,##<0.01;下同。
大鼠心肌MDA、LDH、 c Tn I结果显示,与C组相比,DOX组MDA [DOX组 vs C组,(2.60±0.33)μmol/mL vs(1.20±0.21)μmol/mL,<0.001;图2G]、LDH[DOX组 vs C组,(150.52±19.23)U/L vs(47.68±2.50)U/L,<0.001;图2H]、c Tn I[DOX组 vs C组,(278.68±19.50)pg/mL vs(103.41±31.69)pg/mL,<0.001;图2I]均显著更高;与DOX组相比,EP+DOX组上述指标均显著更低,与EP组相比,EP+DOX组c Tn I[EP组 vs EP+DOX组,(147.96±31.31)pg/mL vs(145.64±8.49)pg/mL,>0.05;图2I]未呈现显著性差异。
2.2 EP对DOX诱导的大鼠心肌组织病理和超微结构的影响
透射电镜结果显示,在3 000×倍数下,C组心肌细胞超微结构正常,核膜平整、心肌细胞排列规整、肌原纤维排列紧密、线粒体形态饱满、呈椭圆形紧密排列、线粒体嵴电子密度较高。DOX组大鼠心肌超微结构发生损伤性改变,核膜不规则凸起增多、染色质边集、肌原纤维断裂、肌丝排列紊乱、明暗带不清晰,线粒体则出现变形变小,数量增多,间隙变大,呈球形,闰盘排列紊乱,桥粒连接断开,并出现一定的缝隙连接扩张。EP明显改善上述结构损伤。5 000×、8 000×倍数下可见DOX组部分线粒体肿胀外膜破裂,肿胀的线粒体体积增大,线粒体嵴排列紊乱甚至断裂,线粒体基质内出现云絮状结构。与此同时,在各个组别均发现不同程度的线粒体自噬体,DOX组的自噬体初级溶酶体颗粒增多,存在线粒体降解痕迹,提示线粒体自噬的发生,EP+DOX组上述情况有所改善(图3)。

图3 大鼠心肌超微结构的透射电镜结果
Figure 3.Transmission Electron Microscopic Results of the Ultrastructure of Myocardial Cells in Rats
HE染色发现C组大鼠心肌结构正常,心肌纤维排列相对整齐规则,胞浆纹理清晰,纤维化表现少见;而DOX组心肌细胞间隙有增大趋势,心肌纤维排列紊乱,细胞间隙变宽(图4A),Image J软件测量细胞面积结果表明DOX组细胞显著小于C组[DOX组vs C组,(283.43±80.15)μm2vs (426.12±113.35)μm2,<0.05;图4B],1次EP抑制DOX引起细胞皱缩。Masson染色可见DOX组蓝色胶原纤维(黑色箭头)、心肌纤维化明显,而EP+DOX组纤维化程度较小,进一步利用图像分析软件测量蓝色胶原纤维面积,EP+DOX组较DOX组更小[EP+DOX组vs DOX组,(17 347.23± 2 125.34)μm2vs (21 657±3 987.98)μm2,<0.01;图4C]。IL-1β免疫组织染色显示(图4A),C组染色阳性褐色颗粒较少,DOX组阳性区域明显,分散于心肌组织。EP+DOX组仍可见阳性区域,但较DOX组阳性面积更小。数据统计结果表明,DOX组阳性面积显著高于C组[DOX组vs C组,(13 142.38±5 825.34)μm2vs (5 687.32±4 215.65)μm2,<0.05;图4D],EP+DOX组阳性区域面积显著低于DOX组[EP+DOX组vs DOX组,(8 743.13±5 646.91)μm2vs (13 142.38±5 825.34)μm2,<0.05]。
2.3 EP对DOX诱导大鼠心肌细胞凋亡的影响
大鼠心肌免疫印迹结果显示,与C组相比,DOX组的大鼠心肌组织Bax(DOX组vs C组,1.38±0.02 vs 1.17±0.16,<0.05;图5B)、Bad(DOX组vs C组,1.06±0.05 vs 0.69±0.13,<0.05;图5C)、Bnip3(DOX组vs C组,1.30±0.09 vs 0.79±0.12,<0.01;图5D)、TNF-α(DOX组vs C组,1.03±0.21 vs 0.60±0.11,<0.01;图5E)、Caspase3(DOX组vs C组,1.38±0.10 vs 0.79±0.21,<0.01;图5F)表达均显著更高。与C组相比,DOX组Bnip3/Bcl-2(DOX组vs C组,1.84±0.55 vs 0.55±0.17,<0.001;图5H)、Beclin1/Bcl-2(DOX组vs C组,0.42±0.17 vs 0.21±0.08,<0.01;图5I)、Bax/Bcl-2(DOX组vs C组,1.93±0.49 vs 0.82±0.29,<0.001;图5J)、Bad/Bcl-2(DOX组vs C组,1.50±0.44 vs 0.49±0.18,<0.001;图5K)均显著更高(<0.01,<0.001,Bcl-2(DOX组vs C组,0.75±0.22 vs 1.49±0.25,<0.01;图5L)、YAP(DOX组vs C组,0.48±0.12 vs 0.98±0.11,<0.05;图5M)表达显著更低(<0.01,<0.05;图5L、M)。与DOX组相比,EP+DOX组Bax(EP+DOX组vs DOX组,0.94±0.06 vs 1.38±0.02,<0.05;图5B)、Bad(EP+DOX组vs DOX组,0.73±0.13 vs 1.06±0.04,<0.05;图5C)、Bnip3(EP+DOX组vs DOX组,0.63±0.43 vs 1.30±0.11,<0.05;图5D)、TNF-α(EP+DOX组vs DOX组,0.35±0.07 vs 1.03±0.21,<0.01;图5E)、Caspase3(EP+DOX组vs DOX组,1.11±0.49 vs 1.37±0.10,<0.05;图5F)、P-YAPS127/YAP(EP+DOX组vs DOX组,1.00±0.19 vs 1.39±0.15,<0.05;图5O)显著更低,Beclin1(EP+DOX组vs DOX组,0.23±0.02 vs 0.28±0.05,<0.05;图5G)未呈现显著性差异,Bcl-2(EP+DOX组vs DOX组,1.84±0.44 vs 0.75±0.23,<0.01;图5L)表达显著上升。与DOX组相比,EP+DOX组Bnip3/Bcl-2(EP+DOX组vs DOX组,0.32±0.17 vs 1.84±0.55,<0.001;图5H)、Beclin1/Bcl-2(EP+DOX组vs DOX组,0.13±0.02 vs 0.42±0.17,<0.01;图5I)、Bax/Bcl-2(EP+DOX组vs DOX组,0.53±0.13 vs 1.93±0.49,<0.001;图5J)、Bad/Bcl-2(EP+DOX组vs DOX组,0.41±0.04 vs 1.50±0.44,<0.001;图5K)均显著更低。
2.4 EP抑制DOX诱导的心肌细胞代谢紊乱
大鼠心肌组织代谢组学检测结果显示,与C组相比,DOX组GSH(DOX组vs C组,1.40×107±5.29×106vs 3.22×107±6.74×106,<0.01;图6A)、亚精胺(DOX组vs C组,1.93×106±5.1×105vs 2.51×106±6.1×105,<0.05;图6F)、鸟氨酸(DOX组vs C组,3.59×105±6.64×104vs 5.41×105±1.12×105,<0.05;图6G)、NAD+(DOX组vs C组,7.66×104±3.84×104vs 11.39×104±7.08×104,<0.05;图6I)、NMN(DOX组vs C组,1.01×105±3.65×104vs 2.11×105±1.12×105,<0.05;图6K)、还原型烟酰胺腺嘌呤二核苷酸(DOX组vs C组,7.21×103±5.09×103vs 2.75×104±4.66×103,<0.05;图6L)、脱氧三磷酸腺苷(DOX组vs C组,5.29×103±2.12×103vs 7.16×103±4.61×103,<0.05;图6P)等代谢物相对富集含量显著更低,而氧化谷胱甘肽(DOX组vs C组,3.63×106±1.08×106vs 2.75×106±2.59×105,<0.05;图6B)、谷氨酸(DOX组vs C组,1.28×108±2.49×107vs 1.06×108±1.95×107,<0.05;图6C)、谷氨酰胺(DOX组 vs C组,2.41×108±1.16×107vs 2.29×108±1.61×107,<0.05;图6D)、精氨酸(DOX组vs C组,1.92×107±3.27×106vs 1.51×107±6.92×105,<0.05;图6E)、甘氨酸(DOX组 vs C组,3.19×105±7.34×104vs 2.84×105±6.78×104,<0.05;图6H)、丙酮酸(DOX组vs C组,1.78×104±4.94×103vs 1.44×104±5.64×103,<0.05;图6M)水平显著更高。与DOX组相比,EP+DOX组GSH(EP+DOX组vs DOX组,3.03×107±9.48×106vs 1.40×107±5.29×106,<0.01;图6A)、亚精胺(EP+DOX组vs DOX组,4.73×106±7.66×105vs 1.93×106±5.1×105,<0.01;图6F)、NAD+(EP+DOX组vs DOX组,4.73×106±7.66×105vs1.93×106±5.1×105,<0.05;图6I)、烟酰胺腺嘌呤二核苷酸(EP+DOX组vs DOX组,2.07×105±5.96×104 vs 7.27×104±1.63×104,<0.01;图6J)、β烟酰胺单核苷酸(EP+DOX组vs DOX组,5.32×105±2.54×105vs 1.01×105±3.65×104,<0.001;图6K)等代谢物富集水平显著更高。而氧化谷胱甘肽(EP+DOX组vs DOX组,2.19×106±6.16×105vs 3.63×106±1.08×106,<0.05;图6B)、谷氨酸(EP+DOX组vs DOX组,1.07×108±1.97×107vs 1.28×108±2.49×107,<0.05;图6C)、谷氨酰胺(EP+DOX组vs DOX组,1.85×108±3.19×107vs 2.41×108±1.16×107,<0.01;图6D)、精氨酸(EP+DOX组vs DOX组,1.13×107±4.05×106vs 1.92×107±3.28×106,<0.01;图6E)等代谢物富集程度显著更低。
图4 EP对DOX诱导的大鼠心肌组织的影响(400×)
Figure 4.Effect of EP on DOX-Induced Myocardial Tissue in Rats (400×)
注:A.心肌组织病理染色;B.大鼠心肌HE定量统计结果;C.大鼠心肌纤维化的定量统计结果;D.大鼠心肌IL-1β定量统计结果。
EP对抗DOX心脏损伤涉及GSH合成通路、NAD+合成通路,精氨酸代谢通路,具体表现在下调精氨酸和谷氨酸等氨基酸水平、促进谷氨酰胺代谢上调GSH、NAD+水平(图6A、E),对DOX引起的GSH、NAD+、精氨酸、鸟氨酸等物质代谢具有显著改善效果(图7C~E)。
2.5 GSH与Bcl-2相互作用影响EP抗DOX心脏损伤效果
大鼠心肌GSH与Bcl-2免疫荧光共定位检测结果(400×,bar=100 μm)显示,C组GSH为绿色免疫荧光阳性产物均匀分布于心肌细胞内,细胞核为蓝色。C组Bcl-2为红色免疫荧光阳性产物,成颗粒状聚集分布于细胞内,细胞核为蓝色。C组图像融合,可见GSH与Bcl-2共定位部分为黄色。与C组相比,DOX组GSH绿色荧光分散,GSH与Bcl-2共定位程度显著更低(DOX组vs C组,38.30%±13.08% vs 55.78%±9.28%,<0.05;图8D),EP+DOX组的GSH与Bcl-2的荧光强度以及共定位情况与C组相近,显著高于DOX组(EP+DOX组 vs DOX组,58.16%±12.15% vs 38.30%±13.08%,<0.01;图8D)。
Figure 5.Results of the Expression of Apoptosis-Related Proteins in Rats Myocardial Tissues
免疫共沉淀结果表明,Bcl-2和OGC免疫共沉淀和Bcl-2与GSH共定位百分比的共聚焦结果一致。结果显示,与C组相比,DOX组Beclin1(DOX组vs C组,0.13±0.06 vs 0.20±0.03,<0.05;图9B)、Bax(DOX组vs C组,0.83±0.19 vs 1.22±0.29,<0.05;图9C)、OGC(DOX组vs C组,0.75±0.22 vs 1.49±0.25,<0.01;图9D)与Bcl-2相互作用显著更弱。与DOX组相比,EP+DOX组Beclin1(EP+DOX组vs DOX组,0.26±0.02 vs 0.13±0.06,<0.01;图9B)、Bax(EP+DOX组vs DOX组,1.23±0.13 vs 0.83±0.19,<0.05;图9C)、OGC(EP+DOX组vs DOX组,1.64±0.24 vs 0.75±0.22,<0.001;图9D)与Bcl-2相互作用显著更强。
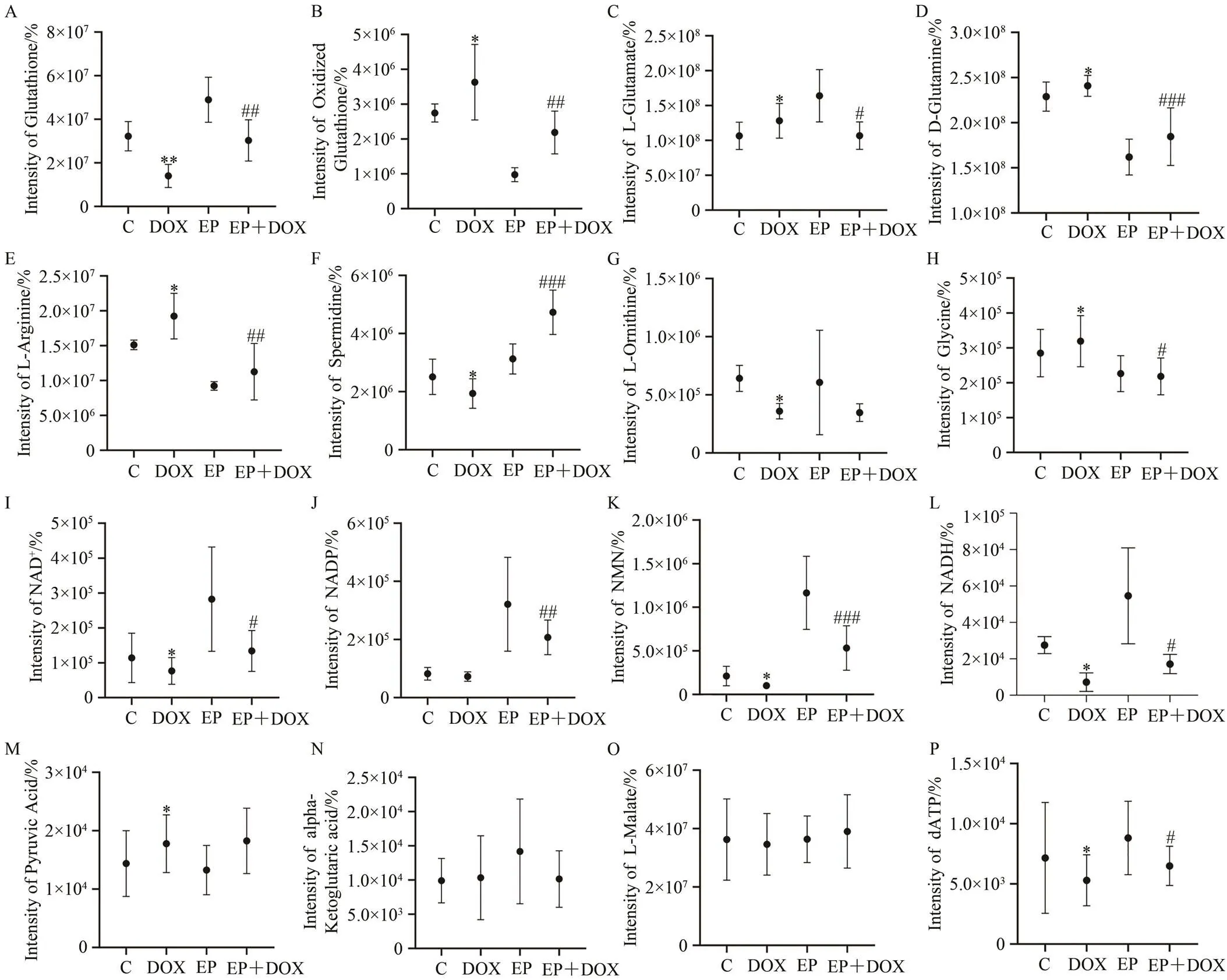
注:oxidized GSH.氧化谷胱甘肽;L-Glutamate.谷氨酸;D-Glutamine.谷氨酰胺;L-Arginine.精氨酸;Spermidine.亚精胺;L-Ornithine.鸟氨酸;Glycine.甘氨酸;NADP.烟酰胺腺嘌呤二核苷酸;NMN.β烟酰胺单核苷酸;NADH.还原型烟酰胺腺嘌呤二核苷酸;pyruvic acid.丙酮酸;alpha-Ketoglutaric acid.α-酮戊二酸;L-Malate.苹果酸;dATP.脱氧三磷酸腺苷。
Figure 6.Comparison between Groups in the Contents of Key Substances of GSH-Related Metabolic Pathways
利用生物信息学技术,对KEGG、Wiki pathway、NDEx、PISCQUIC、String等数据库中关于本研究主要代谢分子及关键蛋白互作PPI数据进行分析,利用Cytoscape 3.8.2(http://cytoscape.org)对机制重叠部分进行分选,进一步结合相关研究及本研究的发现对本文的机制进行绘制。具体机制可能主要涉及(图10):1)GSH的氧化还原生成机制;2)GSH的底物合成机制;3)Bcl-2促进GSH基因表达机制;4)Bcl-2促进GSH胞内再分配等。
3 讨论
EP作为一种强烈刺激因素,在极大提高心肌耗氧量的同时,造成反复短暂的缺血缺氧,通过增强线粒体相关能量代谢调控机制触发内源性保护(原阳等,2015)。本研究中的EP模型沿用Domenech等(2002)提出的概念,即通过反复短时间大强度间歇有氧运动,产生类似于缺血预适应(ischemic preconditioning)的内源性心脏保护效果,使心肌在随后持续性缺血缺氧损伤中得到保护。DOX心脏损伤药代动力学模型表明,DOX在体内峰值浓度时间为注射后2~12 h(Reich et al., 1979),EP的心脏保护效应能够较好覆盖DOX在体内的急性损伤作用期(王传志等,2022)。本研究中单次EP显示出良好的心脏保护效果。研究发现,DOX所致心肌发生明显的纤维化,细胞发生皱缩和炎性变化,基质中可见炎性细胞明显浸润,心肌纤维溶解破裂,透射电镜可见部分线粒体肿胀破裂,结合氨基酸代谢异常和能量代谢异常进一步证明了DOX心脏毒性的线粒体相关机制。与此同时,本研究发现DOX所致的心肌损伤,导致心脏结构发生代偿性改变,心室扩大,心脏泵血功能LVEF下降,是DOX引起心衰的重要原因(Gomes-Santos et al., 2021)。DOX急性损伤性应激还使肌细胞膜破裂,肌原纤维断裂,细胞内部的LDH、c Tn I泄漏至血液,造成血浆c Tn I、LDH水平急剧升高(Zou et al., 2022)。本研究同样发现,DOX使心肌细胞氧化应激损伤标志产物MDA、LDH、c Tn I含量升高并泄漏至血液,致使血浆c Tn I和LDH含量升高。本研究中,EP+DOX组的c Tn I水平接近C组水平,推测与干预5天后心脏损伤标志物恢复至基线水平有关。先前研究表明,由运动引起的c Tn I升高会在24 h内逐渐恢复至基线水平(Stewart et al., 2016)。
Figure 7.Volcano Map, a Cluster Heat Map and a Metabolic Pathway Analysis Map of Differential Metabolites
Beclin1是哺乳动物自噬的重要介导基因,对于自噬的发生起着重要促进作用,Bcl-2与Beclin1相互作用抑制自噬过程。本研究发现,DOX引起Beclin1/Bcl-2显著增高,提示自噬发生,这种现象可能与DOX导致的Bcl-2基因表达抑制有关,DOX刺激导致Beclin1/Bcl-2复合体解离(李宏玉等,2020),也使Bax、Caspase3蛋白表达增加,因此,DOX可能通过诱导过度自噬引起心肌细胞功能障碍和心肌细胞的凋亡。Beclin1/Bcl-2的比值也在一定程度上反映前凋亡与凋亡性自噬的程度(Yuan et al., 2018)。结合DOX导致心肌线粒体氧化应激损伤的结果,本研究认为线粒体功能障碍是心肌细胞凋亡和心脏形态机能改变的起始因素。前期研究发现(原阳等,2015),EP诱导Bcl-2表达可恢复线粒体跨膜电位(ΔΨm)并维持Ca2+稳态,进一步抑制线粒体内Ca2+泄漏和线粒体肿胀的发生,可以抑制线粒体细胞色素C(Cytochrome c,Cyt-c)等凋亡因子释放,进而通过Caspase3级联反应抑制细胞凋亡(Xing et al., 2022)。
唯BH-3类蛋白是细胞内广泛存在的前凋亡因子,也包括Beclin1。其他BH-3类凋亡蛋白与Bcl-2间竞争结合,加剧Beclin1介导的Ⅱ型凋亡发生,表明充分的Bcl-2合成对维持应激状态下细胞活性起到重要作用(Yuan et al., 2020)。Bcl-2也可通过抑制TNF-α降低炎性和凋亡信号表达(原阳等,2015)(图10),本研究中,DOX造成的TNF-α表达增加,炎性加重,EP有效促进了Bcl-2表达,改善DOX引起的TNF-α高表达,因此EP改善DOX损伤可能与Bcl-2抑制炎性因子表达和降低细胞凋亡有关。Bcl-2腺病毒/E1B19k D相互作用蛋白3(bcl-2 adenovirus/E1B 19k D interacting protein 3,Bnip3)是另一种BH-3类促凋亡蛋白,在正常情况下也充当自噬和线粒体自噬的诱导剂,以及造成线粒体膜通透性升高(Lee et al., 2020)。在本研究中,DOX刺激导致氧化应激损伤以及细胞凋亡,上调Bnip3,使Bnip3/Bcl-2比值升高。EP处理后,Bnip3和Beclin1表达显著下降,因此,EP诱导的抗凋亡作用可能与Bnip3下调改善心肌线粒体稳态、抗氧化状态、抗凋亡水平密切相关。在EP+DOX干预的情况下,Bnip3进一步下调,可能与DOX诱导线粒体膜通透性提高有关,DOX激活线粒体外膜Bax/Bak造孔机制,诱导线粒体功能障碍和线粒体源的I型及Ⅱ型细胞凋亡(原阳等,2015;El-Said et al., 2019; Li et al., 2018)。综上,本研究DOX干预诱导了大鼠心肌细胞内氧化应激水平升高,前凋亡BH-3类蛋白/Bcl-2比值水平上升,凋亡蛋白解离程度升高,Caspase3表达上升,促进心肌细胞凋亡,EP通过Bcl-2抑制上述机制改善DOX心脏毒性(Qiu et al., 2022)。
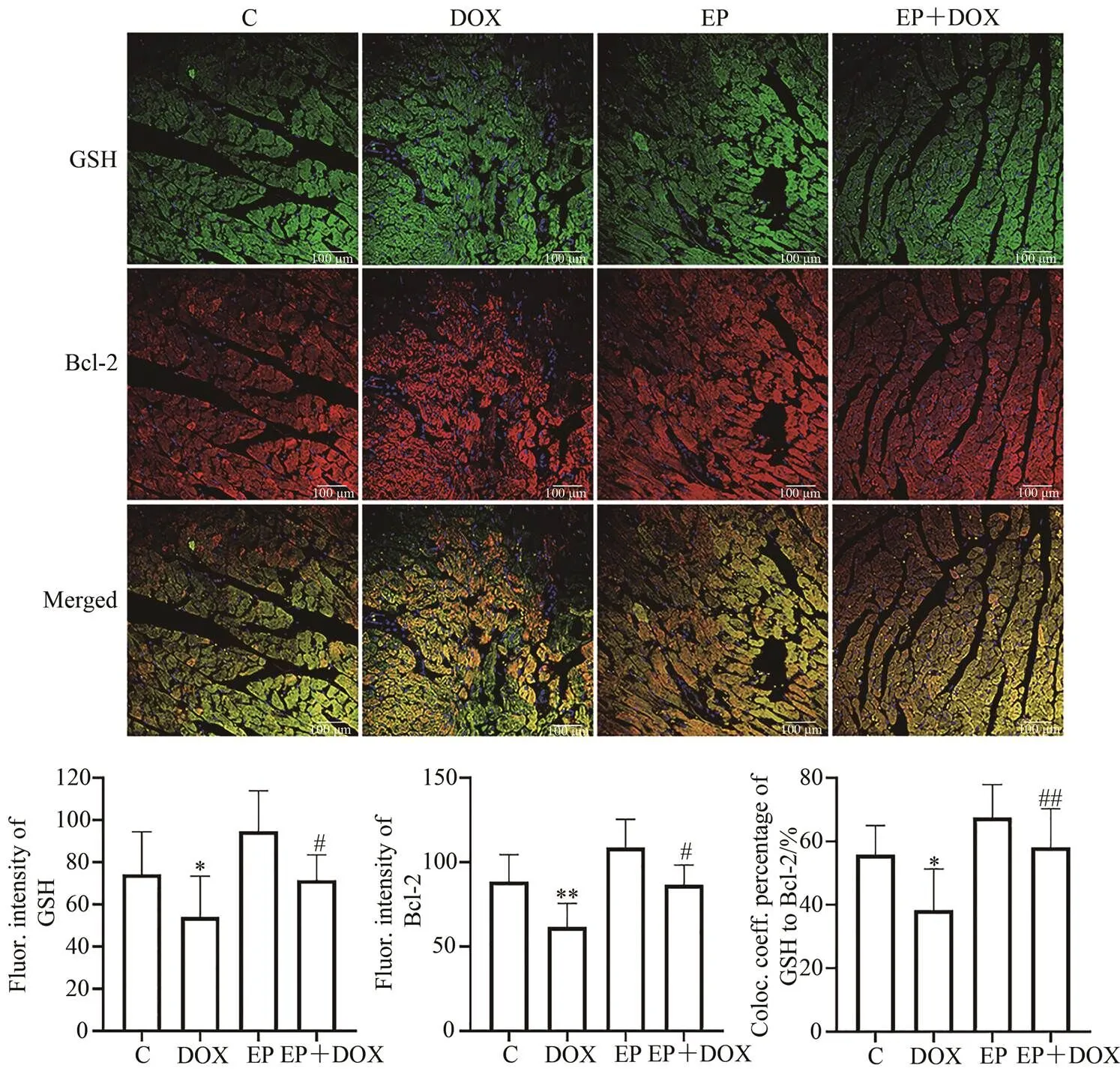
图8 大鼠心肌组织GSH和Bcl-2的免疫荧光双标结果(×400)
Figure 8.Immunofluorescence Double Labeled Results of GSH and Bcl-2 in Rats Myocardial Tissues (×400)
EP与DOX刺激引发凋亡因子含量变化可能与心脏组织代谢物改变密切相关。本研究发现,EP改善GSH代谢可能是EP抑制DOX心肌毒性的核心代谢机制。GSH是人体内最丰富的内源性抗氧化剂,约90%储存于细胞质,其余10%位于线粒体、细胞核和内质网中,GSH在细胞质中由谷氨酸、半胱氨酸、甘氨酸通过连续2步合成,细胞中的氧化还原状态、转录因子活性、凋亡等与GSH/GSSG氧化还原偶联密切相关(杨凤娟等,2021)(图10)。DOX诱导的线粒体损伤促使ROS显著增加,导致GSH/GSSG氧化还原失衡,GSH耗竭,DOX导致氧化应激平衡被打破,诱导程序性细胞死亡,本研究组学结果显示出EP改善DOX损伤的相关程序性细胞死亡机制。进一步,线粒体GSH耗竭发生在细胞程序性死亡的早期阶段,ROS积累则晚于GSH耗竭,因此认为线粒体GSH耗竭可能是诱发细胞凋亡的初始原因(Guha et al., 2011)。此外,GSH氧化还原反应发生改变还可使TNF-α诱导细胞凋亡的敏感性增加、线粒体凋亡信号通路异常,本研究DOX导致的TNF-α表达升高可能是GSH代谢异常的重要原因。鸟氨酸参与GSH的合成代谢,本研究结果表明,DOX刺激导致GSH代谢合成异常,鸟氨酸循环水平升高,提示氨基酸参与直接供能消耗而不是用于合成氨基酸或蛋白。谷氨酰胺等的降低,造成GSH再生降低,最终导致清除ROS能力下降(Circu et al., 2012),本研究中DOX引起的GSH代谢异常可能是激活细胞凋亡或氧化应激的先决条件。

图9 大鼠心肌组织OGC蛋白、Bax、Beclin1与Bcl-2共沉淀情况
Figure 9.Coimmunoprecipitation of OGC Proteins, Bax and Beclin1 with Bcl-2 in Rats Cardiac Tissue
有研究发现,亚精胺能够抑制一氧化氮合酶(inducible nitric oxide synthase,iNOS)和阳离子氨基酸转运体(cationic amino acid transporters,CAT-2B)的表达,促进NO合成所需的L-Arginine消耗(Madeo et al., 2018)。本研究发现,EP+DOX组的亚精胺水平较EP组丰度更高,表明EP可以通过增加亚精胺代谢途径调节DOX诱导的心脏毒性。精氨酸能够通过刺激GSH的生物合成,激活Nrf2途径诱导机体抗氧化反应,对抗氧化应激损伤(Liang et al., 2018),本研究发现,DOX使精氨酸的利用度下降,致使GSH生物合成下降,造成了心脏氧化应激损伤加剧。在DOX刺激前进行一次性EP,可以调节GSH相关代谢产物的代谢,促进GSH生物合成,对抗氧化应激损伤。前人研究表明,GSH在肿瘤微环境中扮演重要角色,GSH可减少肿瘤细胞中基因毒性剂的积累,线粒体GSH的特异性增加导致抗凋亡蛋白Bcl-2的增加,二者共同作用,从而抵消药物介导的氧化应激与凋亡反应(Wang et al., 2016),本研究也验证了EP通过调节GSH代谢,促进与Bcl-2的相互作用,发挥保护心脏的作用。综上,EP一方面促进DOX应激情况下能量的稳定合成,另一方面有助于ROS的清除效率进而抑制氧化应激损伤。针对谷氨酰胺、GSH的外源补充形式可能是未来协同EP治疗和预防DOX心脏损伤的联合作用靶点形式,EP诱导适度GSH存在其干预形式的便利和价值。但仍需要注意的是,过度摄入GSH可能会导致ROS信号传递的稳态失衡,从而对细胞氧化还原状态产生不利影响(Gusarov et al., 2021)。本研究还发现EP可诱导NMN合成,可能是EP上调GSH表达的重要因素,其中可能涉及谷氨酸底物合成的上调以及NAD+本身在GSH氧化还原反应中扮演的角色,具体机制还有待进一步深入研究(Yuan et al., 2022)。
在协同层面,Bcl-2通过调节线粒体GSH池,有助于线粒体发挥抗氧化功能,抑制GSH向线粒体转运,可使线粒体GSH耗竭,从而导致线粒体氧化应激加剧,启动凋亡级联反应和细胞死亡(D’Alessio et al., 2004)。为了探究Bcl-2与GSH相互作用的机制,进一步研究发现基因层面可能与YAP激活有关,GSH消耗可能触发基因转录调控,YAP转录因子激活参与GSH1表达,反馈机制促进GSH合成(Wheeler et al., 2003)。已有研究表明,Bcl-2是YAP-TED1活性复合物的直接靶向基因,并发现YAP敲除可诱导Bcl-2表达水平的下降,YAP能够直接增加Bcl-2基因的转录(Chen et al., 2018)。YAP在S127位点磷酸化剪切YAP蛋白,抑制其表达。抑制该位点磷酸化对于YAP信号的核定位和转录过程具有积极效应,这可能有利于促进Bcl-2与GSH转录,而产生心脏保护效应(Tao et al., 2021; Wang et al., 2020)。有研究认为,DOX上调YAPS127磷酸化水平,进而抑制YAP是导致心肌细胞凋亡的重要原因(Tao et al., 2021),EP有效抑制了上述DOX对YAP的调节,促进YAP/Bcl-2轴上调,这可能是EP心脏保护的新机制。
本研究中荧光双染和免疫共沉淀结果进一步表明,Bcl-2与GSH的直接协同关系可能是EP抑制DOX心脏损伤的重要原因,GSH通过线粒体膜内阴离子转运体(DIC、OGC、TCC)进入线粒体内发挥抗氧化作用,通过化学抑制OGC转运功能或使用siRNA敲除Bcl-2导致线粒体GSH水平下降,稳定的OGC细胞系对氧化应激敏感性恢复,在使用重组蛋白或瞬时转染的几个系统中发现,Bcl-2和OGC可以以GSH依赖的方式相互作用(Wilkins et al., 2014)。本研究结果显示,EPS提高Bcl-2与OGC相互作用水平,表明Bcl-2与OGC在促进线粒体GSH转运方面的协同机制抑制了DOX引起的线粒体损伤以及GSH代谢的异常。此外,EP诱导心肌细胞NADPH的增加,提供了GSH再生的酶促环境,随着GSH水平的增加,GSH与Bcl-2结合,形成线粒体GSH孔道促进GSH进入线粒体,发挥抗氧化作用,抑制DOX诱导的线粒体源的细胞凋亡,该机制为EP诱导的GSH心脏保护作用提供了分子基础(Kowaltowski et al., 2005; Wilkins et al., 2012)。

图10 Bcl-2与GSH在运动预适应抑制阿霉素心脏毒性的可能机制
Figure 10.Possible Mechanism of Bcl-2 and GSH in Exercise Precondition to Inhibit Doxorubicin Cardiotoxicity
4 结论
本研究发现,EP可显著降低DOX心脏毒性,增强心功能、抑制心肌炎症和纤维化,其作用与EP刺激抑制心肌氧化应激损伤与细胞凋亡密切相关。EP通过促进抗凋亡基因Bcl-2高表达、抑制BH-3类蛋白等凋亡或前凋亡相关蛋白表达,促进GSH合成,及其相关NAD+合成和精氨酸消耗,促进GSH与Bcl-2相互作用,实现心脏保护效应。调控线粒体GSH转运可能是EP治疗DOX诱导的Bcl-2表达下降致细胞凋亡的重要靶点。
陈天然,潘珊珊,2021. 运动预适应:心脏康复预防与治疗的新策略[J]. 上海体育学院学报, 45(10): 72-80.
李宏玉,张继瑶,张钰,等,2020. 运动预处理对心肌缺血再灌注损伤大鼠自噬相关蛋白表达及心肌细胞凋亡的影响[J]. 中国康复理论与实践, 26(8): 903-907.
苏毅馨,朱世杰,薛鹏,等,2020. 阿霉素心脏毒性的研究进展[J]. 临床肿瘤学杂志, 25(11): 1048-1054.
王传志,王蔚,张双双,等,2022. 运动预适应降低肥胖人群运动心血管事件风险[J]. 生理学报,74(5): 792-804.
杨凤娟,谭宁,张天禹,等,2021. 谷胱甘肽在肿瘤细胞发生铁死亡过程中的作用研究[J]. 世界华人消化杂志, 29(15): 901-907.
原阳,潘珊珊,2015. 活性氧介导氧化应激在心血管应激及运动中对心肌线粒体和自噬作用的新进展[J]. 体育科学, 35(5): 71-77,97.
BERNARDO B C, OOI J Y Y, WEEKS K, et al., 2018. Understanding key mechanisms of exercise-induced cardiac protection to mitigate disease: Current knowledge and emerging concepts[J]. Physiol Rev, 98(1):419-475.
CHEN X Y, GU W T, WANG Q, et al., 2018. C-MYC and BCL-2 mediate YAP-regulated tumorigenesis in OSCC[J]. Oncotarget, 9(1): 668-679.
CIRCU M L, AW T Y, 2012. Glutathione and modulation of cell apoptosis[J]. Biochim Biophys Acta, 1823(10): 1767-1777.
D’ALESSIO M, CERELLA C, AMICI C, et al., 2004. Glutathione depletion up-regulates Bcl-2 in BSO-resistant cells[J]. Faseb j, 18(13): 1609-1611.
DOMENECH R, MACHO P, SCHWARZE H, et al., 2002. Exercise induces early and late myocardial preconditioning in dogs[J]. Cardiovasc Res, 55(3): 561-566.
EL-SAID N T, MOHAMED E A, TAHA R A, 2019. Irbesartan suppresses cardiac toxicity induced by doxorubicin via regulating the p38-MAPK/NF-κB and TGF-β1 pathways[J]. Naunyn Schmiedebergs Arch Pharmacol, 392(6): 647-658.
GOMES-SANTOS I L, JORDÃO C P, PASSOS C S, et al., 2021. Exercise training preserves myocardial strain and improves exercise tolerance in doxorubicin-induced cardiotoxicity[J]. Front Cardiovasc Med, doi: 10.3389/fcvm.2021.605993.
GUHA P, DEY A, SEN R, et al., 2011. Intracellular GSH depletion triggered mitochondrial BAX translocation to accomplish resveratrol-induced apoptosis in the U937 cell line[J]. J Pharmacol Exp Ther, 336(1): 206-214.
GUSAROV I, SHAMOVSKY I, PANI B, et al., 2021. Dietary thiols accelerate aging of C. elegans[J]. Nat Commun, 12(1): 4336.
KOSOKO A M, OLURINDE O J, AKINLOYE O A, 2017. Doxorubicin induced neuro- and cardiotoxicities in experimental rats: Protection against oxidative damage byStem bark[J]. Biochem Biophys Rep, 10: 303-317.
KOWALTOWSKI A J, FISKUM G, 2005. Redox mechanisms of cytoprotection by Bcl-2[J]. Antioxid Redox Signal, 7(3-4): 508-514.
LEE Y I, KWON I S, JANG Y C, et al., 2020. Endurance exercise attenuates doxorubicin-induced cardiotoxicity[J]. Med Sci Sports Exer, 52(1): 25-36.
LI M, YANG X, WANG S C, 2018. PTEN enhances nasal epithelial cell resistance to TNFα‑induced inflammatory injury by limiting mitophagy via repression of the TLR4‑JNK‑Bnip3 pathway[J]. Mol Med Rep, 18(3): 2973-2986.
LIANG M C, WANG Z X, LI H, et al., 2018. l-Arginine induces antioxidant response to prevent oxidative stress via stimulation of glutathione synthesis and activation of Nrf2 pathway[J]. Food Chem Toxicol, 115: 315-328.
MADEO F, EISENBERG T, PIETROCOLA F, et al., 2018. Spermidine in health and disease[J]. Science, 359(6374): eaan2788.
PILCO-FERRETO N, CALAF G M, 2016. Influence of doxorubicin on apoptosis and oxidative stress in breast cancer cell lines[J]. Int J Oncol, 49(2): 753-762.
QIU D, SONG S, WANG Y H, et al., 2022. NAD(P)H: Quinone oxidoreductase 1 attenuates oxidative stress and apoptosis by regulating Sirt1 in diabetic nephropathy[J]. J Transl Med, 20(1): 44.
RAWAT P S, JAISWAL A, KHURANA A, et al., 2021. Doxorubicin-induced cardiotoxicity: An update on the molecular mechanism and novel therapeutic strategies for effective management[J]. Biomed Pharmacother, doi: 10.1016/j.biopha.2021.111708.
REICHARDT P, TABONE M D, et al., 2018. Risk-benefit of dexrazoxane for preventing anthracycline-related cardiotoxicity: Re-evaluating the European labeling[J]. Future Oncol, 14(25): 2663-2676.
REICH S D, STEINBERG F, BACHUR N R, et al., 1979. Mathematical model for adriamycin (doxorubicin) pharmacokinetics[J]. Cancer Chemother Pharmacol, 3(2): 125-131.
SALEH D O, MAHMOUD S S, HASSAN A, et al., 2022. Doxorubicin-induced hepatic toxicity in rats: Mechanistic protective role of Omega-3 fatty acids through Nrf2/HO-1 activation and PI3K/Akt/GSK-3β axis modulation[J]. Saudi J Biol Sci, doi: 10.1016/j.sjbs. 2022.103308.
SUNG H, FERLAY J, SIEGEL R L, et al., 2021. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 71: 209-249.
TAO R H, KOBAYASHI M, YANG Y Z, et al., 2021. Exercise inhibits doxorubicin-induced damage to cardiac vessels and activation of Hippo/YAP-mediated apoptosis[J]. Cancers, doi: 10.3390/cancers13112740.
WANG H, XU P, LUO X F, et al., 2020. Phosphorylation of Yes-associated protein impairs trophoblast invasion and migration: Implications for the pathogenesis of fetal growth restriction[J]. Biol Reprod, 103(4): 866-879.
WANG W, KRYCZEK I, DOSTÁL L, et al., 2016. Effector T cells abrogate stroma-mediated chemoresistance in ovarian cancer[J]. Cell, 165(5): 1092-1105.
WHEELER G L, TROTTER E W, DAWES I W, et al., 2003. Coupling of the transcriptional regulation of glutathione biosynthesis to the availability of glutathione and methionine via the Met4 and Yap1 transcription factors[J]. J Biol Chem, 278(50): 49920-49928.
WILKINS H M, BROCK S, GRAY J J, et al., 2014. Stable over-expression of the 2-oxoglutarate carrier enhances neuronal cell resistance to oxidative stress via Bcl-2-dependent mitochondrial GSH transport[J]. J Neurochem, 130(1): 75-86.
WILKINS H M, MARQUARDT K, LASH L H, et al., 2012. Bcl-2 is a novel interacting partner for the 2-oxoglutarate carrier and a key regulator of mitochondrial glutathione[J]. Free Radic Biol Med, 52(2): 410-419.
XING J J, MI X J, HOU J G, et al., 2022. Maltol mitigates cisplatin-evoked cardiotoxicity via inhibiting the PI3K/Akt signaling pathway in rodents in vivo and in vitro[J]. Phytother Res, 36(4):1724-1735.
YUAN J Q, YUAN Y, PAN S S, et al., 2020. Altered expression levels of autophagy-associated proteins during exercise preconditioning indicate the involvement of autophagy in cardioprotection against exercise-induced myocardial injury[J]. J Physiol Sci, 70(1): 10.
YUAN Y, LIANG B, LIU X L, et al., 2022. Targeting NAD+: Is it a common strategy to delay heart aging?[J]. Cell Death Discov, 8(1): 230.
YUAN Y, PAN S S, WAN D F, et al., 2018. H2O2signaling-triggered PI3K mediates mitochondrial protection to participate in early cardioprotection by exercise preconditioning[J]. Oxid Med Cell Longev, doi: 10.1155/2018/1916841.
ZOU L F, LIANG B, GAO Y Z, et al., 2022. Nicotinic acid riboside regulates Nrf-2/P62-related oxidative stress and autophagy to attenuate doxorubicin-induced cardiomyocyte injury[J]. Biomed Res Int, doi: 10.1155/2022/6293329.
Exercise Preconditioning Promotes GSH/Bcl-2 Synthesis and Interaction to Inhibit Cardiac Injury by Doxorubicin
WANG Chuanzhi1,ZHANG Shuangshuang1,HAO Yuerong1,LUO Lijie2,YUAN Yang1*
Objective:To investigate the mechanisms of GSH interaction with Bcl-2 following one-time exercise precondition (EP) in reducing cardiotoxicity induced by DOX treatment of cancer.Methods:Forty 19-week-old female SD rats were randomly divided into control group (C), doxorubicin group (DOX), exercise preconditioning group (EP), and exercise preconditioning + doxorubicin group (EP+DOX), 10 rats in each group. The Dox group rats were injected with doxorubicin, EP group rats were conducted about of high-intensity intermittent exercise, and the EP+DOX group rats were injected with doxorubicin 24 h after EP. Cardiac ultrasound was used to detect cardiac function in rats; chemical fluorescence immunoassay was used to detect the expression level of myocardial injury markers; histological staining and transmission electron microscopy were used to observe and analyze the histopathological changes of myocardium; Western blot was used to detect myocardial apoptosis and pro-survival gene-related protein expression; Metabolomics analysis was performed to explore the changes of myocardial metabolites and metabolic pathways; immunoprecipitation was used to detect the interaction between Bcl-2 and OGC (GSH transporter protein); immunofluorescence double-labeling was used to analyze the co-localization of GSH and Bcl-2.Results:In the DOX group, the myocardial mitochondria were swollen, the outer membrane was ruptured, the volume increased, and the mitochondrial cristae were disorganized or even broken; in the mitochondrial matrix, the linear dense cristae were visible, and the cloudy flocculent structures were appeared. Compared with group C, the cardiac function of rats in the DOX group was significantly decreased; the serum c Tn I, LDH, and MDA contents of myocardial injury indexes were significantly higher; the symptoms of myocardial cell injury, fibrosis, and inflammation were obvious; the expression levels of anti-apoptotic protein Bcl-2 and cardiomyocytes were significantly lower, and the expression of apoptotic proteins such as Bad, Bax and Caspase3 were significantly higher; YAP phosphorylation level was significantly increased; GSH and NAD+metabolism level were significantly lower; Bcl-2 and OGC interaction was significantly lower; Bcl-2 and GSH co-localization level was significantly lower. Compared with the DOX group, the EP+DOX group showed improvements in all of the above indicators.Conclusions: The classical EP can attenuate DOX treatment-induced apoptosis and oxidative stress injury in cardiac myocytes by promoting GSH/Bcl-2 interaction, and it also can inhibit inflammation and fibrosis, and improve cardiac function.
1000-677X(2023)01-0060-14
10.16469/j.css.202301007
2022-07-29;
2022-12-20
国家自然科学基金(32000830);中国博士后科学基金第14批特别资助(2021T140356)。
王传志(1998-),男,在读硕士研究生,主要研究方向为运动与心血管健康,E-mail:1327472591@qq.com。
原阳(1989-),男,讲师,博士,硕士研究生导师,主要研究方向为运动与心血管健康,E-mail:yuanyangofficial@ yeah.net。
G804.7
A

