色杆菌灭活疫苗的制备与免疫效果评价
林琳 刘蓓 徐素慧 周伦江 王隆柏 罗伟铭 何晓聪 陈云钦 黄杭 修云芳

摘 要:為防控小熊猫色杆菌病,按细菌灭活疫苗制备程序将海峡(福州)大熊猫研究交流中心2008年、2020年分离的2株色杆菌CV08毒株和CV20毒株经条件优化后灭活,分别制备成灭活菌液与铝胶佐剂联用制备成灭活疫苗。以BALB/c小鼠为试验动物,建立色杆菌感染模型,用2种方式接种CV20毒株灭活疫苗,比较2种接种途径效果。进一步设计2株色杆菌半数致死量(LD50)梯度对二免后小鼠进行攻毒保护试验,同时进行交叉攻毒保护试验。结果表明:CV20毒株灭活疫苗肌肉注射效果优于皮下注射。CV08毒株和CV20毒株对每只小鼠的LD50分别为3.2×108、5×107CFU。色杆菌CV08毒株灭活疫苗对不同LD50攻毒小鼠的保护率为83%、 70% 、60% ;色杆菌CV20毒株灭活疫苗对不同LD50攻毒小鼠的保护率为75% 、70% 、10%。试验制备的CV08、CV20毒株疫苗含菌量均为4×109 CFU·mL-1,安全检验合格,能对自身菌株感染产生较好的保护效果但无交叉保护效果。
关键词:小熊猫;色杆菌;灭活疫苗;免疫保护
中图分类号:S 859.93 文献标志码:A 文章编号:0253-2301(2023)03-0051-05
DOI: 10.13651/j.cnki.fjnykj.2023.03.009
Abstract: In order to prevent and control the Chromobacterium infection in red pandas, according to the preparation procedure of bacterial inactivated vaccine, two strains of Chromobacterium CV08 strain and CV20 virulent strain isolated from Straits (Fuzhou) Giant Panda Research and Exchange Center in 2008 and 2020 were inactivated after the optimization of conditions, and then the inactivated bacteria solution was prepared by combining with the aluminumcontaining adjuvants to produce the inactivated vaccine. The BALB/c mice were used as the experimental animals to establish a model of Chromobacterium infection. The inactivated vaccine of CV20 virulent strain was inoculated in two ways to compare the effects of the two inoculation routes. The median lethal dose (LD50) gradient of two strains of Chromobacterium was further designed to carry out the challenge protection test on mice after the secondary immunization, and the crosschallenge protection test was also carried out. The results showed that the effect of intramuscular injection with the inactivated vaccine of CV20 virulent strain was better than that of subcutaneous injection. The LD50 of CV08 virulent strain and CV20 virulent strain to each mouse was 3.2×108 and 5×107 CFU, respectively. The protective rates of the inactivated vaccine of Chromobacterium CV08 virulent strain on the mice challenged with different LD50 were 83%, 70% and 60%, respectively, while the protective rates of the inactivated vaccine of Chromobacterium CV20 virulent strain on the mice challenged with different LD50 were 75%, 70% and 10%, respectively. The bacterial contents of CV08 and CV20 virulent strain vaccines prepared in the experiment were both 4×109 CFU·mL-1, which passed the safety test and could produce better protective effect against the infection of their own strains but had no crossprotective effect.
Key words: Red panda; Chromobacterium; Inactivated vaccine; Immune protection
色杆菌属是一类革兰氏阴性,严格好氧或兼性厌氧菌,色杆菌属命名非常混乱,文献归纳色杆菌属共有14个成员[1],已确定的2个种为紫色色杆菌与蓝黑色杆菌[2]。其中紫色色杆菌在小熊猫种群中流行主要以发热、食欲不振、呼吸困难为主要临床症状,致病性强、发病迅速、病死率高[3]。紫色色杆菌鲜有感染人,但感染后病程发展极为迅速,死亡率高,其发病机制尚不清楚,但大多数病人有被土壤或积水污染创伤或伤口的病历[4]。2008年7月,海峡(福州)大熊猫研究交流中心发现3只小熊猫感染色杆菌,病死率为100%。2020年,该中心6只小熊猫陆续感染色杆菌,病程发展很快,发现症状2~5 d死亡。2021年南京紫清湖野生动物世界发生6例色杆菌感染小熊猫病例,其中死亡5例,病死率达到83.3%[5],广州也有发现小熊猫感染色杆菌病例(内部交流资料)。关于色杆菌感染小熊猫的研究多为临床调查、疾病诊断、治疗等[3,5-8]。考虑到该病对于小熊猫的传染性和高病死率,若防治工作未做到位,该病可能会对圈养小熊猫种群造成毁灭性打击。保护易感动物是动物传染病防治要素之一,而接种有效疫苗是保护易感动物的重要手段。目前我国尚无针对小熊猫色杆菌的疫苗研究,本研究为小熊猫色杆菌的免疫接种研究提供参考数据。
1 材料与方法
1.1 试验菌株及小鼠
色杆菌为海峡(福州)大熊猫研究交流中心2008年、2020年从死亡小熊猫体内分离,纯化后用甘油保存法冻存于-70℃冰箱。
试验小鼠为6周雌性SPF级BALB/c小鼠(吴氏试验动物有限公司),体重均为20 g左右。
1.2 主要试剂
2%铝胶佐剂(法国InvivoGen公司)、40%甲醛溶液(西陇科学股份有限公司)、无菌PBS(BL550A,北京兰杰柯科技有限公司)、血琼脂平板(北京陆桥技术股份有限公司)。
1.3 试验设计
1.3.1 小鼠致病性试验 将保存的CV08、CV20菌种分别用血琼脂平板复苏,37℃培养24 h,之后刮平板菌落制菌液,4000 r·min-1,离心10 min,弃上清,用无菌PBS洗涤3次后加无菌PBS重悬。倍比稀释法进行活菌计数,确定攻毒剂量。取50只小鼠每组5只,2株菌液攻毒浓度均分为1.0×1010、1.0×109、1.0×108、1.0×107、1.0×106 CFU·mL-1 5个梯度。腹腔注射攻毒每只小鼠0.1 mL,观察14 d,统计各组小鼠的发病和死亡情况。参考改良寇氏(Korbor)法测定2株菌的半数致死量[9]。其计算公式为:
lgLD50=Xk-d(Pi-0.5)
式中Xk为最大对数剂量,d为相邻组对数剂量差值,i为分组号,Pi为死亡率。
1.3.2 优化灭活条件和疫苗制备及安全性检测
(1)优化灭活条件。按1.3.1中论述的方法配置2种菌液,分别加入浓度为0.02%、0.04%、0.06%、0.08%、0.10%、0.12%和0.14%,然后置于4℃、37℃两种温度下培养。在6、12、24、36和48 h取100 μL灭活液涂布于血琼脂平板上37℃培养48 h,观察结果。无菌落表明细菌灭活完全彻底。观察各种条件下平板菌落生长情况,选择所用浓度最小、灭活时间最短条件为最佳。
(2)疫苗制备。将最佳灭活条件灭活后的细菌液4000 r·min-1离心10 min,弃上清,收集菌体沉积。用无菌PBS洗涤3次除去甲醛和培养基,最后用无菌PBS重悬。洗涤后的细菌灭活菌(4×109 CFU·mL-1):铝胶佐剂=4∶1(V/V)的比例通过鲁尔接头与注射器充分混匀。疫苗4℃保存。
(3)疫苗安全性检测。将所制备的疫苗摇匀后,接种100 μL于血琼脂平板培养48 h观察有无杂菌生长。结合佐剂说明书确定免疫剂量,皮下注射100 μL、小腿肌肉注射50 μL。使用2倍免疫劑量用两种接种方式各注射2只小鼠,观察记录小鼠有无不良反应。
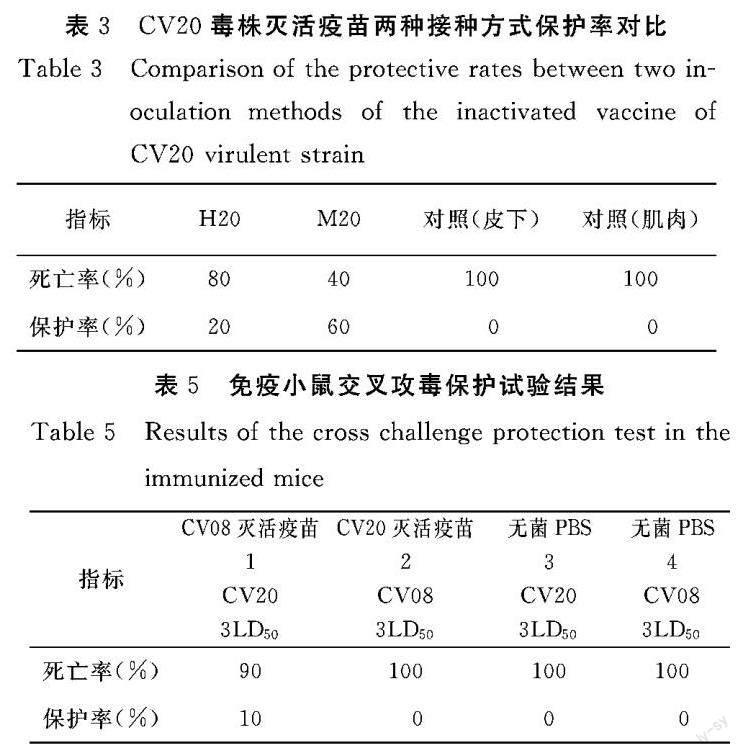
1.3.3 选择最优接种方式 取40只小鼠,每组10只,分为H20组、M20组、对照(皮下)组、对照(肌肉)组。H20组背部皮下注射(100 μL),M20组小腿肌肉注射(50 μL)接种CV20毒株灭活疫苗,对照(皮下)组、对照(肌肉)组分别接种等量无菌PBS。参考文献确定免疫时间[10-11],第14 d后进行二免,二免疫后21 d对4组小鼠腹腔注射5LD50 CV20活菌液,攻毒后观察14 d,观察记录小鼠死亡情况,计算免疫保护率(RPS),RPS=(1-免疫组死亡率/对照组死亡率)×100%[12]。
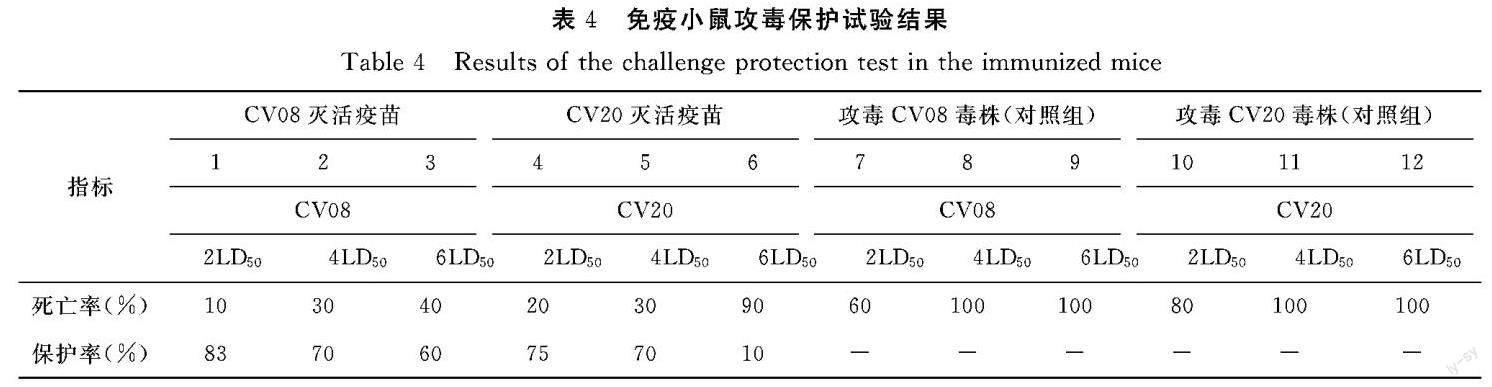
1.3.4 免疫小鼠攻毒保护试验 选取120只小鼠,分为12组,每组10只。采用小腿肌肉注射接种CV20毒株灭活疫苗,1、2、3组接种CV08毒株灭活疫苗,4、5、6组接种CV20毒株灭活疫苗,剩余6组为对照组接种等量无菌PBS。二免后21 d对免疫小鼠进行攻毒保护试验。1、2、3组攻毒CV08剂量分别为2LD50、4LD50、6LD50,7、8、9对照组攻毒CV08剂量分别为2LD50、4LD50、6LD50;4、5、6组攻毒CV20剂量分别为2LD50、4 LD50、6 D50,10、11、12对照组攻毒CV20毒株剂量分别为2LD50、4 LD50、6 LD50。攻毒后观察14 d,观察并记录小鼠死亡情况。从而计算免疫保护率。
1.3.5 免疫小鼠交叉攻毒保护试验 选取40只小鼠,分为4组,每组各10只,采用小腿肌肉注射免疫,1组接种CV08毒株灭活疫苗,2组接种CV20毒株灭活疫苗,3、4组为对照组等量注射无菌PBS。二免后21 d攻毒,对1、3组分别腹腔注射3LD50的CV20,2、4组分别腹腔注射3LD50的CV08。攻毒后观察14 d,观察并记录小鼠死亡情况。从而计算免疫保护率。
2 结果与分析
2.1 小鼠致病性试验结果
经过试验数据结果计算CV08毒株和CV20毒株对每只小鼠的LD50分别为3.2×108、5×107 CFU。
2.2 优化灭活条件和疫苗安全性检测
通过探究不同甲醛浓度、作用时间及温度对2株色杆菌菌液的灭活效果,表明甲醛浓度越大、温度越高,被完全灭活所需的时间越短。参考文献[13-14]选出最佳灭活条件为甲醛浓度0.04%、灭活时间 24 h、温度 37℃。试验数据见表1、2。
灭活疫苗无菌检验未检出任何活菌。肌肉注射小鼠注射部位无异常反应吸收良好,颈部皮下注射小鼠注射部位产生硬结,按压疼痛,56 d未消散,4只小鼠注射疫苗后均无异常行为,10 d后小鼠均健活。上述结果说明本试验疫苗安全。
2.3 确定最优接种方式
通过对比颈部皮下和小腿肌肉两种免疫方式,CV20毒株灭活疫苗经肌肉免疫可避免颈部皮下注射吸收不良,使用灭活疫苗用量相对较少的同时保护效果也更显著。CV20毒株灭活疫苗两种接种方式保护率对比见表3。
2.4 免疫小鼠攻毒保护试验
通过试验数据说明相较于对照组,CV08毒株灭活疫苗能产生较好的保护作用,攻毒剂量2LD50、4LD50、6LD50的14 d内保护率分别为83%、70%、 60%。相较于对照组,CV20毒株灭活疫苗能产生较好的保护作用。攻毒剂量2LD50、4LD50、6LD50的14 d内保护率分别为75%、70%、10%。攻毒保护试验结果见表4。
2.5 免疫小鼠交叉攻毒保护试验
通过试验数据说明2种菌株的灭活疫苗相互没有交叉保护力。免疫小鼠交叉攻毒保护试验结果见表5。
3 讨论与结论
本试验优化了2株色杆菌CV08毒株和CV20毒株的灭活条件。选择铝胶佐剂具有载体的作用,可缓慢释放抗原,避免酶的降解,增加抗体效价[15]与灭活菌液连用制备灭活疫苗,以BALB/c小鼠为试验动物建立感染模型。CV08、CV20毒株灭活疫苗在2LD50的攻毒剂量下对小鼠的保护率为83%与75%,均能对自身菌株感染产生较好的保护效果。本试验为色杆菌灭活疫苗的深入研究提供技术参考。在CV20毒株灭活疫苗的攻毒保护试验中,发现当攻毒剂量为6LD50时保护率仅为10%,与攻毒剂量为4LD50的保护率70%相比出现断崖式的减少,可能与菌株毒力因子相关,还需进一步研究。2种灭活疫苗无交叉保护力的情况,可能因为2种菌株为不同菌种,CV08毒株为色杆菌新种。
本试验通过CV20毒株灭活疫苗经颈部皮下和后腿肌肉2种不同的免疫途径的比较,发现小腿肌肉注射的保护率高于颈部皮下注射,且使用疫苗剂量更小,副作用更小,基于此本次试验采取后腿肌肉注射免疫。不同接种方式对血清抗体含量的影响需要建立检测小鼠血清抗体的间接ELISA方法测定。由于课题时间限制本次试验未建立间接ELISA方法,后期将完善建立间接ELISA方法,用于测定免疫小鼠血清内抗体含量,分析抗体消长规律以及不同接种方式对血清抗体含量的影响,有待进一步研究。
参考文献:
[1]王茜月,管飘萍,陈诗涵,等.1株溶血色杆菌的分离鉴定与基因组分析[J].江苏农业科学,2022,50(12):42-50.
[2]布坎南,吉本斯.伯杰细菌鉴定手册.第8版[M].北京:科学出版社, 1984:493-498.
[3]修云芳,邵良平,李碧春,等.紫色色杆菌感染小熊猫引起肺炎的临床调查[J].兽类学报,2011,31(1):108-112.
[4]SADIA S, KAMAL S M.Review on Chromobacterium violaceum, a Rare but Fatal Bacteria Needs Special Clinical Attention[J].Anwer Khan Modern Medical College Journal,2019,10(2):169-175.
[5]吕亚奎,刘辉,彭霄鹏,等.圈养环境下小熊猫紫色杆菌疾病診断和防治[J].亚洲兽医病例研究,2022,11(2):9-15.
[6]修云芳,邵良平,王隆伯,等.小熊猫紫色色杆菌变异株感染性肺炎的临床调查[C]//中国畜牧兽医学会家畜内科学分会.中国畜牧兽医学会家畜内科学分会2009年学术研讨会论文集,2009:414-417.
[7]修云芳,徐素慧,王隆柏,等.一例紫色色杆菌感染小熊猫的诊治报告[J].福建畜牧兽医,2020,42(6):85-86.
[8]DYER N W.Chromobacteriosis in a Chinese Red Panda (Ailurus Fulgens Styani)[J].Journal of Veterinary Diagnostic Investigation,2000,12(2):177-190.
[9]孟红亚.Bliss法测定YLN1415对小鼠的半数致死量(LD50)[J].凯里学院学报,2017,35(3):104-107.
[10]陶乔孝慈,邬琴,顾晓晓,等.牛源A型多杀性巴氏杆菌(Pm12)灭活疫苗的制备及小鼠攻毒保护试验[J].黑龙江畜牧兽医,2021(5):127-130,135.
[11]牟婧.牛源致病性大肠杆菌菌影制备及其免疫原性研究[D].黑龙江:东北农业大学,2020.
[12]赵山.罗非鱼无乳链球菌弱毒和灭活疫苗保护效果的比较研究[D].武汉:华中农业大学,2022.
[13]李正伟.维氏气单胞菌灭活疫苗的制备及其免疫保护效应研究[D].重庆:西南大学,2014.
[14]陈皓祥.花鲈哈维弧菌甲醛灭活疫苗的制备及其保护力研究[D].上海:上海海洋大学,2021.
[15]杨琳,傅哲彦,吕正兵,等.免疫佐剂分类及作用机制[J].中国生物工程杂志,2019,39(5):114-119.
(责任编辑:柯文辉)

