3D 打印磷酸钙涂层多孔镁金属支架的力学性能和生物相容性评估
叶健廷,缪铂尊,熊英杰,孟昊业,单验博,孙小涵,卢雨征,4,武艳斌,林万程,4,关聪聪,刘修志,王 鑫,许文静,袁广银,彭 江,周成福
1 佳木斯大学附属第一医院骨科,黑龙江佳木斯 154000;2 解放军总医院第四医学中心骨科医学部研究所,北京 100853;3 上海交通大学轻合金精密成型国家工程研究中心,上海 200240;4 首都医科大学附属北京世纪坛医院骨科,北京 100038
外伤、感染、人工关节失用等原因所致负重部位骨松质缺损的治疗是骨科面临的一大挑战[1]。负重部位骨松质的修复强调整体化置入,置入材料必须保证力学结构的完整性,同时与周围骨床尽快实现整合,便于传递载荷。多孔钛、钽等金属置入是目前有效的解决方法,但存在不可降解性、应力遮挡等缺点。生物陶瓷类材料因具有较好的生物相容性,受到科学家的青睐,但脆性等缺点限制了其在临床中推广[2-3]。不锈钢、金属坦棒、钛金属等临床常用金属能为骨松质缺损区提供足够的力学支撑,其不可降解性及高弹性模数等缺陷极易引发应力屏蔽和二次骨折,且上述金属缺乏生物活性,无法与周围组织实现快速整合[4]。生物可降解镁金属具有良好的生物相容性、优异的力学性能、生物可降解性,降解产物镁离子又是人体内必须元素之一,这使其逐渐走向前台[5-7]。但金属镁存在过快降解和大量产气等缺点。人们逐渐意识到镁金属表面添加涂层的重要性[8]。将镁金属与各种生物活性涂层结合可克服局部严重产气这一缺点。基于本研究所前期研究[9],采用选择性激光熔化工艺制备多孔镁金属支架,通过化学转化法在纯镁金属表面制备生物可降解磷酸钙涂层;本文侧重探讨磷酸钙涂层多孔镁金属支架的力学性能和生物相容性。
材料与方法
1 主要材料、试剂与仪器 镁粉(威豪,中国);胎牛血清(Gibco,美国);青-链霉素双抗(Gibco 15070063); 胰酶(Gibco 15050065);磷酸盐缓冲液(CORNING 21-031-CV);α-MEM 培养基(Gibco,美国);CCK-8 试剂盒(碧云天,中国);选择性激光熔化机器(Solution,德国);体视显微镜(Nikon DSRi2);酶标仪(Biotek,美国);扫描电子显微镜(Hitachi,日本)。
2 多孔镁金属支架的制备 利用Rhinoceros 6.0软件设计一种零平均曲率的三周期极小曲面结构。调整支架厚度,支架的孔隙率为75%,平均孔径为800 µm,支架的表面积/体积比为3.0 mm-1。制备过程中,惰性气体中氧含量低于1/10 000,使用选择性激光熔化机器将支架构建在镁基板上。采用气体雾化法制备球形镁粉末,并用于激光粉末熔炼。在能量密度为83.3 J/mm3、相邻层间旋转角度为73°的参数中打印,然后通过电火花加工将样品从构建板上移回,并在70%乙醇中超声清洗10 min,以去除未粘连的松散粉末。最后支架在10%高氯酸和90% C2H5OH 组成的电解液中经电化学抛光。
3 涂层的制备 采用化学转化法在多孔镁金属表面制备Ca-P 生物活性涂层。首先将60℃的NaOH/Na2CO3溶液1∶1 混合均匀,超声清洗多孔镁支架。去离子水和无水乙醇冲洗干净、晾干。将晾干后的多孔镁金属支架浸泡于钙磷处理溶液中12 h,用去离子水和无水乙醇清洗后晾干,即可获得有钙磷涂层的多孔镁支架。
4 支架材料的物理表征 利用体视显微镜观察无涂层多孔镁金属支架及Ca-P 涂层支架的外观。通过扫描电子显微镜和能量色散X 线能谱(Energydispersive X-ray spectrometry,EDS)观察磷酸钙涂层镁基支架的表面形貌和元素组成。
5 力学性能试验 圆柱多孔镁金属支架固定于电子万能试验机托盘上,分别在X 轴和Z 轴方向上压缩。调整位移速率为1 mm/min。自动记录载荷-位移曲线,直至位移达到3.0 mm。并绘制出应力-应变曲线。
6 制备浸提液 首先用75%乙醇将10 mm ×3 mm 的多孔镁金属支架消毒20 min 以上,密封袋封装,钴60 消毒。按照GB/T 16886.12-2017 和ISO 10993-12 标准,按照样品表面积与溶液体积比1.25 cm2/mL 将支架浸泡在添加10%胎牛血清和1%青霉素/链霉素的α-MEM 中,置于培养箱(5% CO2,37℃)中。72 h 后吸出浸提液,4℃保存用于后续实验。
7 细胞增殖实验 小鼠来源的胚胎成骨细胞前体细胞(MC3T3-E1)购于上海生命科学院细胞资源中心。在所有体外实验中均采用第4 ~ 6 代MC3T3-E1 细胞。支架提取物用于细胞培养。将圆盘样品(Φ10 × 3 mm)浸入3 mL 含10%胎牛血清的3 mL完全培养基中,100 U/mL 青霉素和100 U/mL 链霉素在细胞培养箱中培养72 h。然后将MC3T3-E1 以每孔3 × 103/mL 接种于96 孔细胞培养板,接种后第1 天细胞完全贴壁后,将浸提液取代完全培养基。细胞在37℃、5% CO2中孵育1 d、3 d、5 d 进行细胞增殖实验,将完全培养基组设为空白对照组。CCK-8 试剂盒用于评估每孔培养1.5 h 后的活细胞数,使用酶标仪在450 nm 处测量光密度(OD)值。
8 细胞黏附实验 由于无磷酸钙涂层镁金属降解过程中有明显气体产生,表面不适于接种细胞,因此细胞黏附实验仅在磷酸钙涂层支架进行。将MC3T3-E1 以1 × 104/孔接种于24 孔板无菌支架,培养7 d。接种细胞的支架用PBS 冲洗,在4.0%甲醛溶液中固定2 h,然后依次在50%、70%、80%、90%、95%和100%的乙醇溶液中脱水。CO2临界点干燥除乙醇后喷金,扫描电镜观察。
9 细胞活性实验 用活死染色评估细胞的活性。活死染色实验仅在浸提液培养下进行。MC3T3-E1以1 × 104/孔接种于24 孔板,待细胞贴壁后换支架浸提液培养72 h,将完全培养基组设为空白对照组,然后用500 µL 的混合染料染色10 min,体视显微镜观察。与钙黄素-AM 结合的活细胞呈绿色,而与乙锭-高二聚体-1 结合的死亡细胞呈红色。
10 统计学方法 采用GraphPad Prism 9.0 进行统计学分析以及绘图,计量资料以±s表示,组间比较采用t检验或单因素方差分析(Dunnett-t检验),P<0.05 为差异有统计学意义。
结 果
1 支架表面结构 无涂层多孔镁金属支架及Ca-P涂层支架均具有高度相互联通的大孔(图1)。无涂层多孔镁金属支架呈现三维贯通的开孔结构且孔壁表面较光滑(图1A),表面仅存在少量氧化层;磷酸钙涂层支架表面均匀覆盖了一层结晶状涂层(图1B)。

图1 Ca-P 涂层覆盖前后多孔镁样品数字图像(6×)A:无涂层支架;B:Ca-P 涂层支架Fig.1 Digital images of porous magnesium samples before and after Ca-P coating (6×)A: Non-coated scaffolds; B: Scaffolds coated with Ca-P
2 支架的表征 扫描电镜结果显示,无涂层支架表面光滑,呈现出融合体状,未见散在镁金属颗粒(图2A);Ca-P 涂层支架表面呈现花瓣状结构,均一铺展在多孔镁金属支架表面,且与多孔纯镁基体表面结合紧密,未观察到明显间隙(图2B)。能量色散X 线能谱分析结果,无涂层支架主要成分为Mg(图2C);Ca-P 生物活性涂层的主要成分为C、O、Ca、P元素(图2D)。
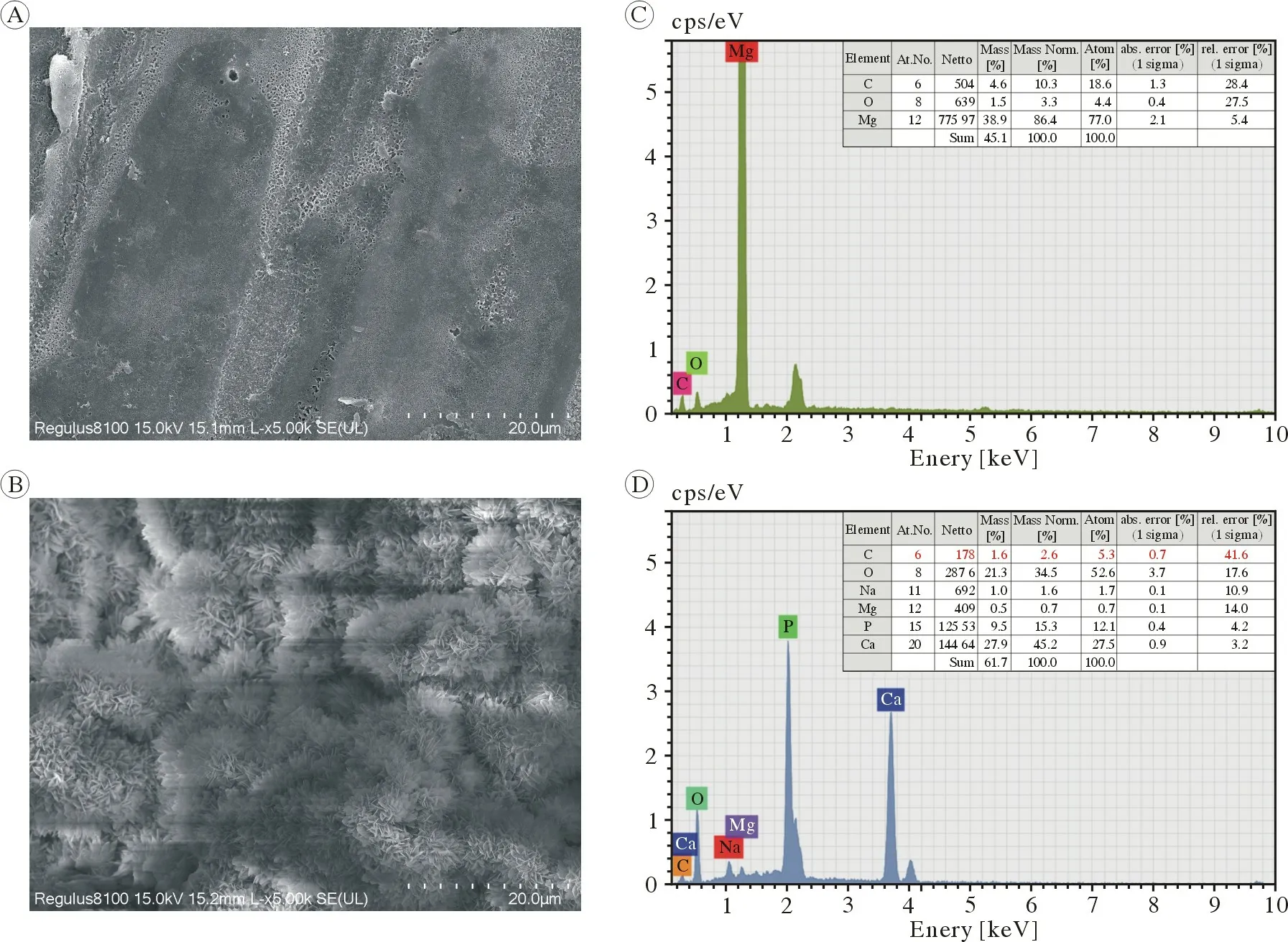
图2 支架表面形貌和元素图谱分析 (5 000×)A、C:无涂层支架及 EDS 能谱分析;B、D:Ca-P 涂层支架及EDS 能谱分析Fig.2 The surface morphologies and the corresponding elemental mapping images of the scaffolds (5 000×)A, C: Non-coated scaffolds and EDS analysis; B, D: Scaffolds coated with Ca-P EDS analysis
3 支架的力学性能 两种支架均具有优异的力学性能(图3)。Ca-P 涂层支架弹性模量高于无涂层组[(656 ± 8.7) Mpavs(623 ± 7.0) Mpa,P=0.007,n=3](图3B);压缩强度高于无涂层支架[(35.3 ±0.7) Mpavs(31 ± 1.0) Mpa,P=0.003,n=3](图3C)。
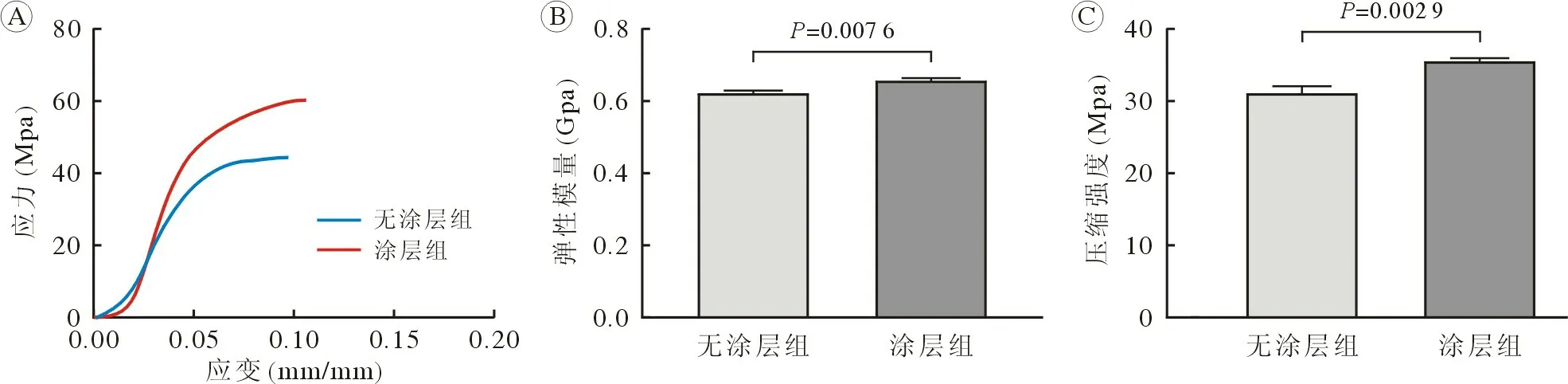
图3 支架力学性能A:应力-应变曲线;B:弹性模量;C:压缩强度Fig.3 The mechanical properties of the scaffoldsA: Stress-strain curves; B: Elastic modulus; C: Compression modulus
4 生物相容性 CCK-8 结果显示,与空白对照组相比,在第1 天和第3 天,无涂层支架浸提液未表现出显著毒性(P>0.05),第5 天表现出显著抑制(P<0.05);而Ca-P 涂层支架浸提液在各时间点对细胞都有显著促增殖作用(图4)。第3 天活死染色结果显示,Ca-P 涂层组表现出更多的活细胞和更少的死细胞,并且呈现出正常的细胞形态(图5)。涂层支架细胞黏附结果显示,细胞形态呈现舒展、片状、丝状多种形态与支架表面充分接触,细胞在支架表面大量增殖(图6)。
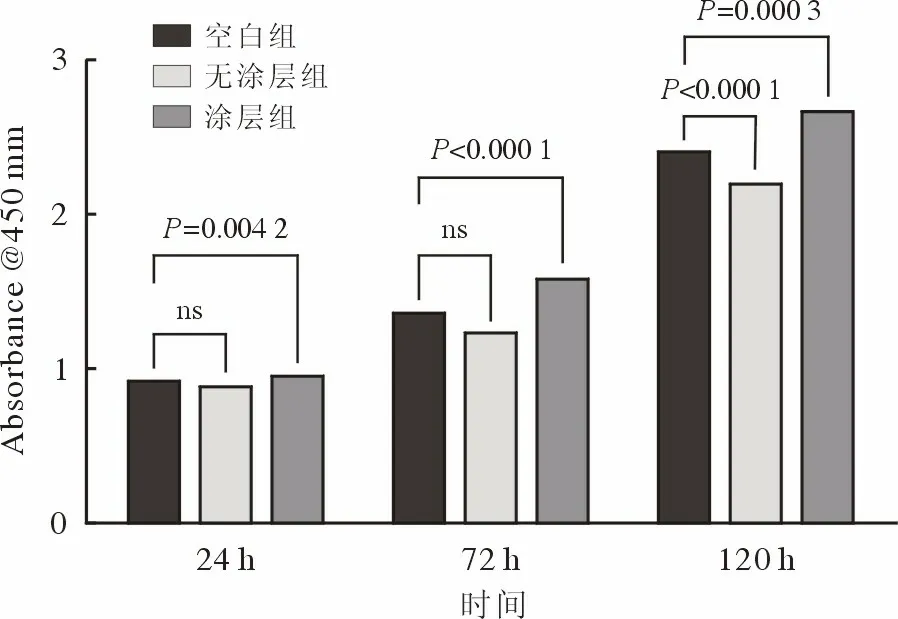
图4 CCK-8 法检测细胞在不同支架浸提液中培养 1 d、3 d、5 d 的增殖情况Fig.4 Cell counting kit-8 assay showing cell proliferation after culturing in the extract of different scaffolds for 1,3 and 5 d respectively
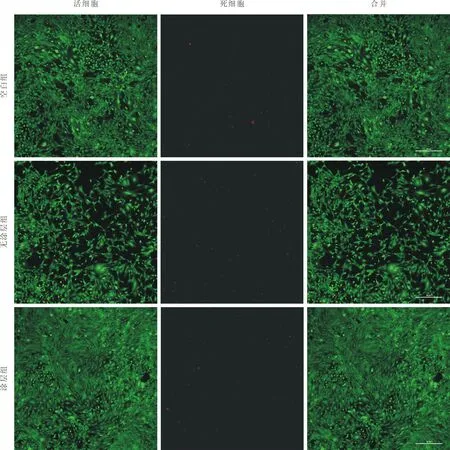
图5 培养3 d 后 MC3T3-E1 细胞活力活/死染色(红色,死亡细胞;绿色,活细胞。6×)Fig.5 Live/dead staining of MC3T3-E1 cell viability after 3 days of culture (red, dead cells; green, live cells. 6×)

图6 扫描电子显微镜观察 MC3T3E1 细胞在 Ca-P 涂层支架上的附着情况(500×)Fig.6 Scanning electron microscopy observation of MC3T3-E1 cell attachment on Ca-P coated scaffold (500×)
讨 论
目前,关于骨缺损修复金属支架的研究进展迅速,主要包括镁、锌、铜、钙、铝、钛、铁等金属材料的研究,其中镁金属材料是目前研究最广泛、最深入的可降解置入金属材料之一,其研究成果得到了全世界的认可,是目前非常有前途的医用金属材料。镁离子是人体细胞内仅次于钾离子的金属阳离子,参与催化和激活体内上百种生化反应,是人体内必不可少的一种金属离子[5,10-12]。Mg2+可促进骨形成和促血管生成,这使得镁基生物材料作为骨组织工程生物材料更具可行性[4,13-14]。镁金属(41 ~ 45 GPa)拥有与天然骨(3 ~ 20 GPa)相似的弹性模量和密度,能为置入区提供可靠且稳定的力学支撑。结合选择性激光熔化工艺,利用计算机程序构建仿生天然骨结构置入支架。因此,我们采用选择性激光熔化工艺,设计并打印出纯镁金属支架,并通过化学转化法在多孔镁金属支架表面添加Ca-P 生物活性涂层。
负重部位骨松质骨缺损支架材料应用必须同时具备以下基本特征: (1)具有较好的力学性能,维持骨修复过程中力学完整性,同时传递分布载荷[15];(2)良好的生物相容性,与周围组织实现快速整合[16];(3)具有多孔结构,利于新生骨和血管长入[17];(4)相对缓慢的降解速率,与新骨生成相匹配的降解速率和骨诱导是生物支架的重要功能[18]。
适宜且稳定的力学性能是维持负重部位骨缺损修复的重要前提,Wang 等[6]采用模板法制备的镁合金Mg-Nd-Zn-Zr (JDBM),孔隙率为70.6%其屈服强度为6.87 MPa,弹性模量为0.4 GPa,并拥有很好的成骨成血管效果和适宜的降解速度。然而,JDBM 支架的初始力学强度稍低于骨松质,不足以满足骨松质骨缺损区的初始力学强度。一些学者使用低温沉积技术制造PT 多孔支架,这种PT 支架呈现出具有适宜降解速率的小梁状几何形状[19-22]。然而,PT 支架[弹性模量=(45.7±5.4) MPa]置入的初始机械性能不足[20]。选择性激光熔化工艺是目前精确度较高,能准确还原骨微结构的先进手段,其推动了生物材料学的快速发展[23-24]。Lai 等[3]通过3D 打印方法制备了含不同镁浓度的PLGA/TCP 多孔支架,这种支架具有与天然骨相似的孔隙率和高联通性,并且拥有很显著的成骨成血管效果,但力学性能仍小于骨松质,不能为缺损区提供足够的初始力学支撑。Lin 等[14]采用3D 凝胶打印技术制备出多孔镁支架,该支架在体内外表现出很好的成骨效果,但该支架的屈服强度和弹性模量低于负重部位骨松质,表明该支架不能为负重部位骨松质提供有效的力学支撑。Dimitriou 等[25]通过3D 打印技术制备的多孔铁锰合金拥有很好的生物相容性和缓慢的降解速率。这种支架的力学性能结果表明,支架力学强度远高于负重部位骨松质,过高的力学强度易导致二次损伤。我们通过3D 打印工艺结合化学转化法制备的Ca-P 涂层多孔镁金属支架具有很好的力学性能,其屈服强度(35.3 ± 0.7) MPa,高于天然骨松质(12 MPa);Ca-P 涂层多孔镁金属支架弹性模量为(656 ± 8.7) MPa,在骨松质弹性模量40 ~ 1 400 MPa范围内,力学结果表明,我们制备的多孔镁金属支架的力学性能与骨松质相匹配。
扫描电镜观察显示,我们所制备的Ca-P 涂层多孔镁金属支架的涂层呈现出均一花瓣状结构,无缝隙结合紧密,这种独特的结构,显著增加了支架表面积和表面粗糙程度,意味着支架可接受更多细胞附着(图6)[26]。Carluccio 等[27]通过微弧氧化方法,在镁合金表面成功制备出厚约20 µm的涂层,此种方法制备的涂层拥有很好的生物相容性,并能降低镁合金的降解速度,但该方法制备的涂层呈现出火山口状的微孔,加大了外界与镁金属接触面积,不利于保护基体镁合金。同样,电镜下镁金属支架基体呈现完整一体性,与本课题组前期研究的3D 凝胶打印纯镁金属支架微观结构明显不同,未见颗粒状镁金属[9];即使在力学测试实验后,这种支架仅表现出轻微形变和微小裂痕,而未表现出松散的碎末样结构。
良好的生物相容性是检测金属材料向临床转化的首要前提。CCK-8 结果表明,支架浸提液与MC3T3-E1 细胞共培养后,无涂层组表现为轻微毒性,而涂层组未表现出明显的细胞毒性,这种现象可能归因于无涂层支架快速降解过程带来的高镁和高碱环境,抑制细胞生长;相反,Ca-P 生物活性涂层保护下的镁金属降解速率显著降低,适宜浓度镁和微环境有利于细胞生长。相较于本组前期3D 凝胶打印纯镁金属支架[9],并未表现出显著差异,同样符合国家标准。细胞活死染色结果显示,随着培养时间延长,经染色后,死细胞数量少,活细胞数量随时间呈现增加的趋势,与本实验室前期研究的3D 凝胶打印纯镁金属支架类似。扫描电镜下,支架表面细胞黏附结果表明,MC3T3-E1 细胞在支架表面附着,细胞形态呈现扁平、舒展、片状、丝状多种形态充分与支架表面接触,细胞在支架表面大量增殖。以上结果显示,我们制备的这种支架具有良好的生物相容性。
综上所述,我们通过选择性激光熔化工艺结合化学转化法成功制备出Ca-P 涂层多孔镁金属支架,并研究其力学性能和生物相容性,发现该材料能够为负重部位骨松质骨缺损区提供足够的力学支撑,且拥有良好的生物相容性,为骨松质缺损修复镁材料的深入研究奠定基础。
致谢感谢佳木斯大学附属第一医院骨科、解放军总医院骨科研究所、上海交通大学材料研究院所有工作人员的技术指导和帮助。
作者贡献叶健廷:细胞培养,实验指标检测,实验数据分析处理,论文撰写;缪铂尊:材料制备,实验数据分析处理,论文撰写;熊英杰、孟昊业、单验博、孙小涵、卢雨征:细胞培养,数据收集,实验数据分析;武艳斌、林万程、关聪聪、刘修志、王鑫、许文静:实验仪器操作,实验数据分析;袁广银:材料设计,实验设计,文章校对;彭江:实验设计,文章校对;周成福:实验设计,文章校对。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:yejianting12@126.com。

