2 型糖尿病对大鼠颌骨骨髓间充质干细胞生物学特性的影响及其机制研究
李天琪,孟祥博,霍 娜,蔡 川,李帅臣,周孙欣,张 彤
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心口腔科,北京 100853
目前全世界约4.6 亿人患糖尿病,其中90%以上是以胰岛素抵抗和胰岛功能障碍为主要发病机制的2 型糖尿病(type 2 diabetes mellitus,T2DM)[1]。研究显示2 型糖尿病患者颌骨骨质更疏松,骨小梁间隙更大[2]。颌骨骨髓间充质干细胞(jaw bone marrow mesenchymal stem cells,JBMMSCs)是源于颌骨骨髓的一类具有高度自我更新和多向分化潜能的成体干细胞,具有成骨、成脂、成软骨等多向分化能力,是骨组织修复与再生的基础[3]。但2 型糖尿病对JBMMSCs 成骨分化能力的影响及其机制尚不清楚。本课题拟探讨2 型糖尿病状态下颌骨组织来源骨髓间充质干细胞的生物学变化及成骨分化中Wnt 信号通路相关分子的变化规律,为进一步研究通过调控Wnt 信号通路恢复2 型糖尿病环境下JBMMSCs 成骨能力提供基础。
材料与方法
1 实验动物 10 只12 周龄SPF 级雄性Wistar 大鼠购于北京维通利华实验动物技术有限公司[动物生产许可证号:SCXK(京)2016-0006];10 只12 周龄SPF 级雄性GK 大鼠购于常州卡文斯实验动物有限公司[动物生产许可证号:(SCXK(苏)2021-0013]。本课题已通过解放军总医院实验动物伦理委员会审查(批准号:2022-X18-20)。
2 材料、试剂与仪器 血糖仪(罗氏-活力型);45%高脂饲料(无锡帆泊生物技术有限公司,中国);α-MEM 培养基(Gibco,美国);胎牛血清(BI,以色列);1%青霉素-链霉素、0.25%胰蛋白酶-EDTA、PBS(中科迈晨,中国);Ⅱ型胶原酶(Sigma,美国);成骨诱导试剂盒(赛业,中国);成脂诱导试剂盒(Gibco,美国);CCK-8 试剂盒(东仁,日本);Annexin V-PE/7-AAD 凋亡检测试剂盒(Sino Biological,中国);RNA 提取试剂盒(天根生化科技,中国);BCA 蛋白定量试剂盒(Thermo Fisher,美国);逆转录试剂盒(Takara,日本);4%多聚甲醛、油红O 染色试剂盒、0.2%茜素红染色液(索莱宝,中国);BCIP/NBT 碱性磷酸酯酶显色试剂盒、结晶紫染色液(碧云天,中国);细胞培养箱(Thermo,美国);流式细胞仪(BD Celesta,美国);酶标仪、实时荧光定量PCR仪(Bio-Rad,美国)。
3 2 型糖尿病大鼠模型的构建 GK 大鼠是目前常用的非肥胖自发性2 型糖尿病模型,其高血糖是由胰岛素分泌受损和胰岛素抵抗引起的,与人类2 型糖尿病进展极为相似[4]。GK 大鼠以45%高脂饲料喂养,12 ~ 13 周龄时每周固定时间测量血糖和体质量,以GK 大鼠连续两次随机血糖≥16.7 mmol/L 作为建模成功的标准[5]。相同周龄的Wistar 大鼠作为对照,以普通饲料喂养,每周相同时间测量血糖和体质量。本实验选取10 只造模成功的GK 大鼠作为2 型糖尿病组,10 只Wistar 大鼠为对照组。
4 JBMMSCs 的分离与培养 选取建模成功的10 只13 周龄GK 大鼠及10 只13 周龄Wistar 大鼠腹腔注射2%戊巴比妥钠麻醉(2 mL/kg),颈椎脱臼处死,75%乙醇浸泡30 min 后转移至超净台。无菌条件下解剖下颌骨,去除下颌骨上附着的皮肤、肌肉、全部牙齿;使用咬骨钳去除两端后暴露骨髓腔,用含有10% FBS、1%青霉素-链霉素的α-MEM 完全培养基反复冲洗骨髓腔,收集颌骨骨髓冲洗液至15 mL 离心管中,800 r/min 离心3 min,去上清,1 mL 完全培养基重悬。将细胞悬液转移至含有9 mL 完全培养基的10 cm 皿中,放置于37℃、5% CO2细胞培养箱中培养。冲洗后的下颌骨用咬骨钳分割成1 ~ 3 mm3骨片并将其转移至15 mL 离心管中,加入 0.1% Ⅱ型胶原酶3 mL,置于200 r/min 摇床上;37℃ 、200 r/min 条件下消化 90 min;800 r/min 离心3 min,去上清,3 mL完全培养基重悬,将骨片转移至含有颌骨骨髓冲洗液的培养皿中,放置于37℃、5% CO2细胞培养箱培养。接种72 h 后半换液,以后每2 d 换液1 次。倒置相差显微镜下观察颌骨骨髓间充质干细胞形态及生长特点,细胞汇合度达到80% ~ 90%时按1∶2 的比例传代,第2 次传代时去除骨片,取第3 ~ 5 代细胞进行实验。
5 CCK-8 检测细胞增殖能力 取生长状态良好的各组第3 代JBMMSCs,以2000/孔接种到96 孔板中,连续培养8 d,每3 d 换液1 次;于接种后1 ~8 d 每天检测细胞的增殖活力,吸弃原有培养基,每孔加入90 µL 的完全培养基和10 µL 的CCK-8试剂,37℃培养4 h,酶标仪检测450 nm 处的OD 值并绘制细胞增殖曲线。
6 JBMMSCs 克隆形成率检测 取生长状态良好的各组第3 代JBMMSCs,以1 000/皿接种到直径为10 cm 的培养皿中,在37℃、5% CO2的细胞培养箱中培养,每3 d 换液1 次,连续培养15 d 后进行结晶紫染色。PBS 清洗3 遍,甲醇固定5 min,结晶紫染色5 min,PBS 清洗多次至无多余染液,室温下晾干并拍照观察。
7 细胞凋亡检测 收集各组第3 代JBMMSCs,用4℃预冷的PBS 洗细胞2 次,离心后去上清用Binding Buffer 重悬细胞至5 × 106/mL,将细胞悬液转移至流式管中,每管100 µL。Wistar 组和GK 组每组4 管:一管为阴性对照组,一管加入5 µL Annexin V-PE,一管加入5 µL 7-AAD,一管加入5 µL Annexin V-PE 和5 µL 7-AAD;轻轻混匀,室温避光孵育15 min 后加入400 µL Binding Buffer 终止反应,上机检测。在细胞凋亡早期,磷脂酰丝氨酸暴露于细胞表面,但细胞膜不具有通透性,因此Annexin V 可以与细胞结合,但细胞拒染7-AAD,因此早期凋亡细胞为Annexin V 阳性、7-AAD 阴性。在凋亡晚期,7-AAD 可以通过细胞膜进入细胞与DNA 结合,同时Annexin V 进入细胞与磷脂酰丝氨酸结合,因此凋亡晚期的细胞表现为Annexin V 和7-AAD 双阳性。
8 成骨诱导、碱性磷酸酶(alkaline phosphatase,ALP)及茜素红染色 取生长状态良好的各组第3 代JBMMSCs 以1 × 105/孔接种于六孔板中,细胞汇合度达70%时更换为成骨诱导液,每3 ~ 4 d换液。成骨诱导培养7 d 后按照BCIP/NBT 碱性磷酸酯酶显色试剂盒的说明书进行ALP 染色实验。成骨诱导分化21 d 时进行茜素红染色实验,吸去六孔板中的液体,PBS 清洗3 次,4%多聚甲醛溶液室温固定30 min 后吸去固定液,PBS 清洗3 次,每孔加入2 mL 茜素红工作液,室温染色5 min,吸去多余染色液,PBS 清洗多次至无多余染液,显微镜下观察钙结节数量。
9 成脂诱导及油红O 染色 将各组第3 代JBMMSCs 以1 × 105/孔接种于六孔板中,细胞汇合度达70%时更换为成脂诱导液,每3 ~ 4 d 换液。成脂诱导14 d 时按照油红O 染色试剂盒说明书的步骤进行油红O 染色,并在显微镜下观察脂滴数量。
10 qRT-PCR 检测成骨、成脂及Wnt 信号通路相关基因的mRNA 表达 将各组第3 代JBMMSCs以1 × 105/孔接种于六孔板,细胞汇合至70%时更换为成骨或成脂诱导液,每3 ~ 4 d 换液1 次,连续培养7 d 后使用RNA 提取试剂盒提取总RNA,使用酶标仪测定RNA 浓度,以500 ng RNA 为模板,按照逆转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,TaKaRa)的说明书合成cDNA。采用SYBR Green 荧光定量PCR 检测试剂盒检测成骨相关基因ALP、骨钙素(osteocalcin,OCN)、Runt 相关转录因子2(runt-related transcription factor-2,Runx2)、成脂相关基因脂蛋白脂酶(lipoprotein lipase,LPL)、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptorγ,PPARγ)及Wnt 信号通路相关基因的mRNA 表达水平;相关引物均由上海生工合成,引物序列见表1。

表1 相关基因引物序列Tab. 1 Primer sequences of related genes
11 统计学分析 使用Graphpad Prism 9.0 软件进行分析,计量资料以±表示,各组采用正态性检验,两组间样本均数比较采用t检验。多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
结 果
1 2 型糖尿病大鼠模型构建情况 2 型糖尿病组大鼠随机血糖为(24.63 ± 5.123) mmol/L,对照组随机血糖为(9.220 ± 0.957) mmol/L (P<0.001),2 型糖尿病组体质量为(360.5 ± 18.65) g,对照组体质量为(598.4 ± 35.88) g (P<0.001)。2 型糖尿病组大鼠随机血糖>16.7 mmol/L,体质量显著低于对照组,毛色发黄,毛发脏乱,并存在多饮多食多尿的表现,符合2 型糖尿病的特征(图1)。
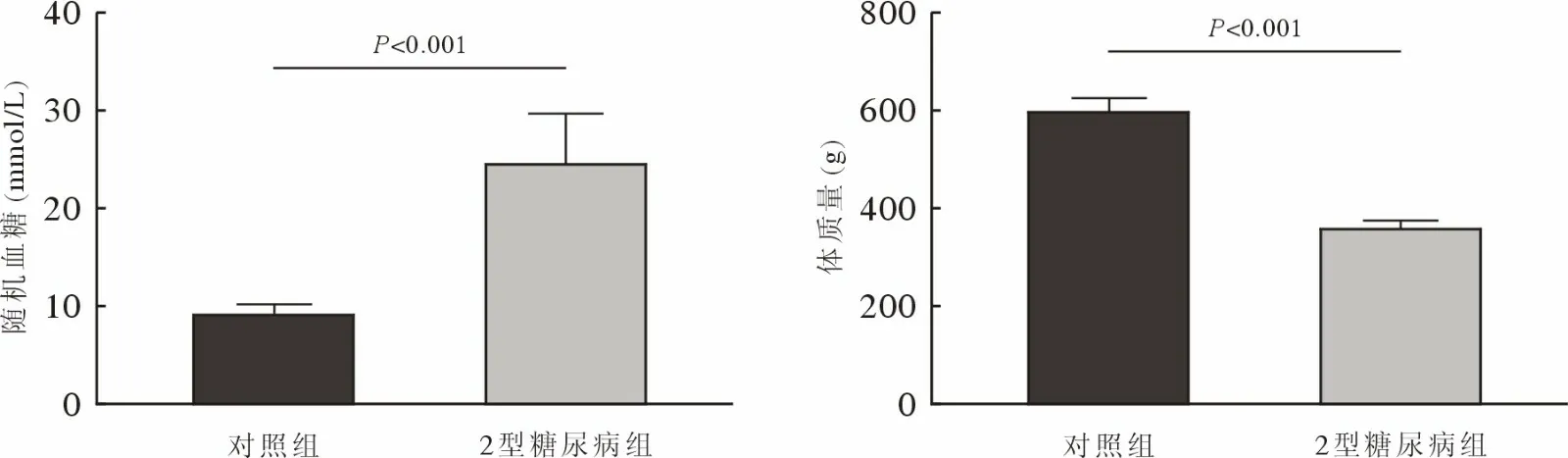
图1 对照组和2 型糖尿病组随机血糖和体质量Fig.1 Randomized blood glucose and weight in control and T2DM groups
2 大鼠JBMMSCs 细胞形态 对照组和2 型糖尿病组JBMMSCs 分离培养3 d 后,镜下可见少量贴壁生长的长梭形或三角形细胞,以及大量圆形、较亮的血细胞;随着换液次数的增加,血细胞数量逐渐减少,JBMMSCs 不断分裂增殖,数量增加,7 d 左右汇合度可达80%,按1∶2 的比例进行传代,细胞纯化后增殖速度变快,3 d 后汇合度可达80% ~ 90%。显微镜下观察可见对照组和2 型糖尿病组第1 代JBMMSCs 均呈长梭形,细胞形态无显著差异(图2)。
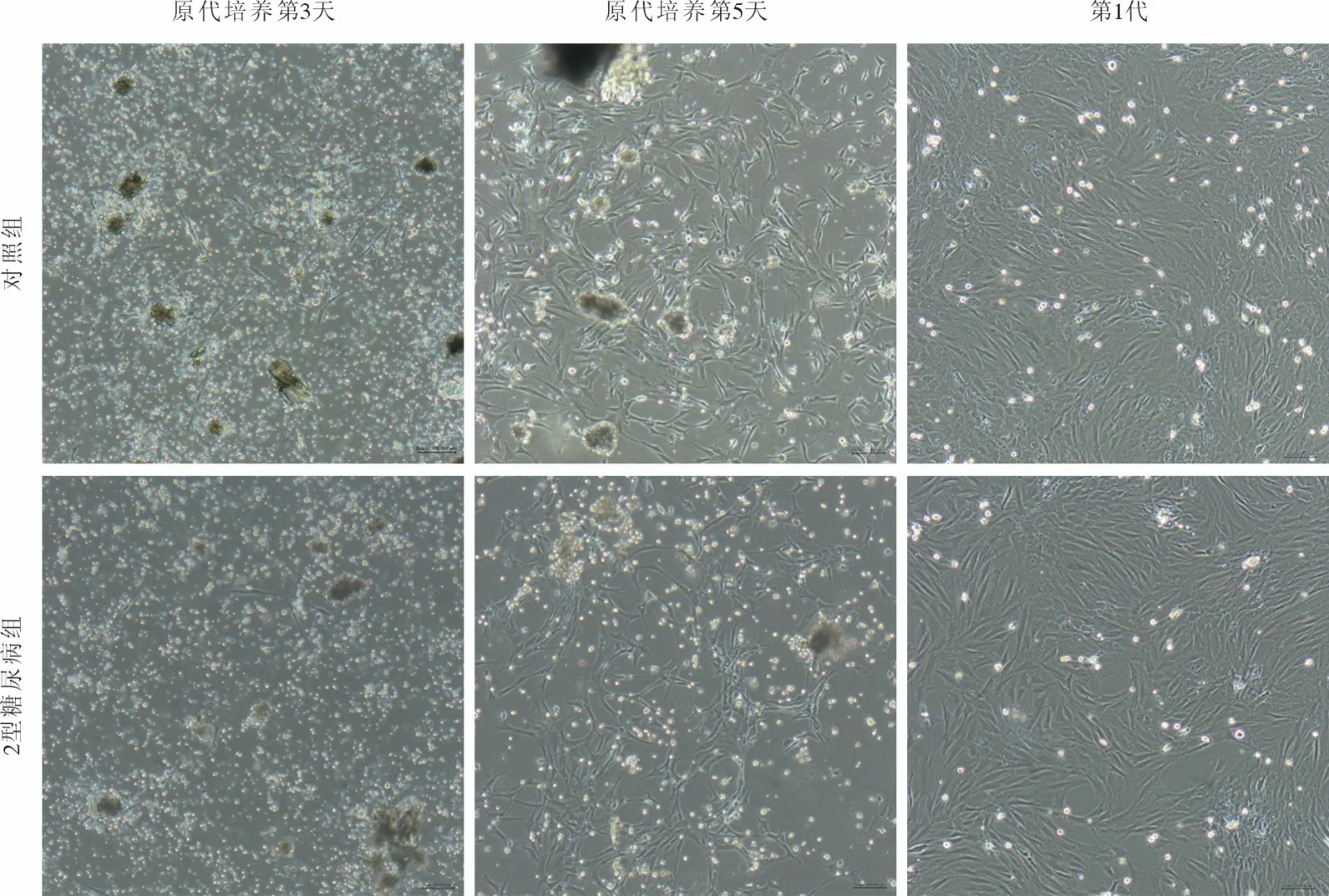
图2 对照组和2 型糖尿病组JBMMSCs 镜下形态观察A:原代培养第3 天;B:原代培养第5 天;C:第1 代(标尺=100 µm)Fig.2 Morphological observation of JBMMSCs in control and T2DM groups (bar=100 µm)A: P0 passage on day3; B:P0 passage on day5; C: P1 passage
3 两组JBMMSCs 活力及克隆能力比较 CCK-8法检测对照组和2 型糖尿病组JBMMSCs 连续培养1 ~ 8 d 的增殖数量变化,两组JBMMSCs 均呈现出稳定的体外扩增能力,细胞生长曲线均类似“S”形,但2 型糖尿病组细胞生长较对照组平缓。第1、2 天两组细胞的增殖能力无显著差异,2 d后两组细胞均进入快速生长期,但对照组细胞增殖速度更快,450 nm 处的OD 值明显大于2 型糖尿病组;6 d 后两组细胞的生长速度明显放缓,但对照组的细胞数量仍多于2 型糖尿病组(图3A)。两组JBMMSCs 以较低密度接种至直径10 cm 的培养皿中,常规培养15 d 后镜下可见克隆形成,散在分布。0.2%结晶紫溶液染色后,克隆呈蓝色,对照组的克隆数显著多于2 型糖尿病组(图3B),说明2 型糖尿病显著抑制JBMMSCs 的克隆形成能力。流式检测结果显示,对照组凋亡早期细胞占比1.37%,凋亡晚期6.73%,2 型糖尿病组凋亡早期细胞占比3.11%,凋亡晚期10.6%(图3C);对照组凋亡细胞比例明显低于2 型糖尿病组。
4 两组大鼠JBMMSCs 成骨及成脂分化能力比较qRT-PCR 显示,成骨诱导7 d 后对照组和2 型糖尿病组JBMMSCs 成骨相关基因ALP、OCN、Runx2 的表达均升高(P<0.05);2 型糖尿病组细胞成骨诱导后成骨相关基因的mRNA 水平低于对照组(P<0.05) (图4A)。成骨诱导7 d 后对ALP 染色实验结果显示2 型糖尿病组蓝紫色染色颗粒分布较稀疏,蓝染面积及密度低于对照组(图4B)。茜素红染色结果显示对照组钙结节颗粒数量及红染面积明显多于2 型糖尿病组(图4C)。成脂诱导7 d 后对照组和2 型糖尿病组JBMMSCs 成脂相关基因LPL 及PPARγ 的表达均升高(P<0.05);2 型糖尿病组细胞成脂诱导后成脂相关基因的mRNA 水平低于对照组(P<0.05) (图5A)。油红O 染色结果显示对照组脂滴数量多于2 型糖尿病组(图5B)。
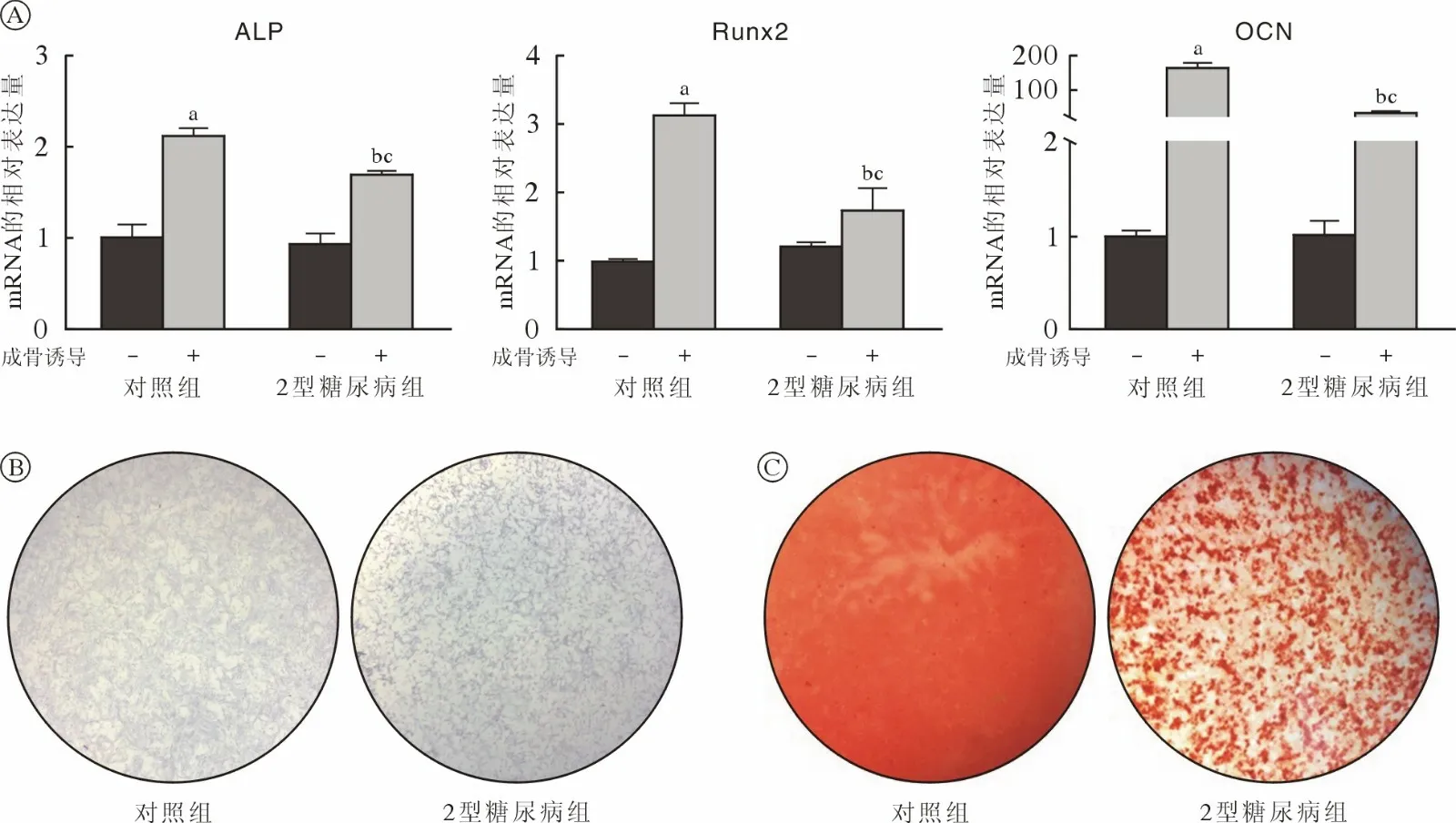
图4 两组JBMMSCs 成骨分化能力比较A:qRT-PCR 检测正常培养和成骨诱导7 d 后对照组和2 型糖尿病组中成骨相关基因的mRNA 表达水平的变化(aP<0.05,vs 对照组-未成骨诱导;bP<0.05,vs 对照组-成骨诱导;cP<0.05,vs 2 型糖尿病组-未成骨诱导);B:ALP 染色;C:茜素红染色Fig.4 Comparison of osteogenic differentiation ability of JBMMSCs between the two groupsA: Changes in mRNA expression levels of osteogenesis-related genes in the control group and the T2DM group after 7 days of normal culture and osteogenesis induction by qRT-PCR (aP<0.05, vs control-NC group; bP<0.05, vs control-OS group; cP<0.05, vs T2DMNC group); B: ALP staining; C: Alizarin red staining
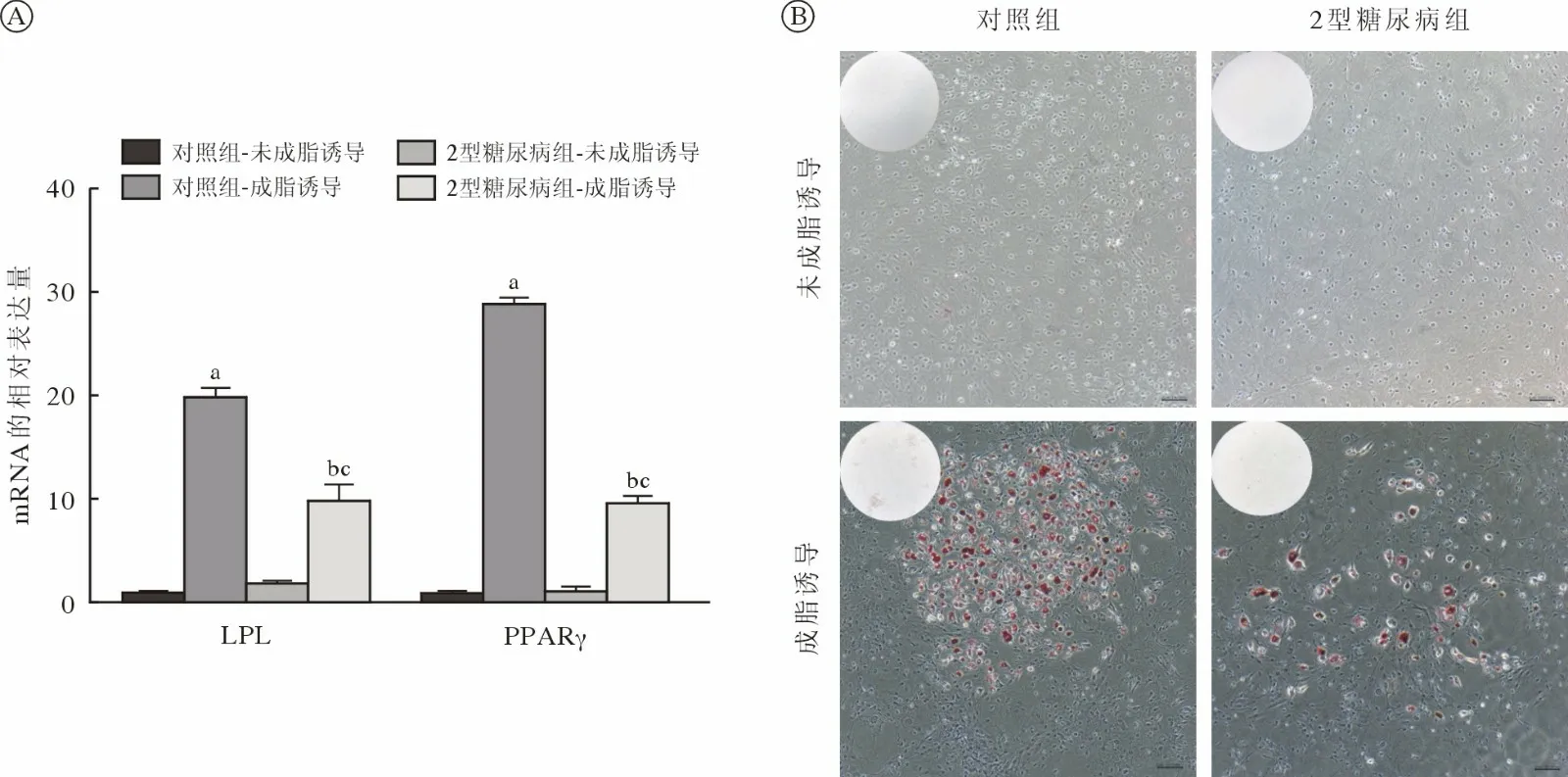
图5 两组JBMMSCs 成脂分化能力比较A:qRT-PCR 检测正常培养和成脂诱导7 d 后对照组和2 型糖尿病组中成骨相关基因的mRNA 表达水平的变化(aP<0.05,vs 对照组-未成脂诱导;bP<0.05,vs 对照组-成脂诱导;cP<0.05,vs 2 型糖尿病组-未成脂诱导);B:油红O 染色(标尺=100 µm)Fig.5 Comparison of adipogenic differentiation ability of JBMMSCs between the two groupsA: Changes in mRNA expression levels of adipogenesis-related genes in the control group and the T2DM group after 7 days of normal culture and adipogenic differentiation induction by qRT-PCR (aP<0.05, vs control-NC group; bP<0.05, vs control-AD group;cP<0.05, vs T2MD-NC group); B: Oil Red O staining (bar=100 µm)
5 2 型糖尿病抑制JBMMSCs 成骨能力的机制研究 成骨诱导7 d 后对照组及2 型糖尿病组Wnt信号通路中的相关分子β-catenin、Wnt4、Wnt5a、Wnt7b 的mRNA 表达水平均显著高于常规培养。然而成骨诱导7 d 后2 型糖尿病组JBMMSCs 成骨诱导后Wnt4、Wnt5a、Wnt7b 的mRNA 表达较对照组增高,β-catenin 的表达较对照组低(图6)。本部分结果提示Wnt 信号通路促进了JBMMSCs 的成骨分化,并且在2 型糖尿病抑制JBMMSCs 成骨分化能力的过程中发挥了作用。然而成骨诱导7 d 后,β-catenin、Wnt4、Wnt5a、Wnt7b 在2 型糖尿病组与对照组中的变化趋势并不相同,提示Wnt 信号通路中不同分子在2 型糖尿病对大鼠JBMMSCs 成骨能力的影响过程中发挥了不同作用。

图6 Wnt 信号通路相关分子mRNA 水平在两组JBMMSCs 成骨诱导过程中的变化(aP<0.05,vs 对照组-未成骨诱导;bP<0.05,vs 对照组-成骨诱导;cP<0.05,vs 2 型糖尿病组-未成骨诱导)Fig.6 Changes in mRNA levels of Wnt signaling pathway-related molecules during osteogenesis induction (aP<0.05, vs control-NC group; bP<0.05, vs control-OS group; cP<0.05, vs T2DMNC group)
讨 论
糖尿病既可以促进牙周病发展,又可以影响种植牙的骨结合、引发种植体周围炎;糖尿病患者种植体周围骨吸收量增加,术后稳定性差[6-7]。有学者通过体外构建高糖微环境来模拟2 型糖尿病,将大鼠JBMMSCs 在高糖培养基中诱导成骨培养7 d 后,细胞中ALP 和Runx2 蛋白的表达较低糖培养基低[8]。但体外的高糖环境无法完全模拟2 型糖尿病患者颌骨中的环境。因此,本实验选取与人类2 型糖尿病发生发展过程相似的GK大鼠作为2 型糖尿病组,选取相同周龄的Wistar大鼠作为对照[9]。
颌骨骨髓间充质干细胞是一种具有较强增殖能力和多向分化潜能的成体干细胞,病理因素、理化因素及生物因素均可影响其生物学特性[10]。本实验成功分离培养了来源于大鼠的JBMMSCs,并对其增殖、分化等生物学性能进行了分析与比较。体外培养条件下对照组与2 型糖尿病组JBMMSCs 贴壁生长,并呈长梭形的成纤维细胞样形态,无显著差异。CCK-8 法检测细胞的增殖能力,与对照组相比,2 型糖尿病组JBMMSCs 的细胞增殖较缓慢,克隆形成能力较低。流式细胞术检测结果显示,2 型糖尿病促进细胞的凋亡,处于凋亡期的细胞比例高于对照组。同时,2 型糖尿病可抑制细胞的成骨与成脂分化能力。JBMMSCs 成骨诱导及成脂诱导7 d 后2 型糖尿病组成骨、成脂相关基因的mRNA 表达均低于对照组,ALP 染色结节的数量也显著降低,产生的脂滴数量也显著少于对照组。研究表明,与正常来源JBMMSCs 相比,糖尿病来源的JBMMSCs 增殖及成骨分化能力显著减弱,这与本实验的研究结果一致[11]。
目前关于2 型糖尿病对颌骨骨髓间充质干细胞成骨分化影响机制的研究较少。2 型糖尿病猪拔牙后牙槽窝的生长分化因子11(growth differentiation factor 11,GDF11)的mRNA 和蛋白表达水平显著高于对照组,降低GDF11 的表达可提高2 型糖尿病来源的JBMMSCs 成骨能力,促进2 型糖尿病条件下拔牙窝的愈合[12]。种植失败糖尿病患者牙槽骨骨髓间充质干细胞的黏附、迁移和成骨分化能力显著低于种植成功糖尿病患者和正常患者,整合素亚单位α10(ITGA10)的表达也低于种植成功糖尿病患者和正常患者;ITGA10 基因敲除可显著降低JBMMSCs 的黏附和迁移能力,并通过干扰FAK/PI3K/AKT/GSK3β/β-catenin 通路抑制其成骨分化潜能[13]。陆玖青等[11]研究发现2 型糖尿病大鼠来源的JBMMSCs 中NF-κB p65 核蛋白的mRNA 及蛋白表达增加,并推测NF-κB 可能参与2 型糖尿病抑制JBMMSCs 成骨分化能力的过程。抑制miR-203-3p 的表达可上调BMP/Smad 信号通路,促进体外高糖环境下JBMMSCs 的成骨分化[8]。糖尿病组JBMMSCs 的胰岛素样生长因子结合蛋白2 的mRNA 表达和蛋白翻译水平显著高于非糖尿病组[14]。
Wnt 信号通路是调控干细胞增殖和多向分化的关键途径,与骨髓间充质干细胞骨向分化关系密切[15]。根据是否依赖β-catenin 可分为经典通路与非经典通路;非经典Wnt 信号通路主要分为Wnt/Ca2+和Wnt/平面细胞极性信号通路[16]。目前的研究表明糖尿病性骨质疏松症与Wnt/β-catenin信号通路关系密切,2 型糖尿病患者血清中骨转换标志物及β-catenin 含量显著低于对照组[17]。Gassel等[18]的研究结果显示,患有夏科氏关节病的2 型糖尿病患者下肢骨组织中Wnt3a、Wnt5a 的mRNA表达水平低于正常组。经典Wnt 信号通路激活后,细胞质中的β-catenin 含量升高并向细胞核中迁移,激活靶基因进而引起下游的一系列反应[19]。Wnt4、Wnt5a、Wnt7b 是非经典Wnt 信号通路的启动子,但也可以通过经典Wnt 信号通路发挥作用[20-22]。在本实验中2 型糖尿病组JBMMSCs 成骨诱导后Wnt 信号通路相关分子Wnt4、Wnt5a、Wnt7b 的mRNA 表达水平较对照组升高,β-catenin的mRNA 表达水平较对照组降低,说明2 型糖尿病影响下经典及非经典Wnt 信号通路可能均参与了对颌骨骨髓间充质干细胞成骨分化的调控过程,并且Wnt4、Wnt5a、Wnt7b 可能通过非经典Wnt信号通路发挥作用。但Wnt 信号通路调节网络结构复杂,其调控具体机制还需进一步研究。
综上所述,2 型糖尿病会影响颌骨骨髓间充质干细胞的增殖、克隆及分化能力。2 型糖尿病影响下JBMMSCs 的增殖、克隆、成骨及成脂分化能力均降低,成骨分化过程中Wnt 信号通路相关分子的表达也有所改变。但若要明确2 型糖尿病通过Wnt 信号通路对JBMMSCs 具体调控机制,还需进一步实验研究。
作者贡献李天琪:细胞及分子生物学实验,文章撰写;孟祥博:动物实验;霍娜:课题设计与指导;蔡川:文章修改,文章审阅和校正;李帅臣:文献收集和整理;周孙欣:统计分析;张彤:写作指导,修订,终审论文。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:619028753@qq.com。

