钽涂层对hPDLSCs增殖及成骨分化的影响
葛 潇,于 淼,武 伟,毕秀婷,吴小燕,于 晨,李 倜
钽(Tantalum,Ta)是一种新兴的金属生物材料,其机械性能及生物学性能优于钛和钛合金,在修复骨缺损方面得到广泛应用,有潜力成为钛及钛合金的替代材料[1-3]。钽的密度较大,价格昂贵,因此临床上金属钽多以涂层的形式用于种植体表面改性[4]。等离子喷涂技术因其适用范围广、工艺参数可控、制备流程简单等成为种植体表面涂层制备的常用方法[5]。有研究表明,在喷砂酸蚀(sandblasted,large-grit,acid-etched,SLA)处理的钛种植体表面用等离子喷涂技术制备的钽涂层结合紧密且具有多孔结构,且生物相容性较钛种植体更好[6-7]。细胞在材料表面的表现是获得良好骨整合的关键,决定了骨植入物的长期稳定性和成功率[8-9]。人牙周膜干细胞(human periodontal ligament stem cells, hPDLSCs)是一种具有多向分化能力的成体干细胞,且获取方式简单、微创,其成骨潜能对种植体周围的骨形成具有重要意义。本研究在SLA钛金属表面通过等离子喷涂技术制备钽涂层,并在其表面培养hPDLSCs,以探究钽涂层表面对hPDLSCs增殖和成骨分化的作用,为钽涂层钛种植体的临床应用提供借鉴。
1 材料与方法
1.1 主要材料与设备
纯钛片、钽粉、胎牛血清(Gibco,美国)、DMEM培养基(Gibco,美国)、胰蛋白酶(Gibco,美国)、CCK-8试剂盒(Dojindo,日本)、茜素红染液(Solarbio,中国)、油红O染色试剂盒(Beyotime,中国)、BCA蛋白定量试剂盒(Solarbio,中国)、ALP/AKP测定试剂盒(南京建成,中国)、Trizol试剂(Ambion,美国)、反转录试剂盒、SYBR qPCR Mix试剂盒(艾科瑞生物,中国)、引物(上海生工,中国)、小鼠抗人抗体(biolegend,美国)、扫描电子显微镜(scanning electron microscope,SEM)(TM4000Plus,HITACHI,日本)、体视显微镜及倒置显微镜(Leica,德国)、流式细胞仪(Agilent,美国)、酶标仪(Thermo,美国)、PCR仪(BIO-RAD,美国)。
1.2 实验方法
1.2.1 钛试件的处理、分组及表征 ①将纯钛片用SiC砂纸逐级抛光得到表面光滑的钛试件,命名为P组;②将经过抛光的试件进行喷砂(喷砂粒径400~600 μm,喷砂压力0.4 MPa,喷砂角度45°)、酸蚀(混合酸溶液:49% HCl和19% H2SO4,60 ℃,30 min)处理,命名为SLA组;③用丙酮、无水乙醇、去离子水依次对经SLA处理的试件超声清洗3 min,然后在钛试件表面用PRAXAIR3710等离子喷涂系统制备钽涂层,命名为Ta组,具体喷涂参数如下:喷涂距离110 cm,电流820 A,电压37 V,喷枪移动速度100 mm/s,送粉速度15 g/min,涂层厚度100 μm左右。用SEM观察SLA组、Ta组的试件表面和Ta组的截面,用能谱分析仪(energy dispersive spectrometer, EDS)对其主要成分进行分析。
1.2.2 hPDLSCs的分离培养 实验经潍坊市人民医院伦理委员会批准(审批号KYLL20191114-2),取2021年10月16日—2021年11月27日临床上无龋病、无牙周病的12~18岁患者正畸需拔除的前磨牙,立即置于含有5%青/链霉素的PBS液中,2 h内在超净工作台上完成牙周膜分离操作。用无菌PBS液(含5%青/链霉素)反复冲洗离体牙,无菌刀片刮取牙根中段的牙周膜组织,分成约1 mm×1 mm×1 mm的小块,平铺在25 cm2的培养瓶底,加入含有20%胎牛血清、1%青/链霉素的DMEM培养液4~6 mL。放入培养箱中(37 ℃,5% CO2),瓶底向上培养3~4 h后,翻转培养瓶。显微镜下观察,待有细胞游出后,每3 d更换培养基。当细胞生长至约80%融合时,用胰蛋白酶消化进行传代。将第3代细胞进行冻存,在后续的实验中使用。
1.2.3 hPDLSCs的鉴定 ①流式细胞术检测表面抗原:取1.2.2部分培养的第3代细胞,消化后PBS洗涤3遍,使细胞悬液密度为4×105个/mL,并向每个管加入250 μL细胞悬液,其中1管为空白对照,其余分别添加CD34、CD44、CD45、CD73、CD90、CD105抗体,避光孵育,PBS洗涤3遍,上机检测。②成骨、成脂分化能力检测:取第3代hPDLSCs,以每孔1.5×105个的密度接种于6孔板中,待细胞贴壁后,更换成骨诱导培养基(含抗坏血酸0.05 mmol/L、β-甘油磷酸钠10 mmol/L、地塞米松1×10-7mol/L)培养21 d后弃去培养液,PBS冲洗,多聚甲醛固定,用茜素红染色液染色。用成脂诱导培养基(含3-异丁基-1-甲基嘌呤0.5 mmol/L、吲哚美辛0.2 mmol/L、胰岛素10 mg/L、地塞米松1 μmol/L)培养14 d后弃去培养液,PBS冲洗,多聚甲醛固定,用油红O染色液染色。
1.2.4 CCK-8法测定hPDLSCs增殖情况 将第4~5代hPDLSCs以2×104个/孔的密度接种于放置有3组试件的24孔板,每组设3个复孔(n=3),隔天换液,培养1、3、5、7 d后,吸弃培养基,每孔加入600 μL培养基和60 μL CCK-8试剂,在37 ℃培养箱里孵育2 h,每孔吸取100 μL置于96孔板中,用酶标仪测定450 nm波长下的OD值。
1.2.5 ALP活性检测 将hPDLSCs以2×104个/孔的密度接种于孔底置有各组试件(n=3)的24孔板中,待细胞贴壁后,弃去原培养液,更换为成骨诱导培养基,每2 d换液1次,诱导7、14 d。吸弃培养基,PBS清洗3次,每孔加入100 μL RIPA裂解液,裂解30 min,BCA法测定蛋白浓度。按照ALP测定试剂盒要求,在520 nm波长处用酶标仪测定各孔吸光度值,计算ALP活性。
1.2.6 茜素红染色 将hPDLSCs接种于置有各组试件(n=3)的24孔板中,细胞密度为2×104个/孔,待细胞贴壁后,弃去原培养液,更换为成骨诱导液,培养21 d后进行茜素红染色,用体视显微镜拍照记录。
1.2.7 实时荧光定量PCR(qPCR) 细胞接种于各组试件(n=3)行成骨诱导培养14 d后,用Trizol试剂裂解细胞,提取总RNA。RNA浓度通过核酸定量仪测定,按照cDNA反转录试剂盒、SYBR Premix Ex TaqTMⅡ试剂盒说明书进行反转录、实时荧光定量PCR(qPCR)反应,引物序列如表1所示。qPCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,运行40个循环,以GAPDH作为内参,根据2-ΔΔCt法对成骨标志基因ALP、RUNX2、OCN进行基因相对表达倍数转化。引物序列见表1。
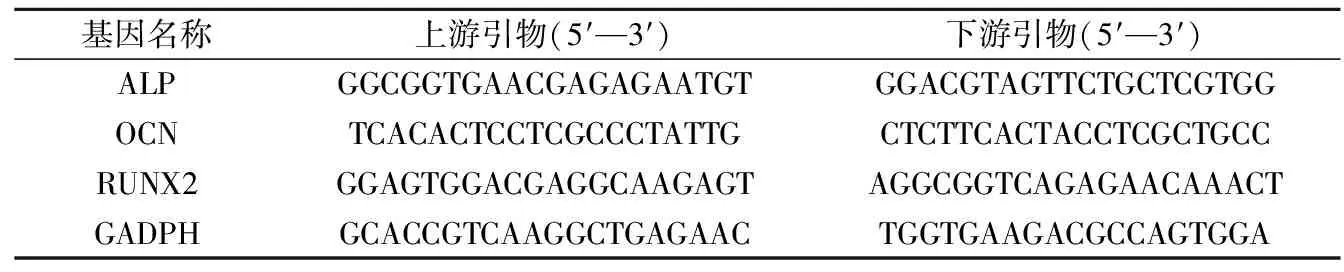
表1 qPCR引物序列
1.3 统计学方法
2 结 果
2.1 钛试件表面观察及成分分析
大体观覆盖钽涂层的试件如图1所示,呈黑灰色,表面较为粗糙。扫描电镜下观察,Ta组试件与SLA组试件的表面形貌如图2所示。SLA组表面可见酸蚀、喷砂后形成的大小不一的坑槽样结构;Ta组表面可见扁平状的钽颗粒相互连接,其间夹杂部分类球形微粒,形成尺寸不一的不规则气孔,组成具有微纳米结构的涂层表面。Ta组试件截面图像显示钽涂层与SLA钛表面结合紧密,且涂层在垂直方向上可见层层堆积的钽颗粒形成的孔隙(图3)。EDS分析图谱表明涂层的主要元素成分是钽(图4),证明了在钛试件上成功制备了钽涂层。

图1 Ta涂层试件外观

A:SLA组表面低倍镜( ×200);B:Ta组表面低倍镜( ×200);C:SLA组表面高倍镜( ×1 500);D:Ta组表面高倍镜( ×1 500);SLA组表面可见酸蚀、喷砂后形成的大小不一的坑槽样结构;Ta组表面可见扁平状的钽颗粒相互连接,其间夹杂部分类球形微粒,形成尺寸不一的不规则气孔,组成具有微纳米结构的涂层表面

图3 Ta组试件截面SEM图像( ×2 000)
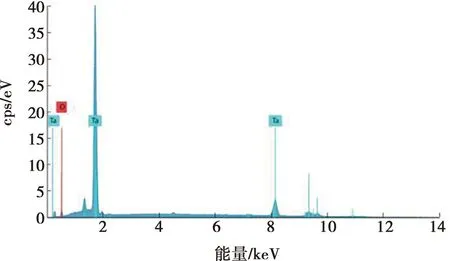
图4 Ta组试件表面元素EDS分析图谱
2.2 hPDLSCs的培养和鉴定结果
原代hPDLSCs的分离、培养采用组织块法,在培养5~7 d时可观察到细胞从组织块周围贴壁爬出,倒置显微镜下观察细胞呈星形或梭形,如图5A所示。当细胞生长至80%融合时可进行消化、传代,传代后的细胞生长状态良好,显微镜下观察呈漩涡状排列,如图5B所示。
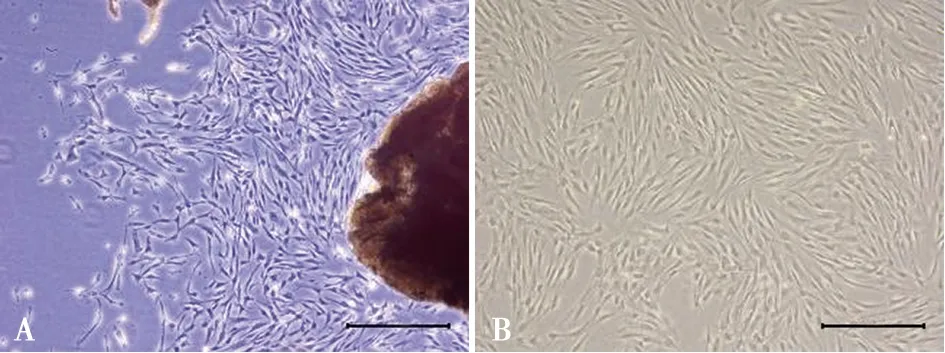
A:原代hPDLSCs( ×40);B:第3代hPDLSCs( ×40);标尺大小:500 μm
流式细胞仪检测结果见图6,细胞高表达间充质干细胞标志物CD44、CD90、CD105、CD73,对造血干细胞标志物CD34、CD45几乎不表达,证实培养的细胞为间充质来源。

图6 流式细胞仪检测hPDLSCs表面相关抗原
成骨诱导21 d,茜素红染色后可观察到大量矿化结节形成(图7A),表明细胞具有成骨分化的能力。成脂诱导培养14 d,油红O染色后可观察到红色油滴(图7B),证实其具有成脂分化的能力。
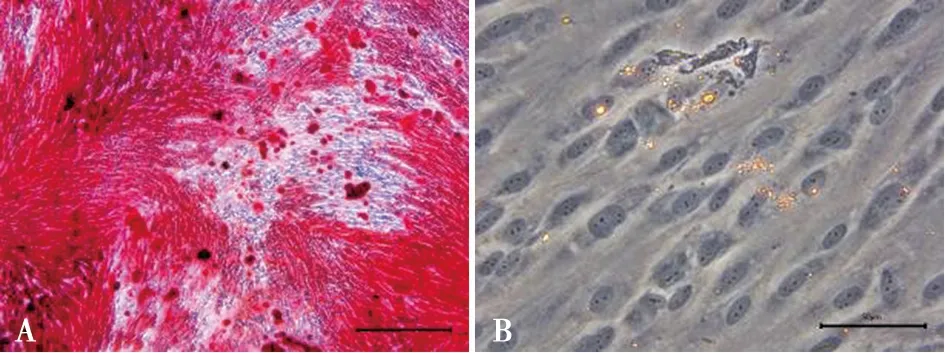
A:hPDLSCs成骨分化( ×100),标尺:200 μm;B:hPDLSCs成脂分化( ×400),标尺:50 μm
2.3 钽涂层对hPDLSCs增殖能力的影响
通过CCK-8法检测各组试件表面hPDLSCs增殖情况,结果见表2、图8。在1 d时,三组细胞的OD值差异无统计学意义,在培养3、5、7 d后,Ta组OD值明显高于SLA组及P组(P<0.05);在培养5、7 d后,SLA组OD值明显高于P组(P<0.05)。
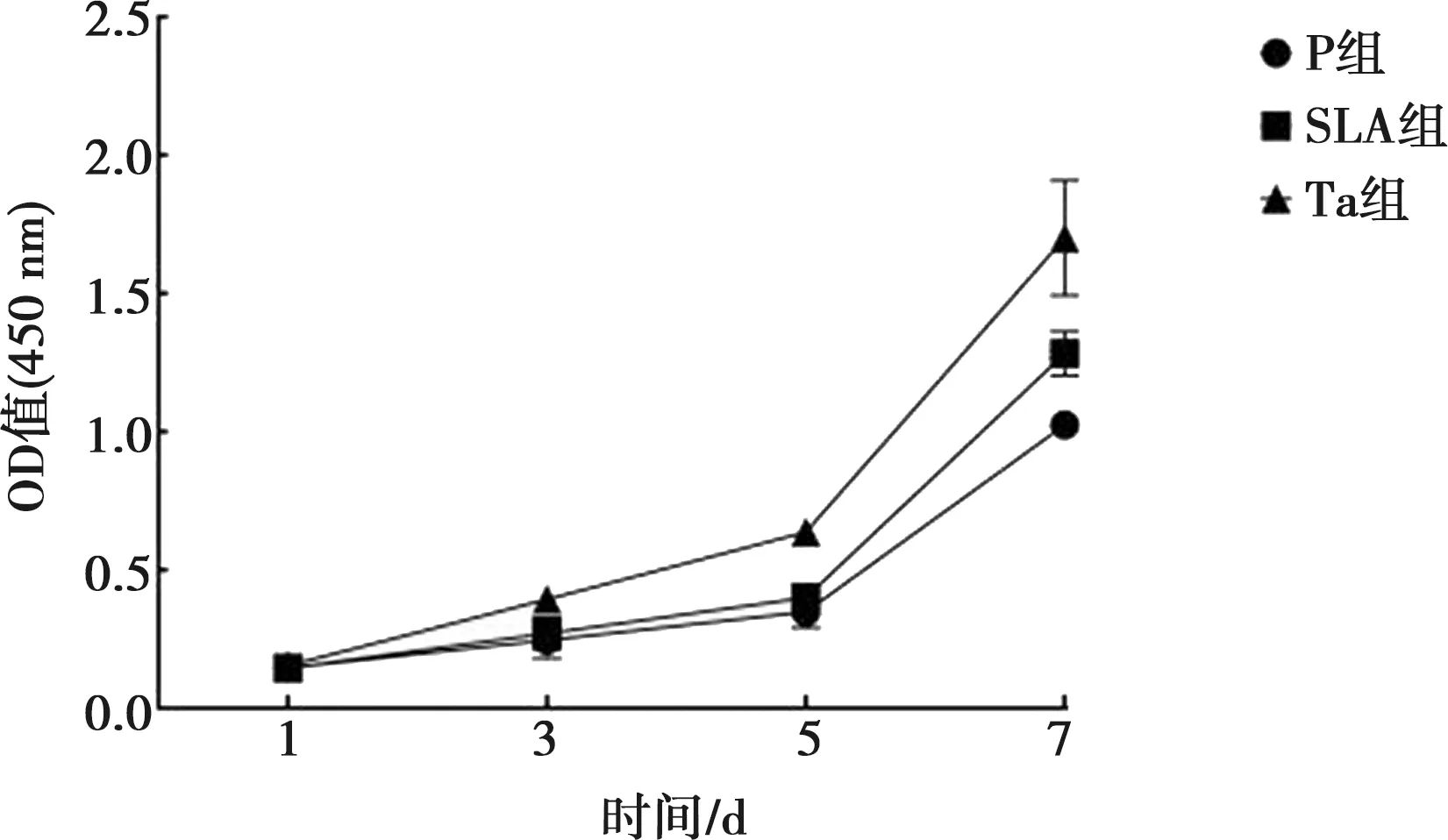
图8 CCK-8检测hPDLSCs增殖情况

表2 CCK-8检测hPDLSCs增殖情况
2.4 ALP活性检测结果
ALP活性检测结果如表3所示,细胞的ALP活性呈现升高的趋势。在第7天时,三组间的差距无统计学意义;第14天时,Ta组ALP活性明显高于P组和SLA组,具有显著差异(P<0.01),而P组和SLA组之间差异无统计学意义。

表3 碱性磷酸酶活性检测
2.5 茜素红染色结果
细胞与3组试件共培养21 d后的茜素红染色结果见图9,三组材料表面都有红色钙化结节形成,SLA组和Ta组的红染区域明显多于P组,Ta组矿化结节相对于SLA组更为密集。
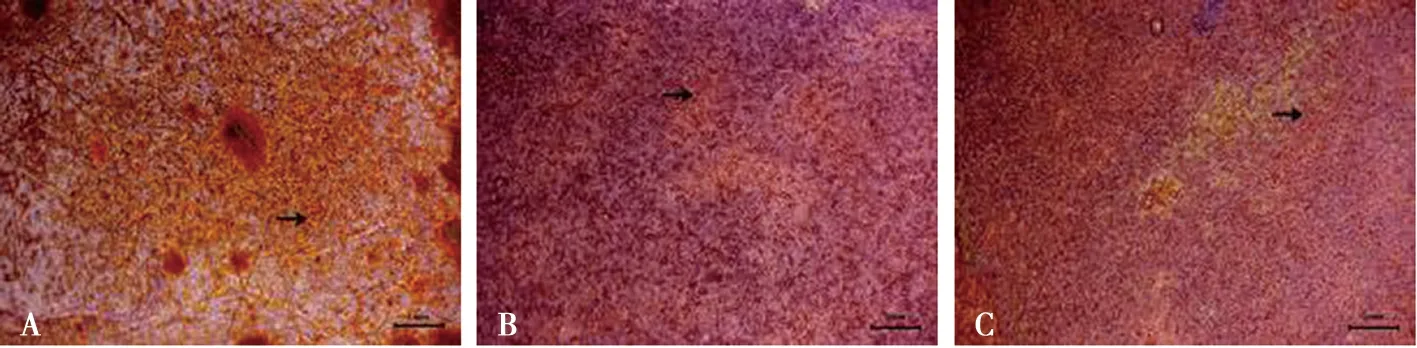
A:P组试件;B:SLA组试件;C:Ta组试件;标尺:1 mm
2.6 成骨相关基因表达结果
成骨诱导培养14 d时,qPCR检测结果如表3所示。Ta组和SLA组的ALP基因表达差异无统计学意义,但Ta组高于SLA组,与P组相比差异具有统计学意义(P<0.01)。Ta组RUNX2、OCN基因表达水平高于SLA组和P组(表4),且差异具有统计学意义(P<0.01)。SLA组ALP、RUNX2、OCN的基因表达显著高于P组(P<0.05)。

表4 ALP、RUNX2、OCN mRNA相对表达量
3 讨 论
种植体表面物理和化学性质对早期形成稳定的骨结合具有很大的影响[10],对种植体表面进行改性能够提高其生物活性[11-12]。单纯的SLA处理仅能改变种植体的表面形貌,且以往的回顾性研究发现经SLA处理的钛合金表面金属微粒脱出,可导致细胞毒性且加速种植体的腐蚀[13]。涂层能够改变种植体的表面生物学性能,同时能起到对钛基底的保护作用。在SLA钛表面通过等离子喷涂制备出具有微纳米级表面特征的钽涂层,既改变了表面形貌又改变了化学元素组成。钽具有出色的机械性能、耐腐蚀性和良好的骨诱导性[14],能够提高钛板的生物活性和力学性能[15]。SEM、EDS分析结果表明,具有微纳米结构的钽涂层覆盖在SLA钛表面,且结合紧密。
目前国内外对于骨缺损修复的研究已趋向于将生物材料和细胞联合的骨组织再生工程,干细胞在组织再生方面显示出良好的前景,并被考虑应用于骨缺损的修复。以往的骨再生研究中多应用骨髓间充质干细胞,但其分化能力会随细胞传代迅速减弱,而牙周膜干细胞的增殖、分化能力在传代过程中较为稳定,且取材相对容易。从牙周膜中分离的hPDLSCs可作为颌骨再生的成骨前体细胞的来源[16]。实验通过CCK-8法检测三组样品对PDLSCs的增殖的影响,发现hPDLSCs与三组试件共培养1、3、5、7 d后,Ta组的hPDLSCs的增殖速度较SLA组和P组明显提高,表明钽涂层表面对于细胞的生长增殖具有促进作用。前期已有研究表明钽涂层表面有更高的蛋白质吸附能力,这决定了细胞早期能够在材料表面获得更好的黏附和铺展[17],从而为细胞增殖和分化提供有利条件[18]。此外,结构复杂的种植体表面具有更大的表面积,延长了形成细胞融合的时间,允许细胞在达到接触抑制之前进行更大面积的增殖[19]。从仿生学角度来讲,钽涂层改性的微/纳米结构的表面与天然的骨结构更为相近,合适大小的微窝结构能够使接触的细胞获得与成骨表型接近的长径比[20-21]。且钽涂层表面的Ta2O5具有生物活性,与微/纳米结构具有协同促进细胞黏附增殖的作用[22]。细胞的快速增殖使种植体表面与周围组织的有效接触面积增加,提高了组织-种植体表面相互作用强度,有利于形成良好的骨结合[23]。
成骨诱导性对提高种植成功率具有重要意义,是影响种植体早期稳定的重要因素。碱性磷酸酶在骨矿化早期发挥功能,其水平升高与骨形成率呈正相关。本研究中,ALP活性检测显示在第14天时,各组的ALP活性最高,Ta组明显高于SLA组和P组。这表示钽涂层表面能够促进hPDLSCs的早期成骨分化。过去的研究也表明,钛钽梯度材料相比纯钛材料,能提高成骨细胞的ALP活性[24]。在细胞与材料培养21 d后进行茜素红染色,钽涂层上的分化细胞群比粗糙或光滑钛表面上的细胞产生更多的钙结节,这表明钽涂层表面的骨诱导性增强,这与先前的研究结论一致[25-26]。而qPCR对成骨相关基因的检测结果进一步证实了钽涂层组的促成骨作用。通过对成骨相关基因ALP、RUNX2、OCN表达的检测来比较不同试件对细胞成骨活性的影响,结果显示Ta组对成骨的促进作用最佳。ALP是成骨矿化机制中最重要的功能基因之一,在矿化周期的早期发生,能够启动骨细胞的钙离子沉积[27];OCN是在细胞分化后期分泌的非胶原蛋白,在合成和重建骨组织过程中有着重要作用,能反映矿物质的沉积情况[28];RUNX2是调节干细胞向成骨细胞分化和成熟的主要转录因子,诱导骨基质蛋白基因的表达,在缺乏RUNX2的情况下不会发生成骨[29]。近年来,已发现钽的成骨诱导性与许多经典的成骨信号通路有关[30],这从发生机制上解释了钽能够促进hPDLSCs成骨的原因。
综上所述,SLA钛表面制备的钽涂层能够促进hPDLSCs的增殖和成骨分化,具有良好的生物相容性,等离子喷涂技术能够在传统钛种植体表面制备具有微纳米级结构的钽涂层,为开发新型种植体提供了思路。本实验研究提示,与传统的钛合金种植体材料相比,钽涂层能更好地促进牙周干细胞的增殖和成骨分化,这为后期种植体表面设计的优化提供了生物学指导。但是种植体的长期效果在体内会受到更多因素的影响,因此钽涂层钛种植体的性能还需要进一步的体内实验证实。

