鲤疱疹病毒2 型不同分离株的基因组比较分析
周怡,赵路品,刘笑茹,姜有声,2,3
(1.上海海洋大学,国家水生动物病原库,上海 201306;2.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306;3.上海海洋大学,水产动物遗传育种中心上海市协同创新中心,上海 201306)
1 鲤疱疹病毒2 型
1.1 流行病学
CyHV-2 又称为疱疹病毒性造血器官坏死病毒(Herpesviral haematopoietic necrosis, HVHNV)、金鱼造血器官坏死病毒(Goldfish haematopoietic necrosis virus, GFHNV),与鲤痘疱疹病毒(Carp pox virus,又称鲤疱疹病毒I 型CyHV-1)、锦鲤疱疹病毒(Koi herpesvirus,KHV,又称鲤疱疹病毒III 型,CyHV-3)同属于疱疹病毒目(Herpesvi rales)、异疱疹病毒科(Alloherpesviridae)、鲤疱疹病毒属(Cyprini-virus)[1-2]。CyHV-2 的感染性强,致死率高,鱼体感染病毒出现症状后,24~48 h 即死亡。主要临床症状为体表广泛性充血或出血、鳃丝肿胀;解剖发现,患病鱼的鳃和肝胰脏苍白。CyHV-2 引起异育银鲫鳃出血病,主要发生在春秋两季[3-9]。CyHV-2 的传播方式主要为垂直传播和水平传播[10-11]。
1.2 病原学
CyHV-2 是一种线性双链DNA 病毒,其基因组全长约290 kbp,基因组共编码154 个开放阅读框(Open reading frame, ORF),其中有4 个末端重复序列(Terminal repeat, TR)和2 个无编码功能的碎片基因[12]。CyHV-2 的核衣壳呈六角形或球形,直径为115~117 nm,具有皮质层和囊膜的完整病毒颗粒直径为170~220 nm[2,13]。Gao 等[14]利用蔗糖密度梯度,结合超离心纯化病毒粒子,鉴定了CyHV-2 的结构蛋白,通过SDS-PAGE分离病毒蛋白,并用质谱法进行鉴定,结果显示,CyHV-2 含有74 种蛋白,其中包含3 种衣壳蛋白、18 种膜蛋白和8 种主要免疫原性蛋白。文献[7,15]建立异育银鲫脑细胞系(Brain cell lines of Carassius auratus gibelio, GiCB),研究CyHV-2的理化及生物学特性,发现其对酸碱度和有机溶剂敏感。
1.3 患病金鱼、鲫状态比较
CyHV-2 对金鱼和鲫表现出较高的易感性,对金鱼(父本)和鲤(母本)的杂交个体也表现出易感性,但锦鲤不易被感染,杂交个体对CyHV-2 的敏感性低于金鱼和鲫[16]。发病的金鱼和异育银鲫,其生活的水温存在一定差异[17],金鱼在水温>25 ℃时,存在感染发病情况。Xu 等[6]试验发现,异育银鲫在水温15~32 ℃的池塘中会暴发疾病,并指出该病暴发的最适温度为20~28 ℃。在水温25 ℃时,CyHV-2 对金鱼和鲫的致死率都很高;>25 ℃时,其发病状态则存在一定差异,不同的宿主感染后,呈现出不同的病理变化。鲫和异育银鲫患病后,鳃部明显出血,尾鳍末端发白,体表无寄生虫附着,鲫有少量红色腹水,鳔有点状出血,部分异育银鲫体内有浅黄色腹水,鱼鳔上有明显出血性瘀斑,一些患病死亡的异育银鲫,鳃丝因失血而呈苍白色,在鳃盖两侧各形成一个胭脂红色的淤血斑块[8,18-19]。患病金鱼的鳃苍白,脾和肾脏肿胀并呈苍白色,偶尔能见多处白色病灶,肝苍白,肠道空,鳔上有瘀斑性出血,鳍上有水泡状脓疱,有些患病鱼的腹部膨大,眼球突出[8]。
2 CyHV-2 毒株的基因组比较
通过核苷酸序列数据库(GenBank)数据库查找,鲤疱疹病毒2 型共有7 个分离株进行了全基因组测序(表1、2),按照时间顺序,分别为ST-J1、YC-01、SY-C1、1301、SY、YZ-01 和CNDF-TB2015,它们的基因组大小为275 348~290 455 bp。除了CNDF-TB2015 株是环状DNA,其余毒株都是线状DNA。

表1 分离株来源信息
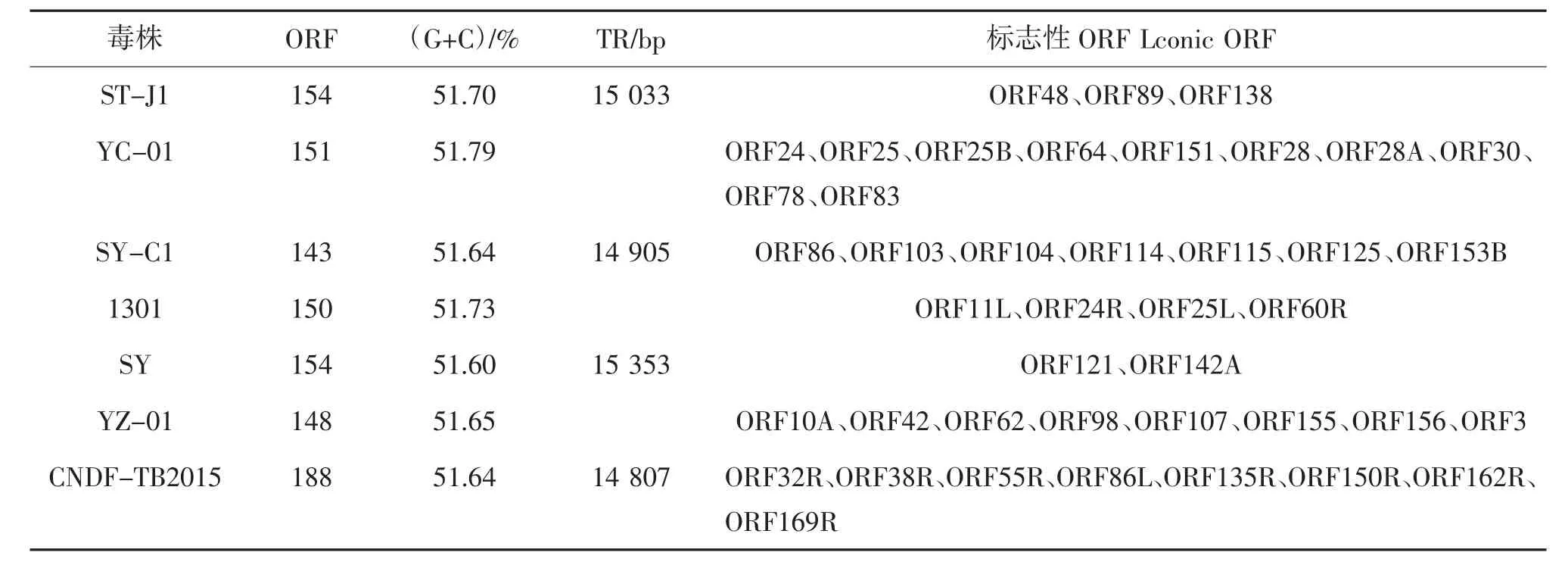
表2 7 株分离株的基因组信息①
李莉娟等[13]研究了从国内患病鲫体内分离的毒株SY-C1 的基因组特征,并与日本株ST-J1 进行了比较基因组学分析,结果表明,2 个毒株序列的同源性为98.8%,在CyHV-2 基因组中唯一区域和末端重复序列的同源性分别为99%和97.6%,说明该2 个毒株的基因组在核苷酸序列水平上高度相似;通过进一步比较发现,SY-C1 的单核苷酸突变、插入、缺失和重排等,与ST-J1 存在明显变异,这2 个毒株的主要差异是SY-C1 基因组在ORF25B 和ORF25C 之间具有一个523 nt 的缺失,这也是2 个毒株基因组最显著的差异。SY-C1 基因组中ORF55编码胸苷激酶(TK)参与核酸代谢,与ST-J1 基因组的不同之处,在于它包含了9 nt 的缺失,此明显差异,也可以用来区别2 个株型。SY-C1 基因组中的3个核心ORF(ORF33、ORF79、ORF107)与ST-J1 基因组中的ORF33、ORF79、ORF107 相同,在其余核心ORF 中两者之间,只有1~3 个氨基酸存在差异[13]。这2 个毒株被分为C 基因型(中国基因型)和J 基因型(日本基因型),国内分离的CyHV-2 毒株更接近C 基因型。
SY 基因组全序列具有154 个ORF 和15 353 bp的TR,总(G+C)含量约为51.6%[20]。生物信息学分析表明,SY 基因组具有10 个ORF 编码膜蛋白,3 个ORF 编码核衣壳蛋白。CaHV(分离株1 301)的片段长度为275 348 bp,包含150 个ORF,(G+C)含量为51.73%,不含TR[21]。CaHV 中的19 个ORF 与SY-C1 中同源物的同源性低于95%,9 个ORF 与ST-J1 中同源物的同源性低于95%。SY、ST-J1 和SY-C13 个毒株之间存在67 个ORF,没有任何变异,这表明CyHV-2 与自身宿主发生了协同进化,宿主的适应性,导致了不同毒株的基因差异。
将ST-J1、SY-C1、SY、CaHV 的序列进行对比,发现ST-J1 和SY-C1 的ORF10 中有2 个富含谷氨酰胺的串联重复序列,而SY 和CaHV 在这串联重复序列之间多了一个含有组氨酸和酪氨酸插入的重复;核心基因ORF107 的串联重复序列DELD 在ST-J1 和SY-C1 中复制2 次,在SY 和CaHV 中复制1 次;PTVTGITQQS 序 列 在ST-J1 和SY-C1 的ORF156 中重复6 次,在SY 中重复3 次。ORF10 和ORF107 可作为SY 和CaHV 的标志,以区别于STJ1 和SY-C1,ORF156 可作为SY 的标志以区别于CaHV。与ST-J1 基因组相比,SY-C1 基因组在ORF25B 和ORF25C 之间存在523 nt 的缺失,在SY和CaHV 基因组中也发现了相同的缺失。ST-J1 基因组串联重复序列在ORF6 和ORF7 之间,有一个87 bp 的DNA 片段,该片段在SY-C1、SY、CaHV 中不存在[20]。此外,ST-J1 在ORF25C 和ORF48 的右侧具有220 bp 的反向重复序列,但在SY-C1、SY 和CaHV 中没有发现该序列。这些发现,表明SY-C1、SY 和CaHV 在进化过程中具有密切关系。
Wang 等[22]运用PhyML 在线构建的系统发育树表明,YZ-01 更接近YC-01,与SY-C1、CNDF-TB2015、1301、YC-01 属于同一组。通过DNAMAN 软件比较YC-01、YZ-01 和CNDF-TB2015 的ORF 发现,除假设蛋白外,三者具有44 个相似的ORF,其中15 个ORF 的相似性达到了100%(例如CNDF-TB2015 的ORF13R、ORF16R、ORF17R 和YC-01、YZ-01 的ORF23、ORF25、ORF25B),17 个ORF 的相似性超过99%。与YC-01 和YZ-01 的ORF80、ORF138 相比,CNDF-TB2015 的ORF86L 和ORF140R 分别具有865 bp(139 829~140 717 个核苷酸)和88 bp(207 246 个核苷酸~207 333 个核苷酸)的片段,这2 个ORF 可作为CNDF-TB2015 的标志以区别于YC-01 和YZ-01。YC-01 的ORF64 和ORF142A 分别有一个39 bp(101 648~101 686 个核苷酸)、42 bp(213 375~213 416 个核苷酸)的片段,该2 个片段在YZ-01 不存在。此外,YZ-01 的ORF25C 比YC-01 的ORF25C,多出一个711 bp 的片段(32 108 ~32 818 个核苷酸)。虽然其余7 个ORF 或多或少存在碱基的缺失、替换,但其相似性也达到了90%。
对Genbank 中7 个CyHV-2 分离株的全基因组分析表明,虽然所有分离株的基因组具有很高的同源性,但是不同的分离株,在其基因组中包含很多突变、插入、缺失和重排。7 个分离株具有134 个相似的ORF,通过DNAMAN 软件进行序列比对发现,24 个ORF 没有发生变化(相似性100%),98 个ORF 比较稳定(相似性≥90%,不包括100%),12 个ORF 突变较多(相似性<90%),见表3 和4。
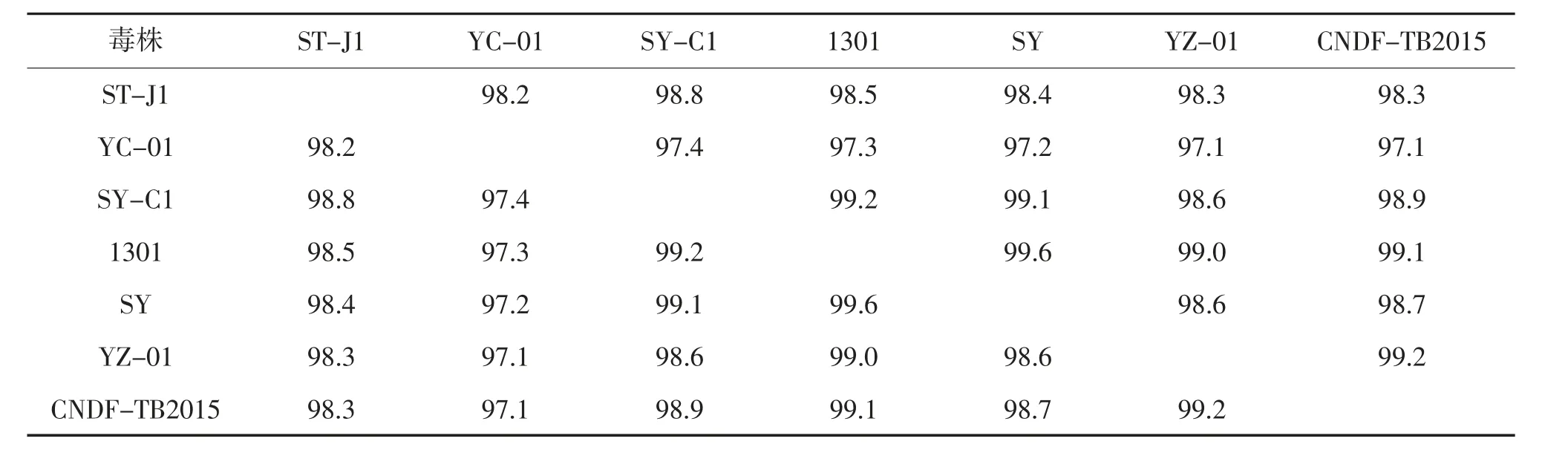
表3 7 株分离株之间的同源性① %
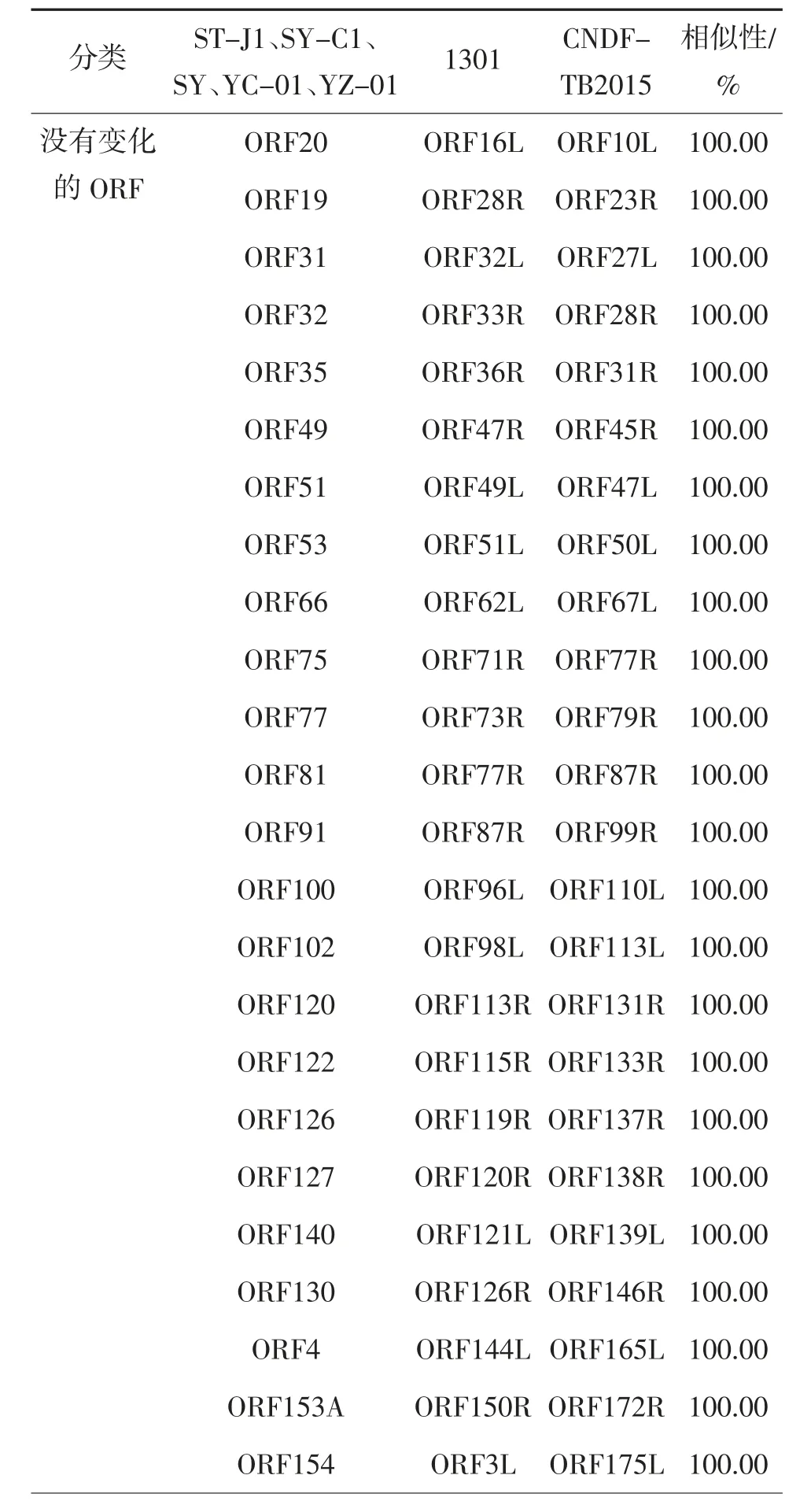
表4 7 株分离株相似ORF 的比较①
3 CyHV-2 基因功能
7 个分离株的基因组具有12 个高度保守的ORF(ORF33、ORF46、ORF47、ORF61、ORF71、ORF72、ORF78、ORF79、ORF80、ORF90、ORF92、ORF107),但YZ-01 株的基因组缺少ORF33。这些蛋白都具有编码功能,如ORF33 编码DNA 包装末端酶亚基1,ORF71 编码DNA 解旋酶亚基,ORF72 编码病毒衣壳三联体亚基2,ORF78 编码衣壳成熟蛋白酶,ORF79 编码DNA 聚合酶亚基等[23]。
CyHV-2 ORFs 中只有少数的功能得到确认,如ORF25、ORF25C 和ORF25D 能够编码膜蛋白[24];ORF104 编码类激酶蛋白,定位于细胞核,与p38 的上游激活子MKK3/MKK6 具有很高的相似性,可以特异性激活p38 MAPK 信号通路,但不能激活JNK 和ERK,而p38 通路的阻断显著提高了感染CyHV-2 银鲫的存活率[25]。金李萍等[26]在异育银鲫脊髓细胞系(Spinal cord tissue cell lines of Carassius auratus gibelio, CSC)中,对CyHV-2 ORF57 进行RNA 干扰,结果显示,干扰ORF57 的表达可大幅度降低CyHV-2 的致细胞病变力和复制率,ORF57 在CyHV-2 复制和致细胞病变中起重要作用。
周勇等[27]比较分析了CyHV-2 部分基因的序列差异,包括ORF25、ORF25B、ORF25D、ORF55 和ORF72,结果表明,ORF25 编码蛋白具有较好的免疫原性。鲁建飞[28]将8 条miRNA mimics 转染至GiCF细胞,发现miR-C12 抑制CyHV-2 诱导的GiCF 细胞凋亡,为进一步探讨miR-C12 的调控机制,将miR-C12 mimics、miR-C12 inhibitor、CASP-siRNA-1 转染细胞,结果表明,miR-C12 mimics 和CASPsiRNA-1 均能促进CyHV-2 复制,miR-C12 inhibitor抑制CyHV-2 复制。Wang 等[29]对5 种RING 蛋白(39L、52L、131R、143R)进行了亚细胞定位、泛素化活性等分析,结果表明,RING 结构域外的序列,决定了亚细胞定位和泛素化活性水平,RING 蛋白可能在病毒和宿主的相互作用中具有不同的功能。文献[30]研究表明,某些DNA 病毒可以编码环状RNA(circRNA)来调节病毒感染,circ-udg 是一种来自Cy-HV-2 尿嘧啶DNA 糖基化酶(udg)基因的circRNA,可以促进CyHV-2 复制。CyHV-2 编码17 个miRNA,其中miR-C12 通过靶向半胱天冬酶8,抑制病毒诱导的细胞凋亡并促进病毒复制[31]。
4 结语
目前,CyHV-2 在世界范围内不断的流行并蔓延,严重危害多个国家的水产养殖业。尽管相关研究人员采取了多种方法,由CyHV-2 引起的疾病仍对水产养殖业造成了巨大的经济损失。随着测序技术的进步,现在已有7 个CyHV-2 毒株的全基因组,虽然这7 个基因组具有很高的同源性,但都有其标志性ORF。未来应以CyHV-2 的基因组序列为基础,加强对CyHV-2 的基因功能以及宿主对Cy HV-2 的免疫反应等基础研究,同时加强国际交流合作,以研究出更具体、更有效的预防、控制和治疗方法,遏制病毒的传播扩散。

