基于CT 测量的肿瘤体积对非小细胞肺癌患者新辅助化疗疗效的评估价值
张惠玲,张宏伟,何元华
资阳市第一人民医院1肿瘤科,2医学影像科,四川 资阳641300
非小细胞肺癌约占肺癌的80%,临床上主要通过化疗来缓解,随后根据患者的病情状况予以手术治疗及生物靶向治疗等,治疗后患者5年生存率可达70%[1]。部分患者在确诊肺癌时,往往错过手术的最佳时机[2]。研究发现,在术前进行新辅助化疗,将相关水平控制在正常水平再进行手术,可以提高治疗效果[3]。选择适宜的方式对辅助化疗疗效进行评估有利于预测患者的疗效,制定后续治疗方案,同时降低不良反应的发生率[4]。相关文献报道,肿瘤体积在评估癌患者疗效方面有一定的应用,加大放疗剂量,在缩小肿瘤体积的同时,也会加重其副作用[5]。因此确定科学合理的新辅助化疗周期,对于改善患者预后意义重大。CT作为一种影像学技术能对肺部病变组织进行详细观察,查看病变形态及体积[6]。然而基于CT测量的肿瘤体积在非小细胞肺癌新辅助化疗中的研究却少有报道。本研究以2019年5月~2020年5月在我院接受新辅助化疗的74例非小细胞肺癌患者为研究对象,探讨基于CT测量的肿瘤体积对其新辅助化疗疗效的评估价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年5月~2020年5月在我院接受新辅助化疗的74例非小细胞肺癌患者。纳入标准:符合临床上关于非小细胞肺癌的诊断标准[7];经病理检查确诊;接受化疗前未行肺癌切除术;CT显示肿瘤边界清晰,体积可测量;患者及家属知情。排除标准:心、肝等其它器官存在疾病者;合并其它恶性肿瘤者;临床资料不完整;依从性较低;认知功能障碍者。根据化疗后病灶病理变化情况进行分组,将病灶中度变化和显著改变患者纳入有效组,病灶无变化和轻度变化患者纳入无效组。74例患者中,男52 例,女22 例,年龄35~80(57.42±10.35)岁。肿瘤位置:上肺39例,中下肺35例;病理分型:腺癌35例,鳞癌22例,其他类型17例。本研究通过本单位医学伦理审批。
1.2 方法
采用螺旋CT对所有患者肺部进行扫描。获取肿瘤CT图像后,将其输入至Philips ADAC Pinnacle 39.0 m系统,逐步勾画并测量体积。所有勾画条件和标准均统一,肺部肿瘤通过肺窗进行勾画(W=1600,L=-700),纵隔区肿瘤通过纵隔窗进行勾画(W=400,L=-400),当无法区分转移淋巴结和原发灶时,则全部属于原发灶。采用TPS及ImageJ图像处理软件对化疗前后肿瘤绝对体积进行计算,数据均通过测量得到。由同一影像操作人员完成勾画患者肿瘤体积和测量步骤,每个患者的肿瘤体积经2次勾画测量,再计算平均值所得。
随访:化疗结束后,每隔6月进行随访,随访持续1年。经门诊和电话完成随访,随访率为92%。统计所有患者化疗后6月、1年的生存率。
1.3 病理判断标准
无变化:所有病灶不存在细胞坏死,结构也没有变化;轻度变化:坏死及消失的肿瘤细胞<所有病灶的1/3,只有细胞或组织结构发生变化;中度变化:坏死及消失的肿瘤细胞>所有病灶的2/3,但依然存在癌细胞;显著改变:所有病灶均坏死并且消失,或由纤维组织取代,没有癌细胞存活。
1.4 统计学分析
采用SPSS19.0对数据进行分析,计量数据以均数±标准差表示,组间比较行t检验;计数资料以n(%)表示,组间比较行卡方检验;采用ROC曲线对肿瘤体积评估新辅助化疗疗效的价值进行分析,得出特异性及敏感度;肿瘤体积的影响因素经多因素Logistic回归的方法分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 化疗前后肿瘤体积及不同时期生存率
化疗前两组患者肿瘤体积的差异无统计学意义(P>0.05);化疗后,两组患者肿瘤体积小于化疗前(P<0.05),有效组患者肿瘤体积小于无效组(P<0.05)。两组患者化疗后6月生存率差异无统计学意义(P>0.05);化疗后1年,有效组患者生存率高于无效组(P<0.05,表1)。

表1 化疗前后两组患者肿瘤体积大小及不同时期生存率比较Tab.1 Comparison of tumor size before and after chemotherapy and survival at different periods in the two groups
2.2 化疗前后非小细胞肺癌患者肺部CT图像
化疗后,非小细胞肺癌患者左右肺肿瘤体积较化疗前有明显缩小(图1)。
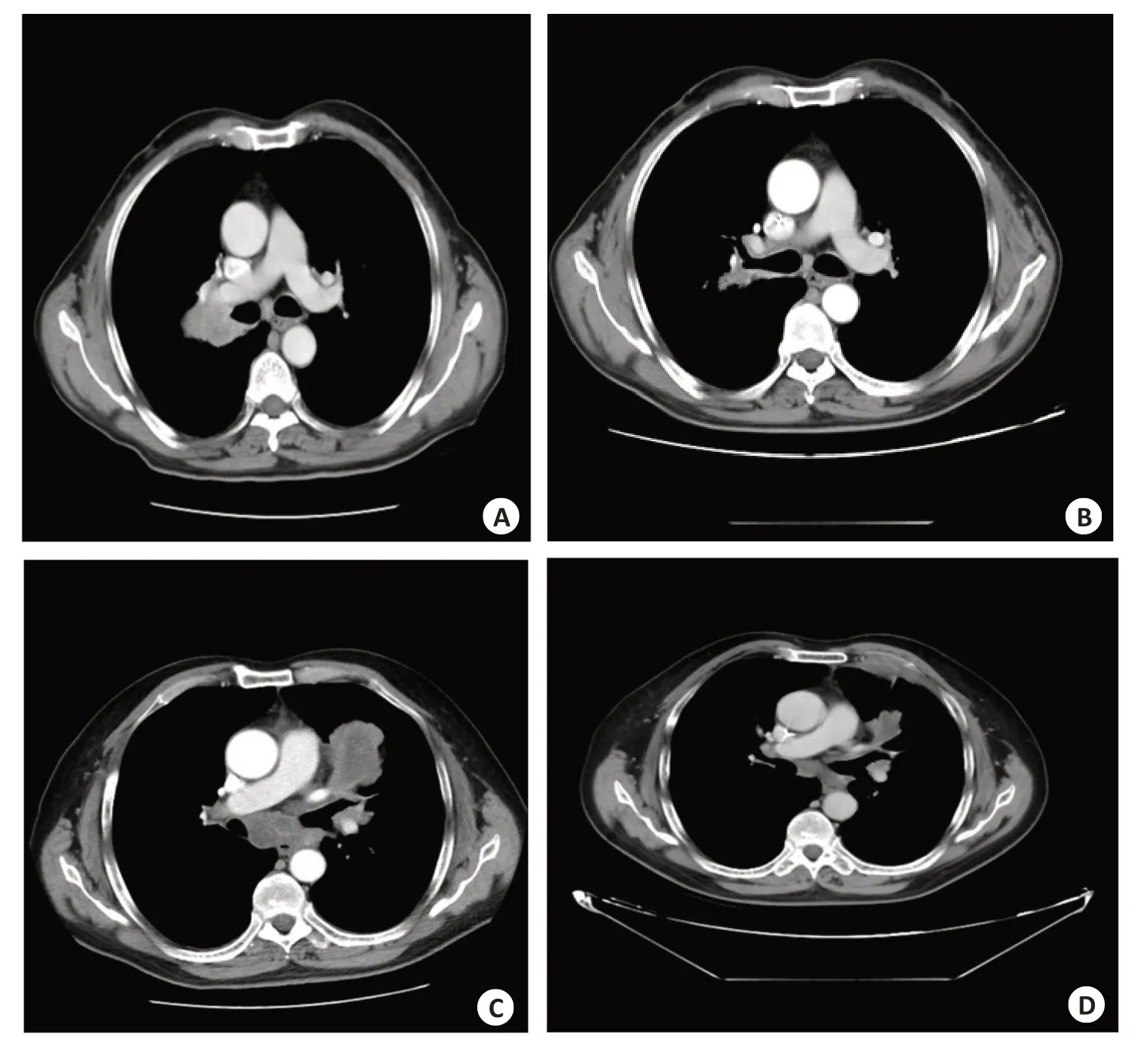
图1 化疗前后非小细胞肺癌患者肺部CT图像Fig.1 Lung CT images of NSCLC patients before and after chemotherapy.A: Right upper lung non-small cell lung cancer before chemotherapy;B:Right upper lung non-small cell lung cancer after chemotherapy;C: Before chemotherapy for non-small cell lung cancer of left upper lung;D:Left upper lung non-small cell lung cancer after chemotherapy.
2.3 影响肿瘤体积的单因素分析
以化疗后1周肿瘤退缩率为依据,将患者分为退缩率≥30%组(n=53),退缩率<30%组(n=21)。经单因素分析,临床分期、分化程度以及化疗周期可能是肿瘤体积的影响因素(P<0.05,表2)。
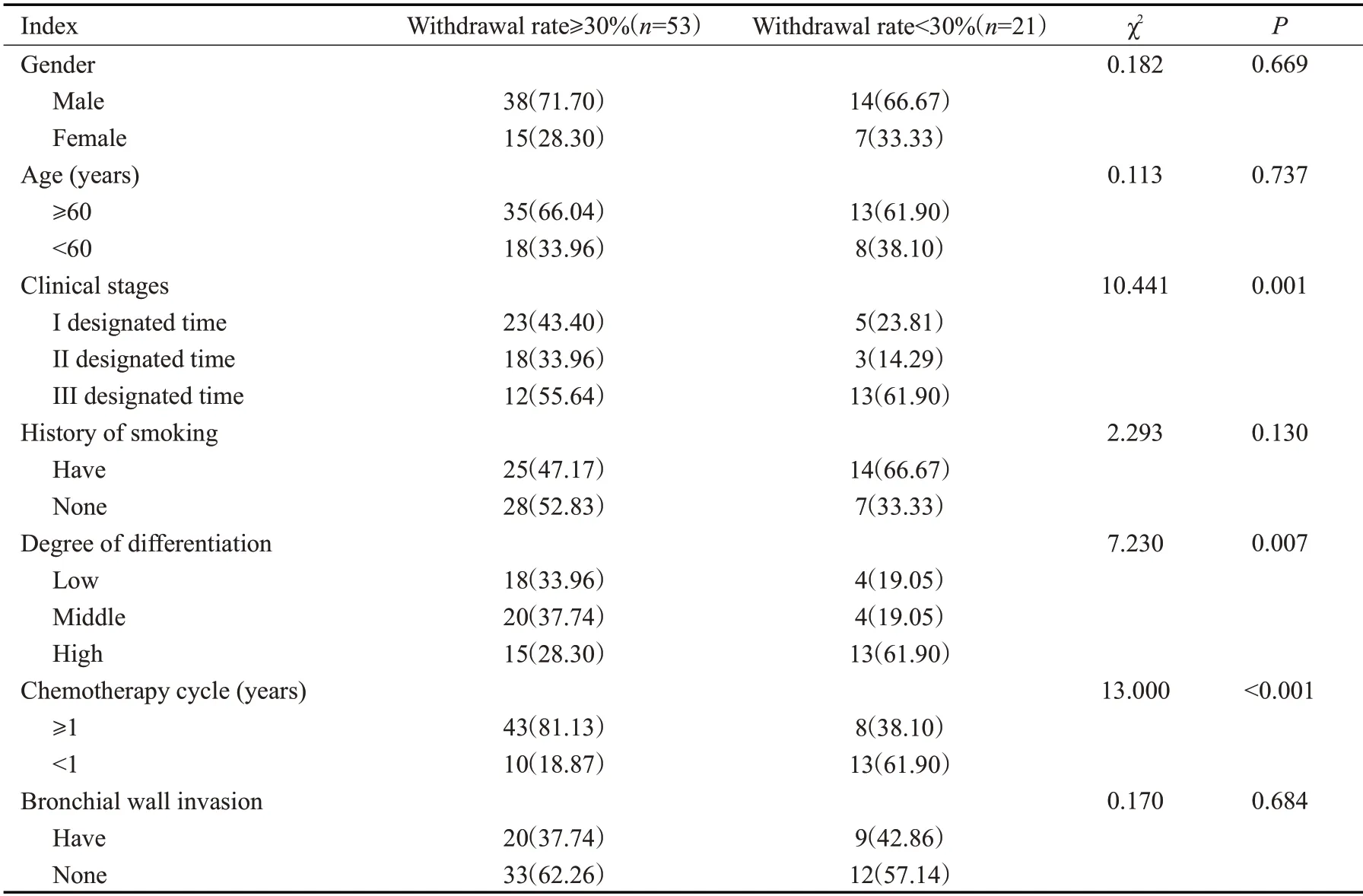
表2 影响肿瘤体积的单因素分析Tab.2 Univariate analysis affecting tumor volume[n(%)]
2.4 影响肿瘤体积的多因素Logistic回归分析
将单因素分析中差异有统计学意义的临床分期、分化程度及化疗周期为自变量,以肿瘤体积为因变量,纳入Logistic回归分析,结果显示:临床分期、分化程度及化疗周期是非小细胞肺癌患者肿瘤体积的影响因素(P<0.05,表3)。
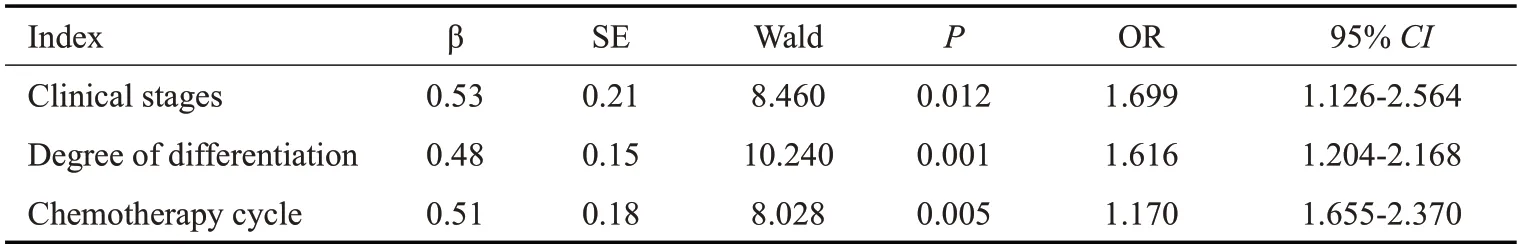
表3 影响肿瘤体积的多因素Logistic回归分析Tab.3 Multivariate Logistic regression analysis affecting tumor volume
2.5 肿瘤体积预测新辅助化疗疗效的ROC曲线
采用ROC曲线分析肿瘤体积对非小细胞肺癌患者新辅助化疗疗效的预测价值,曲线下面积为0.841,约登指数为0.357,敏感度为0.732,特异性为0.800(图2)。
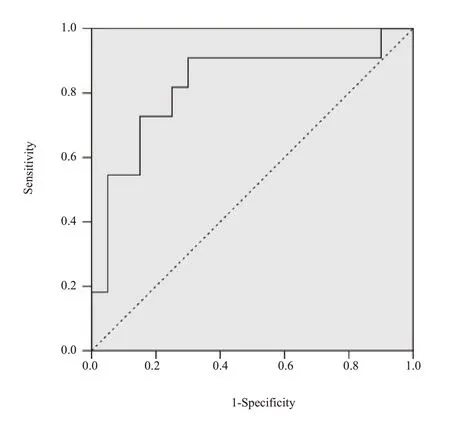
图2 肿瘤体积预测新辅助化疗疗效的ROC曲线Fig.2 ROC curves of tumor volume for predicting the efficacy of neoadjuvant chemotherapy.
3 讨论
肺癌患者一般预后较差,确认初期肺癌的类型,可使患者获得最佳治疗,降低其死亡率[8]。新辅助化疗是应用率较高的一种癌症方式,确定合理的治疗周期对患者具有重要意义。如何评估新辅助化疗的疗效成为研究的热点[9-10]。通过CT检查能明确肿瘤病灶的位置、大小以及其它情况,其耗时短,能对图像进行有效处理,可准确测量肺癌患者的肿瘤体积[11]。
文献报道,肿瘤体积越大,患者的预后越差[12]。有学者通过对进展期胃癌患者采用CT体积测量评估新辅助化疗的疗效,结果显示,CT肿瘤体积测量更客观,与化疗疗效的相关性更好[13]。因此以肿瘤体积来评估非小细胞肺癌的新辅助化疗效果具有一定的科学依据。本研究发现,化疗后,两组患者肿瘤体积小于化疗前,有效组患者肿瘤体积小于无效组;化疗后1年,有效组患者生存率高于无效组,说明肿瘤体积与非小细胞肺癌患者新辅助化疗疗效相关。既往研究表明,原发灶肿瘤体积是影响非小细胞肺癌化疗1周期后疗效的独立因素[14],与本研究结果类似,但该研究并未对肿瘤体积的评估价值进行分析。
此外,将单因素分析中差异有统计学意义的临床分期、分化程度及化疗周期为自变量,以肿瘤体积为因变量,纳入Logistic回归分析,结果显示:临床分期、分化程度及化疗周期是非小细胞肺癌患者肿瘤体积的影响因素,临床分期较高的肺癌患者,其恶性程度也较高,对化疗的敏感度也越高;而化疗周期较长或较短都会影响肿瘤的体积,考虑为体积较大的肿瘤有更丰富的血供,其获取能力较强,化疗药物进入后可以发挥更明显的功效,这与既往研究[15-17]结果具有一定的相似性。本研究进一步评价了肿瘤体积对新辅助化疗疗效的预测效能,ROC曲线分析结果显示,肿瘤体积对非小细胞肺癌患者新辅助化疗疗效的预测具有一定的价值,其敏感度和特异性均较高。这与既往研究[18]发现肿瘤体积对I期非小细胞肺癌术后患者具有较高的预测价值相一致。
综上所述,基于CT测量的肿瘤体积对非小细胞肺癌患者新辅助化疗疗效有一定的评估价值。