多模态MRI预测中晚期宫颈癌患者对甲磺酸阿帕替尼治疗反应的价值
彭露杏,陆合明,陈甲信,蒋海兰,卢志平,陈钊宏,邓 珊,古俊钊,庞 强,吴友军,梁 萍
广西壮族自治区人民医院临床肿瘤中心放射治疗病区,广西 南宁530021
宫颈癌在我国的发病率及死亡率约占全球的1/3,手术和放化疗是主要治疗方案[1-2]。对于早期宫颈癌多以手术治疗,但对于中晚期宫颈癌,手术联合放化疗是常见的治疗方法[3]。甲磺酸阿帕替尼是新型抗血管生成制剂,已被批准用于中晚期宫颈癌的治疗中,同时能够发挥延长生存期的效果[4-5],但其疗效以及反应性还需要准确、及时、有效的评估,目前已逐渐受到临床上的重视。扩散加权成像(DWI)、T1WI、T2WI和增强T2*加权血管成像(ESWAN)均是近些年来常用的肿瘤功能性成像诊断技术,在进展期宫颈癌的治疗评估中发挥着重要的作用[6-7]。多模态MRI在疾病诊断和肿瘤转移等方面均有一定的价值[8],但目前国内对临床疗效的预测多以单一技术研究为主,尚缺乏多模态联合评估治疗效果的研究。本研究通过对比中晚期宫颈癌经过甲磺酸阿帕替尼治疗后不同反应性患者DWI、T1WI、T2WI 和ESWAN特征,以探讨多模态MRI预测中晚期宫颈癌甲磺酸阿帕替尼治疗反应性的临床价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取2017年3月~2022年1月于我院住院的60例接受甲磺酸阿帕替尼治疗的中晚期宫颈癌患者为研究对象,根据患者治疗反应性将其分为A组(存在显著反应,n=48)和B组(无显著反应,n=12)。纳入标准:经病理检查诊断为宫颈癌;国际妇产科联盟分期[9]为Ⅲ~Ⅳ期;治疗前接受研究涉及的影像学检查;年龄18~70岁;临床资料完整。排除标准:图像质量不佳;患者接受化疗疗程不足1个周期;合并其他恶性肿瘤;临床资料不完整。两组患者临床资料之间差异无统计学意义,具有可比性(P>0.05,表1)。本研究经医院医学伦理委员会批准。

表1 两组患者临床特征资料比较Tab.1 Comparison of clinical characteristics data between two groups of patients
1.2 扫描方法
扫描仪器为Siemens Magnetom Trio 3.0 T磁共振仪,线圈为8通道相控阵体部线圈,加用呼吸门控技术,对患者行常规MRI平扫、DWI以及动态增强扫描。若患者带环,则需先取下节育环。检查前患者需充分饮水,使膀胱适度充盈,休息25 min左右后行扫描检查,保持呼吸平稳。
常规扫描:横轴面T1WI设置层厚4 mm,间距1 mm,视野400 mm×400 mm,TR/TE=550/13 ms,激励次数2;脂肪抑制序列横轴面FSE T2WI设置层厚4 mm,间距1 mm,视野400 mm×400 mm,TR/TE=550/3 ms,激励次数2。
DWI扫描:单次激发SE EPI序列,设置层厚4 mm,间距1 mm,视野400 mm×400 mm,TR/TE=3500/93 ms,矩阵320×256,b值=0、600 s/mm2。
DCE-MRI扫描:选取Gd-DTPA为对比剂,经高压注射器进行肘静脉团注0.1 mmol/kg,其流率为3 mL/s,然后三维容积内插快速扰相梯度回波序列进行扫描,TR/TE=5.08/7.4 ms,翻转角为15°,扫描时间设置为8 s,对其进行图像重复采集35组。
常规T1WI增强扫描:横轴面设置层厚4 mm,视野400 mm×400 mm,TR/TE=3.23/1.22 ms,矩阵195×320,激励次数2;矢状面设置层厚4 mm,视野400 mm×400 mm,TR/TE=3.1/1.25 ms,矩阵202×384,激励次数2。
ESWAN 扫描:轴位3D,首个回波:TR/TE=16.3/2.1 ms,翻转角为15°,5个回波,带宽+/-62.5 kHz,层厚与重建层厚分别为8 mm、2 mm,扫描矩阵和重建矩阵分别为256×192、512×512,对加速因子2进行采集,憋气21 s。
1.3 图像分析
将DWI序列采用ADW 4.5工作站进行DWI图像自拟合成ADC图像;将ESWAN扫描所得的每一层均行5个回波的图像获得,将图像传输至ADW 4.5工作站,采用Functoo软件进行处理,并将第一个回波序数进行过滤,保留图像并进行处理后获得相位图、幅度图和R2*图。由2位具有丰富经验的放射科医生独立进行感兴趣区手动勾画,进行图像分析和数据测量。对比两组患者T1WI、T2WI、DWI和ESWAN序列幅度图、相位图以及R2*图信号强度。
1.4 统计学分析
采用SPSS20.0进行统计分析,计数资料以n(%)表示,组间比较采用χ2检验;ADC值、相位值与R2*值等计量资料根据是否符合正态分布,选用独立样本t检验或非参数Mann-WhitneyU检验,采用ROC曲线进行预测效能分析。以P<0.05为差异有统计学意义。
2 结果
2.1 常规序列扫描观察结果
两组患者T1WI序列均以等信号强度为主,T2WI序列均以混杂信号为主,但两组病灶整体信号强度之间的差异无统计学意义(P>0.05,表2)。
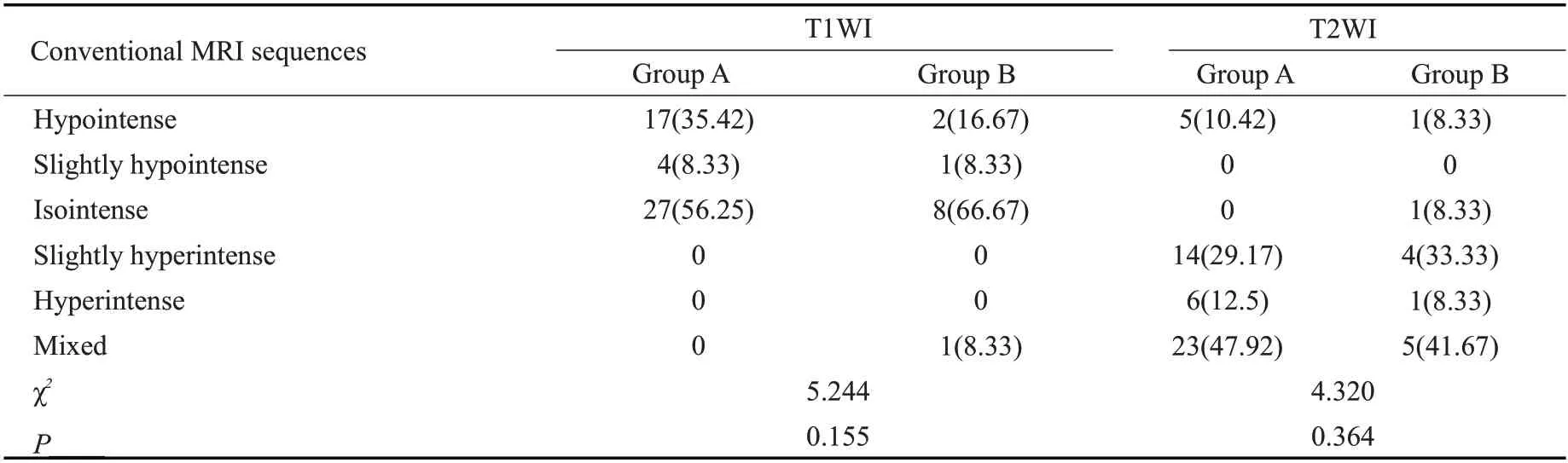
表2 不同治疗反应性宫颈癌患者常规序列扫描病灶整体信号强度Tab.2 Overall signal intensity of lesions in routine sequence scanning of cervical cancer patients with different treatment responsiveness[n(%)]
2.2 DWI序列扫描观察结果
2位医生获得宫颈癌ADC值的组内相关系数值分别为0.936、0.939,一致性良好。两组患者DWI序列信号强度均以混杂信号为主,其中B组患者高低混杂信号占比更大(P<0.05,表3)。A 组患者ADC 值平均为(1.48±0.41)×10-3mm2/s,B组患者ADC值平均为(1.31±0.38)×10-3mm2/s,两组ADC值之间差异有统计学意义(Z=6.724,P<0.05)。

表3 不同治疗反应性宫颈癌患者DWI 序列扫描病灶整体信号强度Tab.3 Overall signal intensity of DWI sequence scanning lesions in patients with different treatment responsive cervical cancer[n(%)]
2.3 ESWAN序列扫描观察结果
2位医生获得宫颈癌相位值、R2*的组内相关系数值分别为0.963 和0.979、0.984 和0.992,一致性良好。两组患者幅度图均以低信号为主,相位图和R2*图均以混杂信号为主,两组患者图像信号强度之间差异均具有统计学意义(P<0.05,表4)。A 组与B 组患者相位值分别为-0.002±0.108 和-0.006±0.088,R2*值分别为36.38±13.27 Hz和47.61±17.44 Hz,两组差异有统计学意义(Z1=4.215,Z2=13.658,P<0.05)。
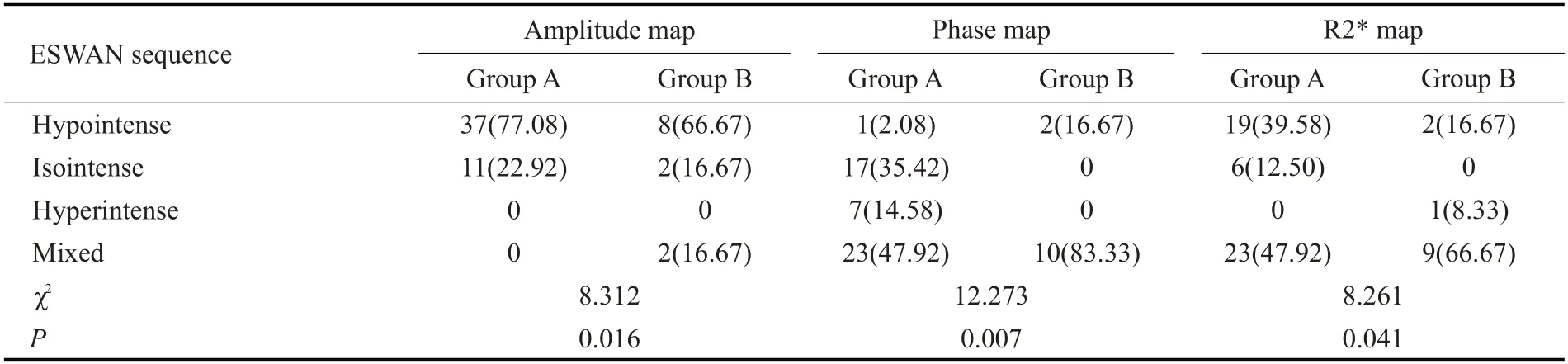
表4 不同治疗反应性宫颈癌患者ESWAN序列扫描病灶整体信号强度Tab.4 Overall signal intensity of ESWAN sequence scanning lesions in patients with different treatment responsive cervical cancer[n(%)]
2.4 ROC曲线分析
ADC值、相位值和R2*值预测宫颈癌患者治疗反应性的AUC分别为0.613、0.656、0.759,三者对于宫颈癌患者在接受甲磺酸阿帕替尼治疗后,具有明显反应性的预测特异性和敏感度分别为43.8%、60.4%、58.3%和83.3%、66.7%、83.3%(表5、图1)。

图1 ADC值、相位值和R2*值预测宫颈癌患者治疗反应性的ROC曲线分析Fig.1 ROC curve analysis of ADC value,phase value,and R2*value predicting treatment response in cervical cancer patients.

表5 ADC值、相位值和R2*值对于宫颈癌患者治疗反应性的预测效能Tab.5 Predictive efficacy of ADC values,phase values and R2*values for treatment responsiveness in cervical cancer patients
3 讨论
随着目前我国防癌筛查普及,宫颈癌早诊率得到提升,中晚期患者逐渐减少,死亡率也随之下降,但总5年生存率仅50%,其中改善预后最大障碍为初治后复发治疗[10]。大多数宫颈癌复发时间在初治后2年内[11]。目前对该类患者治疗方案受限,部分患者失去手术或再次放疗的机会,主要为姑息化疗[12]。阿帕替尼为小分子抗血管生成物,研究显示甲磺酸阿帕替尼对乳腺癌、肝癌、胃癌等多肿瘤治疗有效[13]。体外阿帕替尼对宫颈癌细胞有增殖抑制效果,但长期使用阿帕替尼可引起血凝异常,对患者预后有显著影响[14-15]。故早期判断患者治疗后的反应性对提高患者生存质量极为重要。在本研究60例接受阿帕替尼治疗的患者中,有48例患者具有显著治疗反应性,提示阿帕替尼对宫颈癌患者有较高的临床疗效。既往一项关于中晚期宫颈癌患者的疗效研究显示阿帕替尼联合化疗对宫颈癌患者的有效率为82.8%[16],与本研究结果较为一致。
超声检查方式易受到肠气的干扰,对病变的定性较为困难;CT检查对机体有辐射,部分患者对对比剂不耐受;而MRI的空间分辨率较高,有较强的组织对比度,对肿瘤定性更有优势[17-18]。多模态MRI为常规MR扫描序列结合多种磁共振成像以实现多种扫描序列互补,从而为疾病诊断提供更全面的信息。随着MRI技术发展,多模态MRI在腹部疾病诊断中逐渐广泛应用[19]。多模态MRI强调联合,因存在序列稳定性,各序列不能相互替代,但联合使用具有更好效果[20]。本研究将多模态MRI用于诊断宫颈癌治疗后的反应性,DWI联合ESWAN技术,分析影像学参数对于中晚期宫颈癌患者治疗反应性的预测价值。
DWI为在分子水平上研究活体组织的功能成像技术,通过信号强度与ADC值反映被检组织水分子扩散情况[21]。随着MRI技术的发展,DWI在腹部肿瘤中的诊断价值更为广泛,但目前尚无利用DWI鉴别宫颈癌甲磺酸阿帕替尼治疗反应性的文献。本研究中两组患者的DWI信号均以混杂信号为主,可能与恶性肿瘤成分复杂、水分子运动多变等有关[22-23]。ADC值可定量分析DWI序列的水分子扩散情况,组织液体成分多导致水分子自由运动较快,ADC 值偏大,反之ADC 值较小。本研究中A组ADC值高于B组,该结果原因可能是无显著反应患者的细胞结构致密,其含水量较低,故对DWI 梯度变化较为迟钝,ADC 值比反应显著患者低。一项关于局部宫颈癌疗效预测的研究显示,ADC是预测宫颈癌疗效的可靠指标,其敏感度和特异性分别为75.00%和78.12%[24],其敏感度高于本研究,特异性低于本研究,可能是因为该研究中的预测指标采用的是治疗前和反射治疗2次后ADC差值,与本研究指标选取上存在一定差异。
ESWAN序列为基于磁敏感加权成像序列的新型序列,该序列是多回波采集的重度T2加权,不仅具备磁敏感加权成像序列所拥有的高分辨及薄层三维采集等特征,还具有多回波采集方式,能获得多个参数[25-26]。随着扫描技术改善与扫描时间缩短,磁敏感成像技术在腹部肿瘤中应用。本研究中两组患者幅度图上主要为低信号,在相位图上主要为混杂信号,其信号强度与患者肿瘤质子密度有关。其中B组患者相位图混杂信号占比更大,其原因可能为无显著反应患者肿瘤细胞代谢旺盛,机体耗氧量增加,血液产物也相对较多,在相位图上的信号混杂,相位值也下降[27]。该类患者因癌细胞生长较为活跃,部分供血不足,易导致瘤体局部出血,可能是引起相位图信号强度变化的原因[28]。两组R2*图主要为低信号。由于R2*值与去氧血红蛋白水平有关,随着机体去氧血红蛋白水平增加,R2*值上升,MR信号随之降低。有研究显示ESWAN序列能对宫颈癌进行诊断和疗效评估,但其未探究ESWAN序列能否预测甲磺酸阿帕替治疗宫颈癌的疗效[29]。本研究中B组R2*值高于A组,该结果原因可能是无显著反应患者癌组织生长活跃,含氧量增加使机体处于缺氧状态,导致肿瘤中去氧血红蛋白增多[30]。本研究中ADC值、相位值和R2*值预测宫颈癌患者治疗反应性的AUC分别为0.613、0.656、0.759,三者对于宫颈癌患者在接受甲磺酸阿帕替治疗后是否具有明显反应性均有较高的预测效能,其中R2*值诊断效能最高,高于ADC值、相位值。
综上所述,接受甲磺酸阿帕替尼治疗的中晚期宫颈癌患者治疗后有无反应性在MR常规序列中的征象具有重叠,无特异性,但有反应性患者在DWI、ESWAN图像上表现相对于无反应患者更复杂,有较多混杂信号,ADC值、相位值与R2*值可作为判断阿帕替尼治疗后有无反应的定量指标,其中R2*值的价值更高。