T细胞大颗粒淋巴细胞白血病合并系统性红斑狼疮、肺结节病一例
丁叶利 郝玉秋 杨俊玲
患者,女,52岁,因“进行性咳嗽、气短6个月伴间断发热1周”于2019年8月12日入院。6个月前患者无明显诱因出现进行性咳嗽、气短,未系统治疗。1周前无明显诱因出现间断发热,自测最高体温39.2 ℃,伴干咳,自觉咽部有痰、难以咳出,伴晨起头痛、气短、乏力,于当地医院就诊,诊断为肺炎,行抗感染治疗发热症状缓解,但咳嗽、气短、乏力仍然无好转,为求进一步治疗遂来我院。既往史:高血压疾病史20余年(未规律用药);癫痫病史13年,一直规律口服开浦兰(早0.25 g,晚0.5 g),病情控制尚可,2年未发作。否认特殊物品接触史、食物药物过敏史及特殊家族史。体格检查:T 37.4 ℃、P 75次/分、R 109次/分,Bp 122/83 mmHg,一般状态尚可,左侧肘部及右腰部各见1个大小约3 cm×3 cm的暗紫色结节,全身各浅表淋巴结未触及肿大;律齐,各瓣膜听诊区未闻及杂音,肺呼吸音粗,可闻及散在细湿啰音,倾向于爆裂音。腹软,肝脾肋下未触及。实验室检查:血常规:WBC计数 2.1×109/L(4.0~10.0×109/L,括号内为正常参考值范围,以下相同),淋巴细胞百分比77.5%(20.0%~40.0%),单核细胞百分比16.3%(3.0%~8.0%),中性粒细胞百分比5.7%(50.0%~70.0%),中性粒细胞计数0.38×109/L(1.80~6.30×109/L),RBC计数3.46×1012/L(4.30~5.80×1012/L),血红蛋白105 g/L(120~160 g/L),未成熟网织红细胞比率0.079%(0.500%~1.500%),网织红细胞计数92×108/L(24~84×108/L);尿蛋白+;肝肾功能:ALT 214 U/L(0~40 U/L),尿酸399 μmol/L(<357 μmol/L),AST 195 U/L(0~40 U/L),直接胆红素7.85 μmol/L(0~6.80 μmol/L),间接胆红素18.25 μmol/L(0~12.00 μmol/L),总胆红素26.1 μmol/L(1.7~17.0 μmol/L);肾小球滤过率56.6 ml/min(90.0~120.0 ml/min);降钙素原、真菌D-葡聚糖、结核杆菌斑点试验检查均为阴性;自身免疫检查:高敏C反应蛋白29.3 mg/L(<5.0 mg/L),补体C3 84.3 g/L(0~81.2 g/L),补体C4 15.2 g/L(90.0~360.0 g/L),抗核抗体(ANA):1∶320,抗心磷脂抗体35 RU/ml(0~20 RU/ml);抗链球菌溶血素O(ASO)149 IU/ml(0~116 IU/ml),轻链、自身免疫性肝病检查结果未见异常。气管镜下未见明显异常。气管镜下肺组织病理检查结果(图1):可见上皮细胞肉芽肿改变,抗酸染色阴性。皮肤暗紫色结节病理检查结果(图2):表皮轻度增生,真皮中上部可见致密的上皮细胞肉芽肿改变,抗酸染色阴性;主要为“裸结节”,并见较多多核巨细胞;提示结节病。骨髓及外周血细胞学检查结果:血涂片:WBC总数下降,粒细胞占10%,成熟红细胞大小不一;计数100个WBC未见有核红细胞,淋巴细胞占86%,血小板散在、易见。骨髓涂片:骨髓增生减低,G=37%、E=48%、G/E=0.78∶1;粒系增生活跃,以中幼以下阶段为主,形态无异常;红系增生活跃,以中晚红为主,可见巨幼样变。骨髓病理(图3):骨髓增生活跃,粒红比值降低,粒系增生低下,偏成熟阶段粒细胞减少,红系增生,以中晚幼红细胞增生为主;淋巴细胞增生明显,灶性或散在分布,其体积小,部分核型不规则,染色质较粗,少量可见核仁,巨细胞可见;可见单圆核巨核细胞。检验诊断:淋巴增值性疾病。骨髓病理免疫组化结果:CD20个别+、CD2少数+、CD3少数+、CD5少数+、CD7少数+、CD4部分+、CD8部分+、CD56-、CD57个别+、TIA1少数+。流式细胞(大颗粒淋巴细胞)检测结果:CD3+CD57+T细胞大颗粒淋巴细胞白血病(T-LGLL)细胞占淋巴细胞16.38%;CD3-CD56+自然杀伤细胞占淋巴细胞1.59%。血液肿瘤免疫分型结果:淋巴细胞约占有核细胞50.6%,其中CD3+CD5-细胞约占淋巴细胞52.73%,约占有核细胞25.36%,表达CD2、CD3、CD7、CD8、TCRα、β,部分表达CD57、不表达CD4,考虑为表型异常的T淋巴细胞可能。最终诊断:系统性红斑狼疮(SLE),肺结节病,T-LGLL。予抗感染(莫西沙星0.4 g/d)、糖皮质激素(米乐松40 mg/d)、免疫制剂(甲氨蝶呤15 mg/日)、升白细胞(芪胶升白胶囊)、保肝(还原性谷胱甘肽)、降黄疸(思美泰)、降血压(左旋氨氯地平)及对症治疗3周,患者临床症状完全缓解,复查血常规:WBC计数正常,淋巴细胞百分比40.4%,单核细胞百分比14.1%,中性粒细胞百分比45.3%,中性粒细胞计数正常,RBC计数3.38×1012/L,血红蛋白104 g/L,临床症状完全消失,遂于2019年9月12日出院。随访至2021年1月,患者病情稳定。
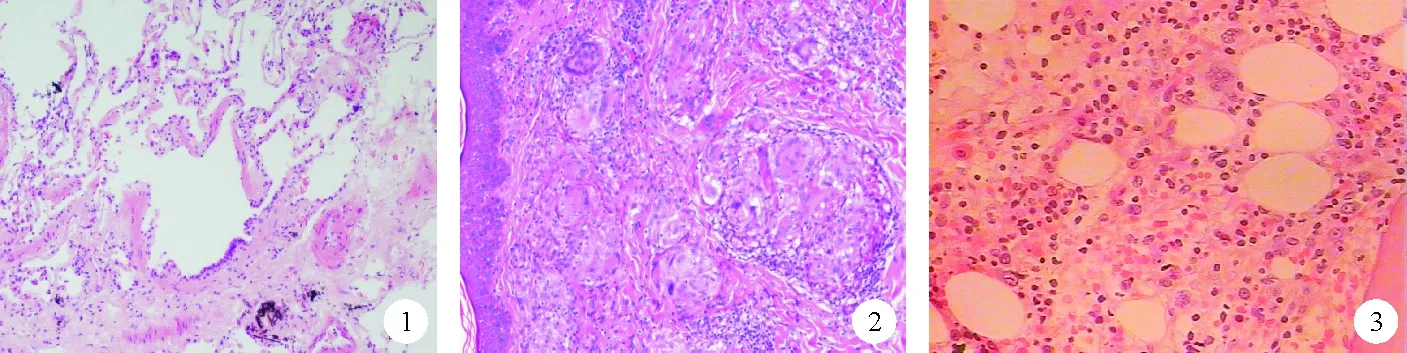
图1 2019年8月15日患者肺组织病理检查结果(免疫组化染色,×50) 图2 2019年8月21日患者皮肤暗紫色结节病理检查结果(HE染色,×50) 图3 2019年9月9日患者骨髓病理检查结果(抗酸染色,×50)
讨 论
SLE是一种好发于育龄期女性的复杂自身免疫性疾病。该病初期累及造血系统并不少见,主要表现为贫血、自身免疫性溶血、WBC计数减少和(或)PLT减少,可能与免疫介导的造血系统破坏及感染、药物毒性或合并血液系统疾病有关[1-2]。本例患者有癫痫病史,长期口服开浦兰(左乙拉西坦平),该药可导致血液及淋巴系统不良反应,表现为WBC、中性粒细胞及RBC、PLT计数减少。本例患者在服用开浦兰期间检测血常规提示RBC、WBC、PLT减少,可能认为与该药的不良反应有关[3]。结节病是一种病因不明的可累及多个组织和(或)器官的系统性肉芽肿性疾病,约90%的患者有肺部累及,其次是皮肤和眼部,发病年龄在20~60岁,女性略高于男性[4]。肺结节病的典型临床表现为纵隔及对称性双肺门淋巴结肿大,伴或不伴肺内阴影,影像学检查及组织病理检查属于排他性诊断,需排除其他原因引起的肉芽肿性疾病后方可确诊为结节病[5]。肺结节病有一定的自发缓解率,大部分结节病患者无需使用药物治疗[6-7],应结合患者的临床症状、影像学、肺功能受损情况及特定器官受累等情况进行谨慎分析,对有症状且有影像学和(或)肺功能下降[用力肺活量(FVC)或弥散功能较基础值下降>15%]患者应采取治疗措施,治疗上主要为全身应用糖皮质激素/吸入糖皮质激素及免疫抑制剂治疗。SLE发生机制主要是CD4+、CD8+T淋巴细胞功能失调,导致B淋巴细胞继续活化产生多种自身抗体,作用于T淋巴细胞,特别是辅助性T淋巴细胞(Th)亚群Th1/Th2、Th17、调节性T细胞(Treg),分泌的细胞因子IL-10、IL-12、IL-17及转化生长因子(TGF)-β1参与免疫应答的调控。Pretorius等[8]报道IL-15与自身免疫性疾病密切相关,IL-15表达异常可诱发免疫性疾病。而肺结节病的病理特征为非干酪样坏死性上皮样细胞肉芽肿,该肉芽肿的形成是由于CD4+T细胞及巨噬细胞浸润,具体机制仍不明确,肺组织暴露于尚未鉴定的抗原,促使CD4+T细胞激活,使得Tregs、Th1细胞因子、肿瘤坏死因子(TNF)-α、干扰素(IFN)-γ和IL-2高表达,这些均表明结节病的发生与T淋巴细胞免疫功能异常有关。
综上,T-LGLL与自身免疫性疾病的发病机制目前尚未完全明确,治疗上存在困难,在临床上遇到顽固复发的粒细胞缺乏,尤其是合并自身免疫性疾病的粒细胞缺乏,应及时考虑到本病可能,并及时安排血液及骨髓系统相关检查,从而排除恶性肿瘤,减少误诊及漏诊。

