NLRP3对自身免疫性脑炎的影响及其作用机制
王 莉,于雪源,闾佳佳,陈 飞
0 引 言
自身免疫性脑炎(autoimmune encephalomyelitis,AE)是系统性自身免疫病,大脑及脊髓是最常受累的靶器官。抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate-receptor, NMDAR)脑炎是最常见的AE类型之一,也是研究较为热门的AE之一,其发病机制仍不十分清楚[1]。研究发现,抗NMDAR脑炎患者脑组织病理显示血管周围及实质内有大量T细胞浸润,表明T细胞可能参与抗NMDAR脑炎的免疫炎症反应,且Th17细胞能通过募集中性粒细胞促进拮抗胞外细菌感染,此病理过程可进一步加重神经系统炎症反应[2-3]。因此Th17免疫反应与自身免疫性疾病的免疫病理学密切相关[4]。尽管如此,Th17细胞的数量、分化及其在脱髓鞘疾病的调控机制尚不清楚。近期在抗NMDAR脑炎患者及实验性自身免疫性脑炎(experimental autoimmune encephalomyelitis,EAE)动物模型中发现,多种炎症小体,包括NLRP3和NLRP1的活化是中枢神经系统炎症发生发展的关键[5-7]。本研究进一步探讨NLRP3活化对EAE小鼠中枢神经系统Th17免疫反应、脱髓鞘病变和炎症程度的影响,以期为AE的治疗靶点及精准治疗提供基础。
1 资料与方法
1.1 临床资料选取在2019年6月至2020年12月南京医科大学附属脑科医院确诊为抗NMDAR脑炎的患者(n=5)作为抗NMDAR组,纳入标准:脑脊液中抗NMDAR抗体阳性,且磁共振成像(MRI)证实中枢神经系统炎症。诊断标准为:(1)出现6项主要症状中的1项或多项:①精神行为异常或认知障碍;②言语障碍;③癫痫发作;④运动障碍/不自主运动;⑤意识水平降低;⑥性神经功能障碍或中枢性低通气。(2)脑脊液抗NMDAR抗体阳性。排除其他病因明确的自身免疫性脑炎综合征,如典型的边缘系统脑炎、急性播散性脑脊髓炎、Bickerstaff脑干脑炎。选择非炎症性神经系统疾病的6例患者作为对照组,纳入标准:不符合上述AE诊断标准,且脑脊液抗NMDAR抗体阴性。参与本研究的患者无其他疾病,在研究之前未接受免疫抑制剂治疗。留取所有入组者在完成临床需要后剩余的脑脊液及血清标本,转移至聚丙烯管中并储存于-80 ℃冰箱。本研究通过南京脑科医院医学伦理委员会审查(批准号:2020-KY212-01)。
1.2实验动物及试剂
1.2.1 实验动物雌性无特定病原体级(SPF级)C57BL/6J小鼠,6~8周,购于上海JSJ实验动物技术有限公司,饲养于瑞金医院SPF级动物房。
1.2.2主要试剂humanIL-1β ELISA试剂盒(达科为,中国),human NLRP3 ELISA试剂盒(Abcam, 英国),mouse CD4抗体(Biolegend,美国),mouse NLRP3抗体(CST,美国),MCC950(selleck,美国,NLRP3特异性抑制剂),MOG35-55(生工,中国,髓鞘少突胶质细胞糖蛋白肽段),完全弗氏佐剂(碧云天,中国),百日咳毒素(Sigma-Aldrich,美国),热灭活的结核分枝杆菌H37Ra(BD,美国),mouse Myelin basic protein抗体及β-actin抗体(Servicebio,中国),mouse IL-1β和mouse IL-17A ELISA试剂盒(Biolegend,美国),CD4及IL-17A流式抗体(Biolegend,美国)。
1.3方法
1.3.1 EAE的小鼠模型建立利用MOG35-55注射诱导AE小鼠模型,并利用小分子抑制剂MCC950特异性抑制NLRP3。将15只小鼠分为CON组、MOG组,MOG+MCC950组。每组5只。MOG组第1天皮下注射MOG35-55 100 μg(溶于100 μL完全弗氏佐剂和4 mg/mL的热灭活的结核分枝杆菌),第0天和第2天给予腹腔注射百日咳毒素(200 ng/只)。MOG+MCC950组在MOG组基础上给予MCC950 50 mg/kg(溶于100 μL玉米油),于第0、1、2天及此后每2天1次腹腔注射。CON组给予玉米油(100 μL)。3组第14天随机选取动物处死、取脑。
1.3.2组织学检查新鲜小鼠脑组织,经4%甲醛溶液固定(内固定)、石蜡包埋、切片、分别行anti-CD4和anti-NLRP3免疫组织化学染色。CD4染色及NLRP3染色评分,20 μm bar视野下,选取所在视野计数阳性细胞数,共选取5个不同视野。
1.3.3ELISA根据厂家说明书指示检测患者及对照者脑脊液中IL-1β、NLRP3及CCL2含量,小鼠脑组织IL-1β和IL-17A含量。
1.3.4Western blot将小鼠脑组织溶解在RIPA裂解液(上海碧云天生物技术有限公司)中,并补充蛋白酶抑制剂,冰上裂解30 min。在12 000×g下4 ℃离心,离心半径9.5 cm,15 min,然后收集上清液,并测定其中蛋白质浓度。在12% SDS-聚丙烯酰胺凝胶上将蛋白质转移到聚偏氟乙烯膜。用5%脱脂奶粉在20 ℃封闭膜2 h,然后加入兔抗MBP抗体(1∶1 000)和兔抗β-actin(1∶2000)(中国塞维尔生物公司)孵育过夜。在室温下用适当的HRP结合二级抗体(1∶5000,中国塞维尔生物公司)覆盖2 h。在增强化学发光检测系统(中国天能公司)中观察结果。
1.3.5流式细胞术眼球采血法获取小鼠外周血100 μL, 加入红细胞裂解液(中国碧云天生物技术有限公司),300 g离心,离心半径9.5 cm,5 min后,加入无菌PBS清洗后,再次300 g离心,离心半径9.5 cm,5 min,加入荧光标记抗小鼠CD4抗体、荧光标价抗小鼠IL-17A抗体,室温下避光孵育30 min后,加入2 mL无菌PBS,300 g离心5 min后去除上清,用无菌PBS重悬细胞,吹散后流式细胞术检测Th17(CD4+IL-17A+)细胞。

2 结 果
2.1 一般资料对照组中脑积水4例、脑外伤2例。抗NMDAR组中所有患者均表现出典型的抗NMDAR脑炎症状,MRI证实中枢神经系统炎症。抗NMDAR脑炎发病年龄呈现早发状态,平均年龄20岁。在脑脊液检查中,与对照组相比,抗NMDAR组患者脑脊液中白细胞、蛋白、糖和氯化物差异无统计学意义(P>0.05),提示脑脊液常规对AE的诊断辅助作用有限。见表1。

表 1 入组患者的基本临床特征
2.2抗NMDAR脑炎患者脑脊液中IL-1β及NLRP3含量变化与对照组比较,抗NMDAR组脑脊液中IL-1β含量显著增高[(5.93±1.26)pg/mLvs(16.31±6.28)pg/mL,P<0.01],NLRP3含量显著上升[(0.16±0.06)ng/mLvs(0.43±0.24) ng/mL,P<0.05]。见图1。

*P<0.05、**P<0.01
2.3NLRP3活性对EAE小鼠脑组织炎症的影响MOG35-55皮下注射诱发EAE 14 d后,MOG组小鼠脑组织中NLRP3+细胞较CON组明显增多[(21.00±4.85)/HPvs(6.80±1.92)/HP,P<0.001];同时CD4+T细胞亦显著增多[(73.40±11.70)/HPvs(15.60±6.02)/HP,P<0.001],表明脑组织炎症细胞浸润增加。
MOG+MCC950组小鼠脑组织中NLRP3+细胞较MOG组明显减少[(12.00±3.81)/HPvs( 21.00±4.85)/HP,P<0.05];同时CD4+T细胞亦显著减少[(29.00±8.12)/HPvs(73.40±11.70)/HP,P<0.001],表明脑组织炎症细胞浸润减少,脑组织炎症减轻。见图2。
2.4NLRP3活化抑制髓鞘蛋白表达并促进Th17免疫反应与CON组比较,MOG组小鼠脑组织中IL-1β显著上升(P<0.001),髓鞘基础蛋白(MBP)表达显著降低(P<0.01),而利用MCC950抑制NLRP3后,MOG+MCC950组MBP表达显著增加(P<0.05),表明NLRP3活性降低(P<0.001)。与CON组比较,MOG组小鼠脑组织中IL-17A含量显著增加(P<0.001),而在MOG造模小鼠基础上注射MCC950后,MOG+MCC950组小鼠脑组织中IL-17A含量显著降低(P<0.001),提示其Th17免疫反应降低。见图3。
2.5抑制NLRP3减少对小鼠体内Th17细胞的影响与CON组比较,MOG组小鼠外周血Th17细胞比例显著升高(P<0.01),而MOG+MCC950组外周血Th17细胞比例较MOG组显著降低(P<0.01),提示其Th17免疫反应降低。见图4。
2.6抗NMDAR脑炎患者脑脊液中CCL2含量的变化相较于外周血清,脑脊液中CCL2含量显著增高[(119.3±33.3)pg/mLvs(349.6±114.7)pg/mL,P<0.01]。见图5。
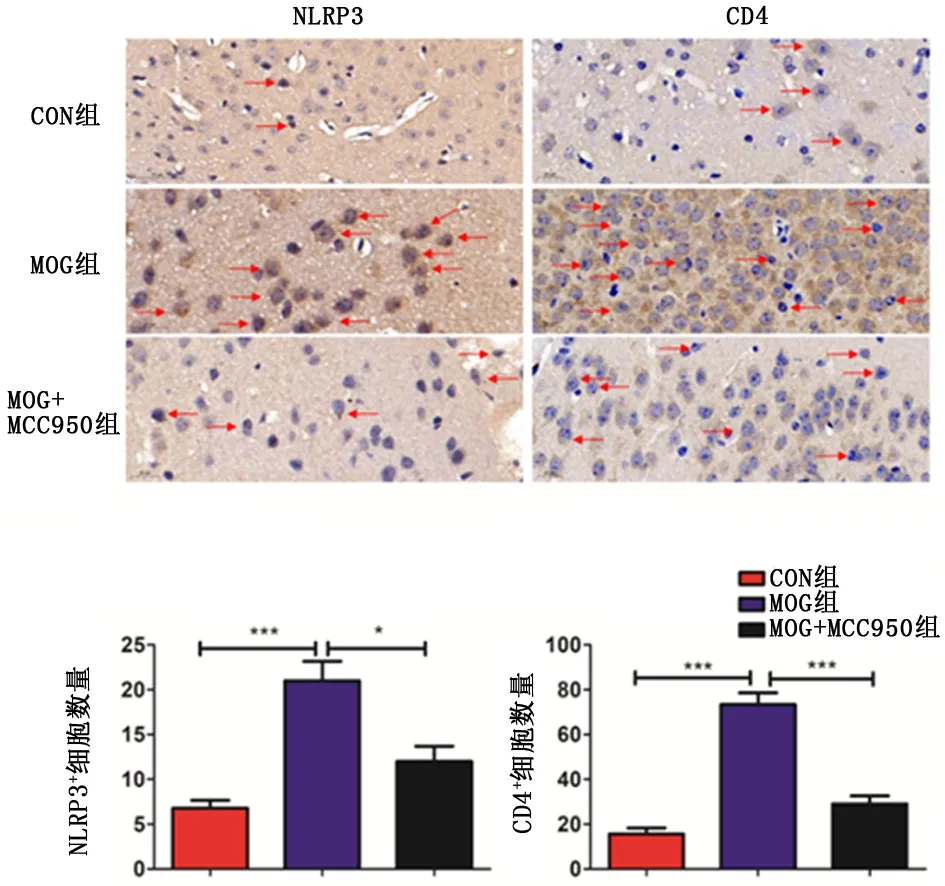
*P<0.05、***P<0.001

1:CON组; 2:MOG组; 3:MOG+MCC950组

*P<0.01
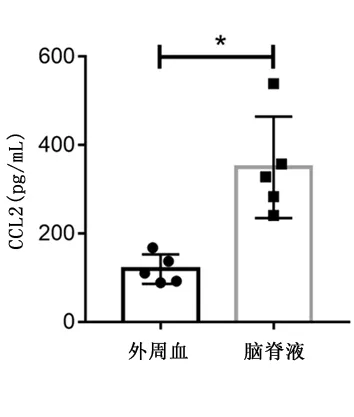
*P<0.01
3 讨 论
NLRP3在多种炎症性疾病中发挥重要作用[8-10]。在抗NMDAR脑炎患者的脑脊液中,本研究发现NLRP3和IL-1β含量显著增加,提示NLRP3炎症通路在自身免疫性脑炎,尤其是抗NMDAR脑炎中可能发挥重要作用。本研究还发现在MOG35-55诱导的EAE小鼠大脑中表达NLRP3,且伴随有CD4+细胞浸润增多,炎症因子IL-1β和IL-17A显著升高,外周血中Th17细胞比例增加,脑组织标本中髓鞘蛋白MBP显著降低,表明脑组织炎症反应和脱髓鞘病变增强。利用特异性的NLRP3抑制剂MCC950腹腔注射后,小鼠脑组织中NLRP3+细胞显著降低,伴随着CD4+T细胞的减少,炎症因子IL-1β和IL-17A显著降低,外周血中Th17细胞比例降低,脑组织标本中髓鞘蛋白MBP表达增加,脑组织炎症反应减轻。最后在抗NMDAR脑炎患者中发现脑脊液中趋化因子CCL2含量相对于外周血显著升高。上述结果表明,NLRP3激活导致Th17免疫反应增强增高,促进脑组织炎症细胞浸润和脱髓鞘病变,从而导致大脑炎症及相关神经系统症状,比如小鼠尾部无力等。鉴于炎症小体在狼疮、地中海热及家族性高IgD血症等多种自身免疫性疾病中的重要作用[11- 12],本研究为自身免疫性脑炎的机制研究提供了一定的实验室基础。
多项研究NLRP3促炎活性及其生物学作用的文章聚焦于其催化释放的炎症因子,尤其是IL-1β[13-14]。本研究在脑炎患者和EAE模型小鼠均发现神经系统中IL-1β显著升高。IL-1β更被认为是NLRP3信号通路的主要活性因子,其主要通过促进CCR2+单核细胞浸润中枢神经系统并通过中枢神经系统内皮细胞释放的GM-脑脊液促进炎症细胞的生成,从而导致炎症细胞如T细胞的脑组织浸润。近期研究发现,在EAE中不仅中枢神经系统内皮细胞表达IL-1R1,CD4+T细胞对IL-1β的炎性信号也具有反应,导致Th17细胞表达大量的IL-1R1,而其他Th细胞表达的IL-1R1水平极低[7, 11-12]。Th17细胞分化依赖于JAK-STAT3通路,前期研究发现,NLRP3可激活JAK2-STAT3通路促进脑缺血引起的中枢神经系统炎症,此通路是否介导自免脑中Th17细胞分化尚不清楚[15]。本研究结果表明,通过抑制NLRP3,脑组织中IL-17A含量和CD4+T细胞的浸润水平降低显著相关,外周血中Th17细胞减少,提示NLRP3可能通过激活JAK-STAT3通路促进Th17细胞分化,具体机制需要进一步研究。
Th17免疫反应一般认为是导致神经元坏死和自身免疫性炎症反应的主要因素[16-17]。除此之外,近期研究发现自身免疫性疾病,如强直性脊柱炎中,3型固有淋巴样细胞(ILC3)也产生IL-17导致自身免疫性炎症,这些IL-17通过促进T细胞的存活维持神经系统炎症的发展[18-19]。本研究发现抑制NLRP3可降低IL-17A的水平并抑制Th17细胞的分化,并且可使MBP表达增加,表明其可相应抑制Th17免疫反应,从而缓解脱髓鞘病变并在一定程度上恢复髓鞘蛋白的表达。在许多疾病中都观察到了IL-17的表达增加,如炎症性肠病,哮喘等[20-21]。IL-17能够下调紧密连接的分子,促进白细胞穿过血脑屏障的运动[19]。Th17细胞的增加与疾病进展有关,免疫抑制治疗显著减少了Th17细胞的数量[22]。近期研究发现,IL-17通过促进细胞焦亡,导致炎症风暴[23]。研究进一步发现,Th17免疫反应同时介导了神经系统炎症及脱髓鞘病变,而通过抑制表达IL-17A的细胞,包括传统的Th17细胞,以及可能同时抑制表达IL-17A的ILC3,可更高效抑制IL-17A相关炎症。根据本研究结果,我们猜测IL-17A和ILC3可能同时介导了神经系统炎症反应和脱髓鞘病变。至于NLRP3对于神经系统中ILC3的调控及其炎症因子的释放需要进一步的探究。
Th17细胞的趋化性是探索其在抗NMDAR脑炎中的重要靶点。研究发现,CCL2/CCR2在神经系统退行性疾病中发挥重要作用,如多发性硬化和阿尔兹海默病,但在自身免疫性脑炎中CCL2的表达及作用尚不十分清楚[24]。本研究发现CCL2在来自抗NMDAR患者的脑脊液中相对于外周血显著增加,提示CCL2可能通过直接或间接作用促进炎症细胞浸入中枢神经系统。研究发现,单核细胞通过CCR2-CCL2依赖的方式促进单核细胞或巨噬细胞迁移浸入神经系统,而单核细胞或巨噬细胞通过促进初始T细胞向辅助性T细胞分化,比如Th17细胞[25-26]。更有研究发现,淋巴细胞可直接表达CCR2,且可通过CCL2依赖的方式穿透内皮屏障[27-28]。因此推测,脑炎患者中高浓度的CCL2可能通过直接趋化淋巴细胞,并以NLRP3依赖的方式促进其分化为Th17细胞,或直接促进外周血中的Th17细胞穿透血脑屏障浸入中枢,进而刺激B细胞产生抗体攻击自身,产生脱髓鞘和脑部神经系统炎症。
总之,本研究发现抗NMDAR脑炎患者脑脊液中NLRP3有升高趋势及IL-1β含量显著升高;利用MCC950抑制NLRP3显著减少脑组织中CD4+T细胞的浸润进而减轻脑组织炎症,为NLRP3抑制剂MCC950治疗自身免疫性脑炎提供了有力的依据。

