典型抗抑郁药对人乳腺癌SKBR3/MCF-7细胞的生物学效应
赵浩然, 彭 玮, 雷炳莉, 许澜冰, 于蒙杰
(上海大学环境与化学工程学院环境污染与健康研究所, 上海 200444)
抗抑郁药类化合物属于药物和个人护理品(pharmaceuticals and personal care products,PPCPs) 中的一类. 临床中应用的抗抑郁类药物按作用机制主要分为单胺氧化酶抑制剂(monoamine oxidase inhibitor, MAOI)、选择性血清素再摄取抑制剂(selective serotonin reuptake inhibitor, SSRI)、三环类抗抑郁药(tricyclic antidepressant, TCA)、血清素和去甲肾上腺素再摄取抑制剂(serotonin and norepinephrine reuptake inhibitor, SNRI)、选择性血清素和去甲肾上腺素再摄取抑制剂(selective serotonin and noradrenaline reuptake inhibitor,SSNRI) 及选择性5-羟色胺(5-hydroxytryptamine, 5-HT) 等. 目前, 全世界抑郁症的发病率逐渐上升. 2016 年世界卫生组织报告显示, 2015 年全球大概3 亿人患有严重的抑郁症状, 约占世界人口的4.3%, 其中中国约有5 400 万患者[1].
随着抗抑郁药在日常生活中的广泛使用, 大量药物通过丢弃或排泄等途径进入环境中.由于这些药物具有水中较难去除、富集性较强等特点, 在环境介质中的浓度越来越高. 水环境中抗抑郁药的主要来源为城市污废水. Kleywegt 等[2]对加拿大的污水处理厂进行检测,发现废水中含有大量抗抑郁药物, 其中氟西汀、阿米替林、文拉法辛的最高质量浓度分别为138、73 和366 ng/L. Xiang 等[3]检测了上海3 家精神病医院的废水中15 种精神类药物的浓度, 发现阿米替林的质量浓度达83.57 ng/L. 2017 年美国环境保护署调查了25 家饮用水处理厂, 在第一阶段水源中检测到多种抗抑郁药残留, 其中氟西汀、诺氟西汀、文拉法辛的质量浓度分别为0.50、0.56、0.58 ng/L, 而在第二阶段水源中阿米替林的质量浓度为4.0 ng/L[4-6]. Giebultowicz 等[7]在检测报告中指出, 波兰自来水中米安色林的质量浓度为0.9 ng/L. Jaqueline 等[8]对医院废水中6 种抗精神病药物进行定量分析, 发现氯氮平、氯丙嗪和利培酮的环境风险系数均大于600, 这表明需要更好地控制抗精神病药物的排放. 由于许多污水处理厂未能有效降低水中抗抑郁药的浓度, 使得抗抑郁类药物在河流和海洋等非城市水体中普遍存在[9]. 水体中的抗抑郁药不仅会在沉积物中累积, 而且会通过富集作用进入水生生物体中[10-11]. 目前, 在不同的鱼类组织如肌肉、肝脏、大脑和血液中检测到了抗抑郁药存在[12-13]. 此外, Arnnok 等[14]在美国西部的尼亚加拉河水样和收集的鱼体中检测到了抗抑郁药的存在. 抗抑郁药具有内分泌干扰效应, 可对生物体的生殖和发育产生影响. Bertram等[15]对澳大利亚东部的食蚊鱼进行30 d 的氟西汀暴露(暴露质量浓度分别为400 和40 ng/L)后发现, 雄性鱼的交配行为和精子数量都有所增加, 但精子质量没有提高. 雷湘杰[16]发现阿米替林在mg/L 级别会显著提高斑马鱼幼胚/幼体的死亡率和畸形率, 在µg/L 或ng/L 级别会显著加快其胚胎的孵育速度, 对斑马鱼的心率也有显著影响. 抗抑郁药暴露还会对生物体的行为产生影响, Thor´e 等[17]发现抗抑郁药的暴露降低了短寿鳉鱼的体型, 增加了其交配频率, 并改变了其社会行为. Lepage 等[18]研究发现虹鳟鱼在100 µg/kg 的西普肽兰中暴露7 d 会显著减少对入侵者的攻击频率. Mcdonald 等[19]发现长期受到氟西汀暴露的蟾鱼会提高自身的攻击行为. 抗抑郁药具有神经毒性, 例如: 氟西汀和帕罗西汀能影响斑马鱼脑组织神经突触结构, 干扰脑组织神经传导系统的正常生理功能, 危害斑马鱼健康[20]; 米安色林可通过下丘脑-垂体-性腺轴干扰斑马鱼的内分泌系统, 改变斑马鱼体内卵黄蛋白原的表达[21]; 低浓度氟西汀短期暴露后可诱导贻贝体内的乙酰胆碱酯酶活性, 从而引起贻贝的神经毒性反应[22]. 此外, 氟西汀还可诱发底栖生物体内的氧化应激反应, 干扰雌激素的正常分泌, 从而影响生物的生理活动[23]. 由于环境中存在的抗抑郁类化合物可通过不同途径对人体产生非靶标暴露, 对人体存在潜在的健康危害, 因此深入分析抗抑郁药对机体的综合毒性效应, 对准确评估其潜在健康危害具有重要的意义.
部分抗抑郁药类化合物可能具有雌激素效应, 而雌激素敏感型细胞如乳腺癌细胞, 是评估污染物雌激素效应的理想细胞模型. 本工作以人乳腺癌细胞SKBR3 和MCF-7 为细胞模型,探讨氟西汀、阿米替林、多虑平和米安色林4 种常见抗抑郁药物对细胞的增殖、细胞内活性氧(reactive oxygen species, ROS) 水平、胞内Ca2+浓度以及DNA 损伤等效应终点的影响, 综合分析常见抗抑郁药物对乳腺癌细胞SKBR3 和MCF-7 的生物学效应, 并探讨抗抑郁药对2种细胞产生的生物学效应差异, 为深入开展该类化合物的危害效应评价提供实验数据.
1 材料与方法
1.1 主要试剂及材料
盐酸氟西汀粉末(纯度98%)、盐酸阿米替林粉末(纯度97%)、盐酸米安色林粉末(纯度99%)、盐酸多虑平粉末(纯度97%)、二甲基亚砜(dimethyl sulfoxide, DMSO)、荧光染料2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodihydro fuorescein diacetale, DCFH-DA) 和噻唑蓝(thiazolyl blue tetrazolium bromide, MTT) 均购自美国Sigma-Aldrich 公司. 图1 为4种目标物的结构式.
图1 4 种目标化合物的结构式Fig.1 Structural formulas of four target compounds
人乳腺癌细胞SKBR3 和MCF-7 购自南京科佰生物科技有限公司; Fluo-3/AM 荧光染购自日本Dojindo 公司; 培养基RPMI-1640 和胎牛血清(fetal bovine serum, FBS) 购自美国Hyclone 公司.
1.2 MTT 法检测细胞活力
将对数生长期的SKBR3/MCF-7 细胞通过无酚红的RMPI-1640 培养基制成单个细胞悬浮液, 再以每孔103∼104个细胞数接种于96 孔培养板上, 每孔体积为100 µL, 并在37◦C体积分数为5% 的CO2的培养箱中培养12∼24 h. 贴壁后, 实验组分别加入浓度为0.001∼50 µmol/L 的抗抑郁药, 设置6 个平行样, 暴露24 h, 体积分数为0.1% 的DMSO 作为阴性对照. 暴露结束后, 每孔加入100 µL MTT 溶液, 继续孵育4 h, 弃上清液, 然后加入150 µL DMSO, 在CO2孵箱中放置10 min. 用酶标仪在490 nm 波长下测定各孔的光密度(optical density, OD), 并计算细胞活力.
1.3 细胞内ROS 检测
取对数生长期的SKBR3/MCF-7 细胞消化后, 用无酚红的RMPI-1640 培养基制成单个细胞悬浮液, 再以每孔约1.5×105个细胞接种于6 孔培养板上, 体积为1 mL. 在CO2孵箱中培养12∼24 h. 贴壁后, 实验组分别加入浓度为0.001∼50 µmol/L 的抗抑郁药, 体积分数为0.1% 的DMSO 作为阴性对照, 暴露时间分别为3 和24 h, 设置3 个平行样. 暴露结束后, 加入DCFH-DA 探针(用无酚红无血清的培养基稀释2 100 倍), 继续孵育30 min, 再用D-Hanks清洗3 遍, 除去未被氧化的DCFH (避光操作) . 荧光显微镜拍照, 并用Ipwin32 图像分析软件处理照片, 获得平均荧光强度.
1.4 细胞内Ca2+ 浓度检测
将对数生长期SKBR3/MCF-7 细胞接种于细胞培养小皿中, 每个孔细胞数约为1.5×105个, 体积为1 mL. 置于37◦C 体积分数为5% 的CO2培养箱中继续培养24 h. 在培养结束后,实验组分别加入浓度为0.001∼50 µmol/L 的抗抑郁药, 体积分数为0.1% 的DMSO 作为阴性对照, 暴露时间分别为1、3 和24 h, 设置3 个平行样. 暴露结束后, 加入Fluo-3/AM 工作液(一个玻片500 µL), 在37◦C 继续孵育40 min, 除去Fluo-3/AM 工作液, 再用D-Hanks 清洗3 遍, 保留一定量的D-Hanks 溶液覆盖细胞. 37◦C 孵育20 min (避光操作), 在激发波长为494 nm、发射波长为516 nm 处, 用荧光显微镜拍照, 照片用Ipwin32 图像分析软件处理, 获得平均荧光强度.
1.5 单细胞凝胶电泳实验
取对数生长期的SKBR3 细胞, 以2×105个/孔接种于24 孔细胞培养板上, 待细胞贴壁后进行抗抑郁药暴露处理, 浓度为0.001∼10 µmol/L, 体积分数为0.1% 的DMSO 作为阴性对照. 暴露结束后, 收取细胞, 并用单细胞凝胶电泳法检测细胞的DNA 损伤[25]. 取出制好的载玻片, 4◦C 保存过夜, 每片载玻片上加50 µL 核酸染料碘化丙啶(propidium iodide, PI) 溶液,拍照, 每个平行样随机拍摄约100 个细胞图像. 使用CASP 图像分析软件进行分析, 获得拖尾的定量数据. 采用尾部DNA 含量(Tail DNA%) 作为定量衡量彗星拖尾程度的指标, 并取中位值进行统计分析.
2 结果与讨论
2.1 对SKBR3 细胞的生物学效应
2.1.1 对SKBR3 细胞活性的影响
采用MTT 比色法检测氟西汀、阿米替林、米安色林和多虑平4 种抗抑郁药对SKBR3 细胞增殖的影响, 结果如图2 所示. 可以发现: 暴露24 h 后低浓度氟西汀(0.001∼10 µmol/L)可明显地促进SKBR3 细胞的增殖, 当氟西汀的浓度高于10 µmol/L 时, 细胞的存活率逐渐下降, 且浓度越大, 细胞的存活率越低; 阿米替林和米安色林在低浓度暴露24 h 后对SKBR3 细胞活性没有显著的影响, 而当浓度高于10 µmol/L 时同样对细胞的活性产生显著的抑制作用;多虑平在整个暴露浓度均对细胞的活性均没有显著的影响.
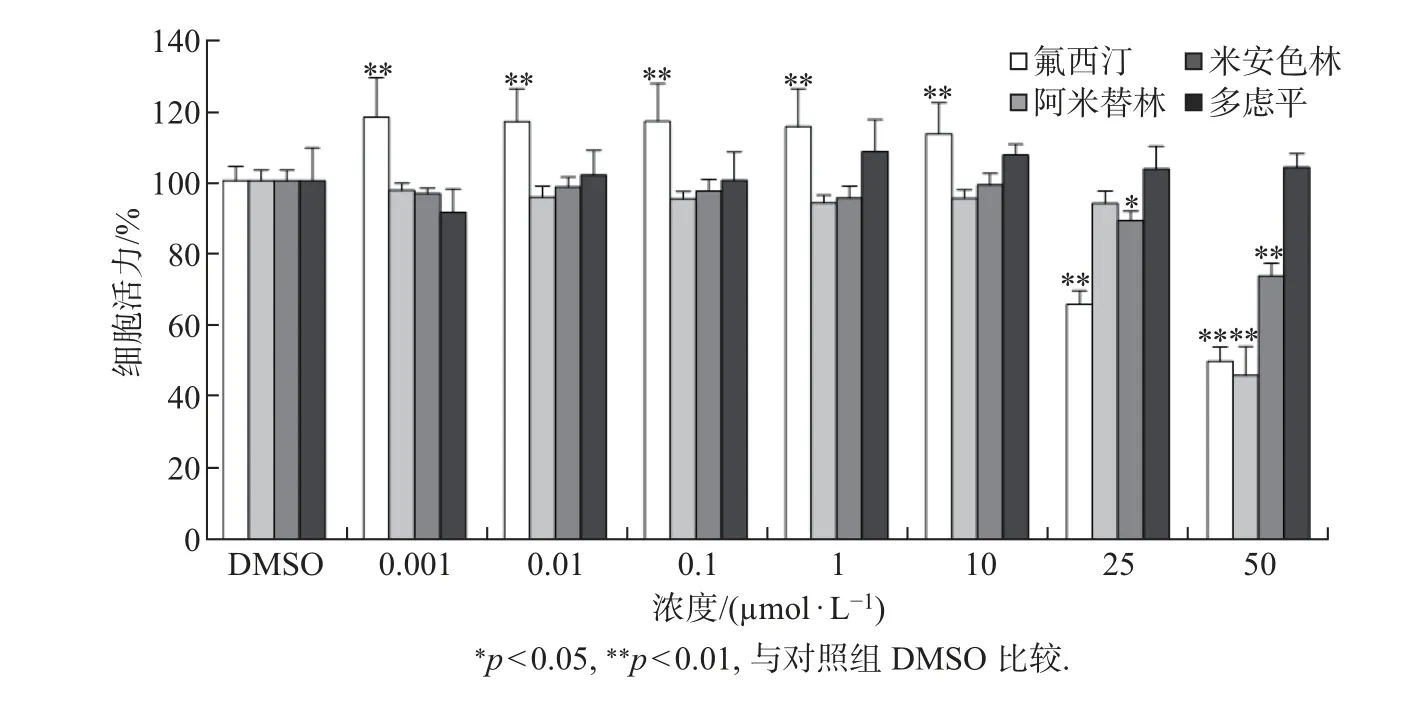
图2 4 种抗抑郁药暴露24 h 对SKBR3 细胞活性的影响Fig.2 Effects of four antidepressants on the viability SKBR3 cells after exposure 24 h
2.1.2 对SKBR3 细胞内ROS 水平的影响
采用DCFH-DA 探针法检测抗抑郁药对SKBR3 细胞内ROS 水平的影响, 暴露时间分别为3 和24 h, 结果如图3 所示. 可以看出: 氟西汀暴露3 h 时, 仅在最高浓度50 µmol/L 时显著地增加了细胞内ROS 水平, 而在24 h 时所有暴露浓度下细胞内的ROS 水平均显著增加;阿米替林与氟西汀类似, 在暴露3 h 时仅在较高浓度1∼50 µmol/L 显著增加了细胞内ROS水平, 而暴露24 h 时细胞内ROS 水平在所有暴露浓度下均显著增加; 米安色林暴露3 和24 h时, 细胞内ROS 水平仅在较高的暴露浓度下显著增加. 多虑平暴露3 h 时, 细胞内ROS 水平在所有的暴露浓度下均显著增加, 而暴露24 h 时所有测试浓度对细胞内的ROS 水平均没有显著影响.

图3 4 种抗抑郁药对SKBR3 细胞内ROS 水平的影响Fig.3 Effects of four antidepressants on intracellular ROS level in SKBR3 cells after exposure for 3 and 24 h
2.1.3 对SKBR3 细胞内Ca2+浓度的影响
利用特异性的钙离子荧光染料Fluo-3/AM 标记SKBR3 细胞, 并用荧光强度反映Ca2+浓度水平. 图4 为浓度0.001∼50 µmol/L 的4 种抗抑郁药分别处理细胞24 h 后SKBR3 细胞内的Ca2+浓度的变化. 可以发现, 在抗抑郁药浓度大于10 µmol/L 时, 细胞内Ca2+水平均显著升高. 为了进一步探究暴露时间对细胞内Ca2+水平的影响, 选取4 种抗抑郁药均有明显效应的浓度25 µmol/L, 分别暴露1、3 和24 h, 结果如图5 所示. 可以看出, 在暴露1 和3 h时, 4 种抗抑郁药对细胞内Ca2+水平基本没有影响, 而延长暴露时间为24 h 时细胞内Ca2+浓度显著增加.
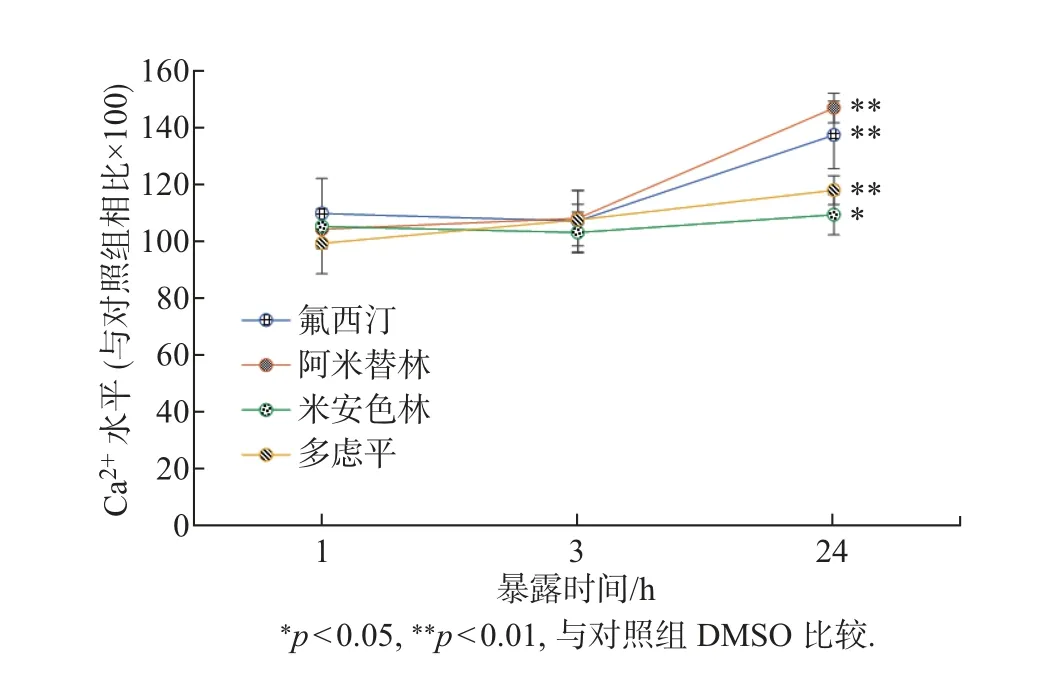
图5 4 种抗抑郁药(25 µmol/L) 在不同的暴露时间对SKBR3 细胞内Ca2+ 浓度的影响Fig.5 Effects of four antidepressants (25 µmol/L) at different exposure durations on intracellular Ca2+ levels in SKBR3 cells
2.1.4 氟西汀对SKBR3 细胞DNA 损伤的影响
根据细胞活性的实验结果, 氟西汀浓度大于10 µmol/L 时会对细胞产生严重的毒性作用,不适合做DNA 损伤实验. 因此, 在彗星实验中氟西汀的浓度设置为0.001∼10 µmol/L. 用不同浓度的氟西汀处理SKBR3 细胞24 h 后, 采用单细胞凝胶电泳对细胞内DNA 损伤进行检测, 结果以中位值表示(见图6). 发现在0.1 和1 µmol/L 时, 细胞尾部DNA 含量分别是DMSO 组的1.4 和1.5 倍, 说明氟西汀可能会引起细胞的DNA 损伤.
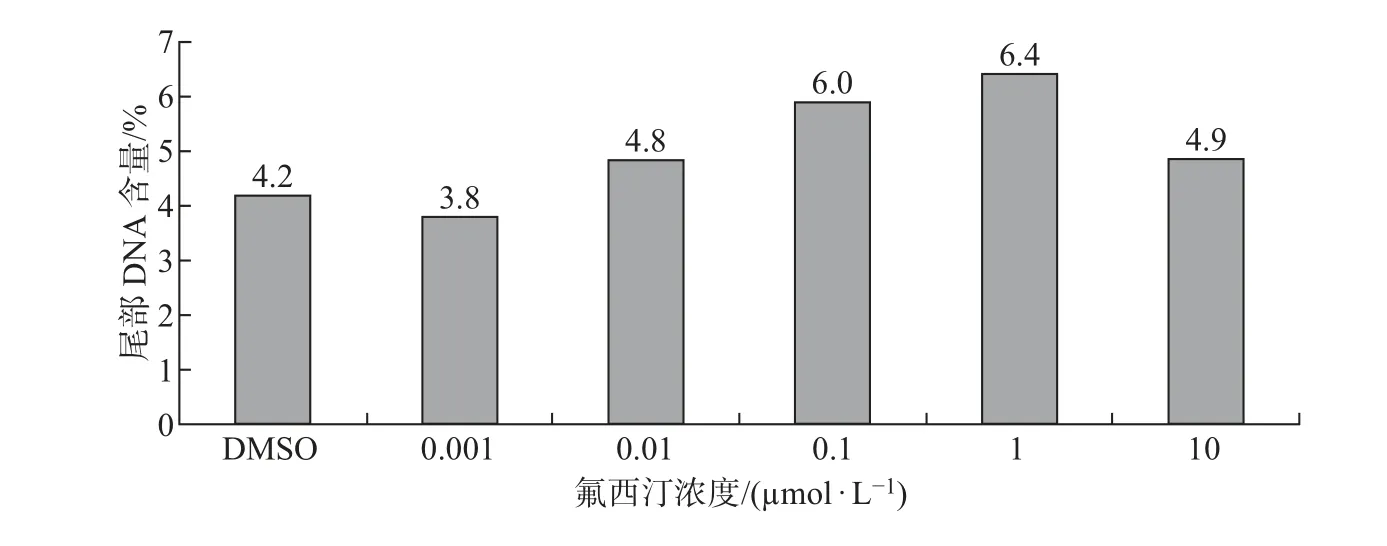
图6 氟西汀暴露24 h 对SKBR3 细胞的DNA 损伤的影响Fig.6 Effects of fluoxetine on DNA damage in SKBR3 cells after 24 h exposure
2.2 氟西汀和阿米替林对MCF-7 细胞生物学效应的影响
研究发现, 在人乳腺癌SKBR3 细胞中雌激素核受体α (estrogen receptor α, ERα) 呈阴性表达, 而雌激素膜受体(G protein-coupled receptor 30, GPR30) 是阳性表达. 氟西汀和阿米替林是常用的抗抑郁药类化合物, 已探讨了抗抑郁药对SKBR3 细胞(GPR30+ 和ERα-) 生物学效应的影响. 作为对比研究, 选择人乳腺癌MCF-7 细胞(GPR30+ 和ERα+) 作受试细胞, 研究氟西汀和阿米替林对MCF-7 细胞的生物学效应. 采用不同浓度的氟西汀和阿米替林处理MCF-7 细胞24 h, 检测这2 种抗抑郁药对细胞活力、细胞内ROS 和Ca2+水平的影响,结果如图7 所示. 可以发现: 低浓度(0.001∼1 µmol/L) 下氟西汀显著地促进了MCF-7 细胞的增殖, 而高于10 µmol/L 时则抑制了细胞活性; 低浓度阿米替林对MCF-7 细胞活力没有影响, 但是高于10 µmol/L 时明显抑制细胞活性. 这2 种抗抑郁药对MCF-7 细胞活力的影响与对SKBR3 细胞活力影响类似, 但在相同的暴露条件下, MCF-7 细胞增殖更明显. 氟西汀和阿米替林在暴露24 h 后仅在2 个较高的浓度时对MCF-7 细胞内ROS 水平产生了显著的诱导效应, 这与氟西汀和阿米替林在暴露24 h 后在所有的暴露浓度均对SKBR3 细胞内ROS 水平产生显著诱导作用的结果是不同的. Ca2+的测定表明, 氟西汀和阿米替林在低浓度时对细胞内Ca2+水平影响不大, 而在浓度大于10 µmol/L 时能显著提高细胞内游离钙离子水平, 这与氟西汀和阿米替林对SKBR3 细胞内Ca2+浓度的影响类似.
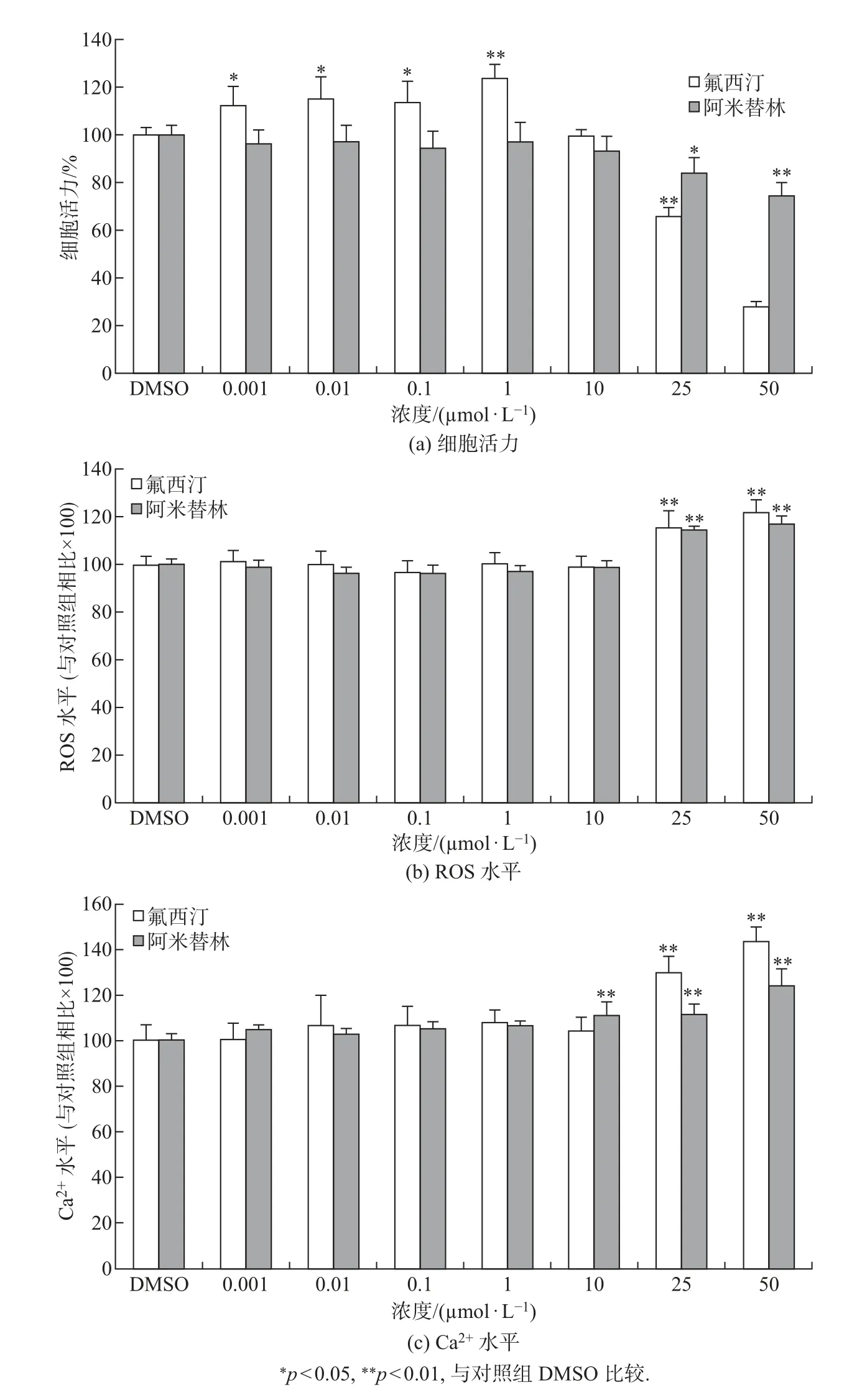
图7 氟西汀和阿米替林暴露24 h 后对MCF-7 细胞的影响Fig.7 Effects of fluoxetine and amitriptyline in MCF-7 cells after 24 h exposure
3 讨 论
雌激素敏感型肿瘤细胞的增殖是衡量环境污染物雌激素效应的常用方法. 环境雌激素在生殖系统方面的癌症如乳腺癌和卵巢癌等的发生发展中起着重要的作用. M¨uller 等[26]利用小鼠和MCF-7 细胞实验发现氟西汀具有雌激素活性. 双酚A (bisphenol A, BPA) 和BPA 的潜在替代物4,4’-二羟基二苯硫醚(4,4’-Thiobisphenol, TDP) 在低浓度时会通过雌激素受体途径促进乳腺癌细胞的增殖[27]. 氟西汀促进了雌激素敏感型肿瘤细胞SKBR3 和MCF-7 细胞的增殖, 表明氟西汀可能类似于BPA 和TDP 具有雌激素活性, 并且促进SKBR3 和MCF-7 细胞增殖的机制可能与雌激素受体激活有关.
正常情况下细胞内ROS 的产生和清除处于动态平衡, 对机体并无明显影响[28]. ROS 在维持细胞正常生长中起到重要作用, 当其含量升高或降低时, 可以改变细胞增殖、凋亡和分化所对应目的基因的表达[29]], 从而影响细胞的生长. 雌激素可通过雌激素受体依赖性途径增加线粒体ROS 的产生, 从而导致细胞的增殖. 在雌激素诱导的细胞增殖期间, 氧化还原系统尤为重要, 同时这一时期也是细胞代谢和ROS 增加的时期[33]. 低浓度氟西汀可同时诱导SKBR3细胞的增殖和细胞内ROS 的生成. 低浓度雌激素类化合物双酚AF(bisphenol AF, BPAF) 和双酚F (bisphenol F, BPF) 可同时诱导乳腺癌细胞产生ROS 和细胞增殖[34], 而加入ROS 清除剂NAC(N-acetyl-L-cysteine) 后, 乳腺癌细胞的增殖受到抑制[25], 说明细胞内ROS 的增加对细胞增殖起促进作用. 此外, Liu 等[35]发现ROS 适度增加可刺激细胞增殖. 雌激素诱导的巨噬细胞和MCF-7 细胞的增殖部分是通过ROS 介导的[36]. 但对MCF-7 细胞, 低浓度氟西汀诱导了MCF-7 细胞的增殖, 却没能诱导细胞内ROS 的升高; 阿米替林、米安色林和多虑平在低浓度不同时间段引起了SKBR3 细胞内ROS 的增加, 而对细胞的增殖却没有促进作用.因此, 推测这种现象的产生可能与受试细胞种类、测试化合物理化性质、测试化合物的浓度设置和暴露时间等存在关系, 但具体原因仍需进一步研究.
在较高浓度时, 抗抑郁类化合物抑制了SKBR3 和MCF-7 细胞的增殖, 并且促进细胞内ROS 的升高, 这可能是由于细胞内ROS 浓度过高产生了细胞毒性. BPAF 和BPF 在较高浓度时抑制乳腺癌细胞MCF-7 的增殖, 增加了细胞内ROS 和Ca2+水平. 抗抑郁药帕罗西汀可通过细胞外Ca2+和p38 MAPK 依赖性ROS 的产生诱导人乳腺癌MCF-7 细胞凋亡[38]. 抗抑郁药在较高浓度时会诱导乳腺癌细胞内Ca2+水平的升高. Ca2+是细胞内的一种重要信号分子. 在细胞受到刺激后, 胞浆内的Ca2+浓度会升高, 并引起细胞内的其他生物学效应,如促进细胞增殖、诱导分化等. 但是, 如果Ca2+浓度超过10−5mol/L, 则细胞会受到损伤.SKBR3 和MCF-7 细胞暴露于抗抑郁药24 h 的情况下, 当抗抑郁药的浓度大于10 µmol/L,细胞内Ca2+浓度显著增高, 而在细胞活性实验中, 高浓度的抗抑郁药(大于10 µmol/L) 会抑制细胞生长,故推测细胞增长受抑制可能与细胞内Ca2+浓度过高有关. Kang 等[39]发现SSRI类抗抑郁药帕罗西汀在浓度为10∼30 µmol/L 时会抑制细胞增殖, 提高细胞内Ca2+浓度,而且还能通过激活caspase-8,9 和DNA 修复酶聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase, PARP) 提高Bax/Bcl-2 蛋白凋亡比率. 另外, 较低浓度下4 种抗抑郁药可诱导SKBR3 细胞内ROS 水平显著升高, 但对SKBR3 细胞内Ca2+水平影响不显著; 但当浓度大于1 µmol/L 时, 它们诱导SKBR3 细胞内Ca2+水平显著升高. 但对MCF-7 细胞来说, 仅仅在较高浓度下, 氟西汀和阿米替林才能诱导MCF-7 细胞内ROS 和Ca2+水平的升高, 说明SKBR3 细胞对抗抑郁药的毒性作用更敏感.
细胞受到外界因素刺激时会发生DNA 分子的损伤或改变, 如果这些损伤或改变不能及时更正, 则细胞功能或生存将会受到影响. DNA 损伤可以通过修复酶进行修复, 但不能修复的DNA 损伤在DNA 复制过程中会引起错误编码而导致突变[40]. Takako 等[42]指出BPA 作为类雌激素可通过雌激素受体途径诱导细胞DNA 损伤. Pearl 等[43]发现氟西汀暴露会引起涡虫的DNA 损伤, 并导致涡虫的摄食和分裂减少. BPAF 在较低浓度(小于1 µmol/L) 时能对MCF-7 细胞的DNA 产生一定的损伤, 并能促进细胞的增殖[25]. 同样的, 氟西汀在较低浓度(0.1 和1 µmol/L) 时对SKBR3 细胞的DNA 损伤有促进作用, 并在促进细胞的增殖, 这暗示氟西汀可通过雌激素受体途径产生遗传毒性效应.
4 结 论
(1) 4 种抗抑郁药中仅氟西汀在低浓度促进了SKBR3 和MCF-7 细胞增殖, 但在较高浓度时, 4 种抗抑郁药均对细胞活性产生了抑制作用; 多虑平在所有的暴露浓度时均对SKBR3细胞增殖没有影响.
(2) 较低浓度下4 种抗抑郁药可诱导SKBR3 细胞内ROS 水平显著升高, 但对SKBR3 细胞内Ca2+水平影响不显著; 但当抗抑郁药的浓度大于1 µmol/L 时, 它们诱导SKBR3 细胞内Ca2+水平显著升高. 但对MCF-7 细胞来说, 氟西汀和阿米替林仅在较高浓度下才能诱导MCF-7 细胞内ROS 和Ca2+水平的升高, 说明SKBR3 细胞对抗抑郁药的毒性作用更敏感.
(3) 氟西汀在0.1 和1 µmol/L 时可诱导的SKBR3 细胞尾部DNA 含量升高, 且分别为DMSO 组的1.4 倍和1.5 倍, 说明氟西汀可能对细胞内DNA 有损伤作用, 暗示其遗传毒性效应.

