非编码RNA 调控肝癌的研究进展
杨芊芊, 田 慧, 王广志, 马中良
(1. 上海大学生命科学学院非编码RNA 与癌症实验室, 上海 200444;2. 复旦大学附属中山医院, 上海 200032;3. 潍坊医学院附属医院, 山东潍坊 261053)
肝癌是一种致命的恶性肿瘤,根据肿瘤权威期刊A Cancer Journal for Clinicians: Cancer Statistic 的最新报道, 肝癌的发病率男性居第五位, 女性居第七位, 而在我国高居恶性肿瘤发病率的第二位, 因此人们面临肝癌问题形势严峻[1]. 肝癌分为原发性肝癌和转移性肝癌,而在原发性肝癌中最常见的是肝细胞癌(hepatocellular carcinoma, HCC), 占原发性肝癌的75%∼85%. 肝癌的发病率高、转移性强、预后较差, 并且大多数肝癌被诊断出时已是晚期, 因此手术切除和肝移植不是实际的治疗选择[2], 需要进一步寻找治疗肝癌的更好办法.
肿瘤与肿瘤微环境(tumor microenvironment, TME) 的相互作用在肿瘤发生和发展中起着关键作用[3]. TME 是指肿瘤细胞周围的微环境, 在肿瘤发展过程中, 组织中的生理氧或常氧浓度受到阻碍, 导致TME 中的氧浓度低, 称为缺氧[4]. 缺氧是TME 的典型特征, 也是癌症的标志, 它通过影响细胞增殖、周期、代谢、血管生成、耐药性或侵袭、迁移和转移等途径, 在致瘤性中发挥关键作用[5-8].
非编码RNA (non-coding RNA, ncRNA) 是一类不编码蛋白质但具有重要调控功能的RNA 分子. ncRNA 包括microRNA (miRNA)、长链非编码RNA (long non-coding RNA,lncRNA) 和环状RNA (circular RNA, circRNA) 等. miRNA 是一类独特的小ncRNA, 在基因表达的转录后调控中发挥着至关重要的作用[9]. lncRNA 是一类长度超过200 个核苷酸且缺乏编码蛋白质能力的RNA[10], 其异常表达与癌症的发生、发展和预后密切相关[10-11].circRNA 是一类高度保守、稳定和丰富的ncRNA, 可在转录或转录后水平调节基因表达[12].研究表明, ncRNA 在多种癌症中异常表达, 与肿瘤发生和转移密切相关, 因此被认为是癌症的新型生物标志物和治疗靶点(见图1).
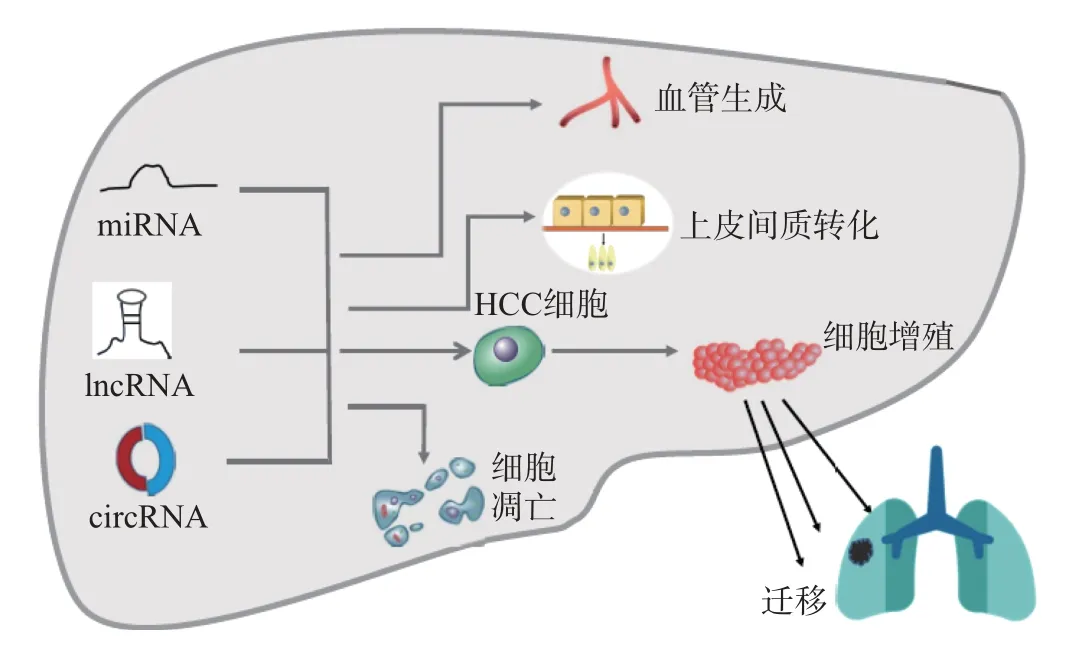
图1 ncRNA 对HCC 发生发展的调控Fig.1 Regulation of HCC development by ncRNA
1 缺氧TME 与HCC
1.1 缺氧诱导因子(hypoxia-inducible factor, HIF) 与HCC
2019 年诺贝尔生理学或医学奖授予威廉· 凯林(William G. Kaelin)、彼得· 拉特克利夫(Peter J. Ratcliffe) 和格雷格· 塞门扎(Gregg L. Semenza), 表彰他们在低氧感应方面做出的贡献[13]. HIF-1 转录因子激活是TME 中广泛研究的途径之一, HIF-1 有2 个亚基: 氧敏感的α-亚基(HIF-1α) 和组成型表达的β-亚基(HIF-1β)[14]. 研究发现, HIF-1α 普遍参与了肝癌的发生发展. Zheng 等[15]发现HIF-1α 过表达与较差的总生存期(overall survival, OS) 和无病生存期(disease-free survival, DFS) 有关. HIF-1α 主要参与促进肿瘤增殖、迁移、侵袭和血管形成, 以及上皮间质转化(epithelial to mesenchymal transition, EMT)、糖酵解调节和脂质代谢等途径, 涉及各种信号通路(见表1).

表1 HIF-1α 在HCC 中的作用及潜在机制Table 1 Role of HIF-1α in HCC and potential mechanisms
HIF-1α 通过白细胞介素-8(interleukin-8, IL-8)/核转录因子-κB (nuclear factor kappa B,NF-κB) 促进肝癌细胞的迁移和侵袭. 此外, HIF-1α 激活的TM4SF1-AS1 通过增强TM4SF1表达在促进肝癌细胞的增殖、迁移和侵袭中起重要作用. HIF-1α 诱导的EMT 是与转移相关的关键过程. 活化的肝星状细胞通过炎症信号可以促进HCC 细胞中转谷氨酰胺酶2(transglutaminase type 2, TGM2) 上调, 使HIF-1α 积累, 从而产生假缺氧状态, 促进HCC细胞中的EMT. 脂质代谢的重编程已成为癌症的标志, 最近有研究报道HIF-1α 与这一过程有关, 脂肪酸结合蛋白5 (fatty acid-binding protein 5, FABP5) 通过促进HIF-1α 合成并破坏FIH/HIF-1α 相互作用来增强HIF-1α 活性, 从而促进HCC 细胞中的脂质积累和细胞增殖.
1.2 ncRNA 与HCC 缺氧TME
基于ncRNA 的特点, 目前大多数研究集中在ncRNA 调节HCC 细胞功能和靶基因中的作用. 研究表明, ncRNA 参与细胞间通讯, 调节肿瘤免疫细胞的活化、增殖和细胞因子分泌,从而影响肿瘤的迁移、侵袭和免疫逃逸. ncRNA 在HCC 和TME 之间起着重要作用. 实体癌及其TME 通常是以缺氧为关键特征, 而缺氧的反应机制十分复杂. 因此, ncRNA 调节缺氧TME 的作用受到人们越来越多的关注.
靶基因受HIF-1α 调节, 以介导缺氧诱导的表型[16], 其中由缺氧信号调节的ncRNA 称为缺氧反应性ncRNA (hypoxia-responsive ncRNA, HRN). 根据与HIF 复合物的相互作用,HRN 可分为参与HIF-1α 介导的直接调节和HIF-1α 介导的间接调节[17]. miRNA 作为研究最多的亚组, 缺氧反应性miRNA (hypoxia-responsive miRNA, HRM) 在癌症的发生和发展中表现出有希望的致癌或肿瘤抑制功能[18]. 缺氧可以改变lncRNA 的表达, 进而通过多种机制调节HIF-1α 活性, 如染色质修饰、RNA 稳定性和蛋白质稳定性、HIF-1α 的转录活性调节[19]. 研究表明, lncRNA 还可作为miRNA 的竞争内源性RNA (competing endogenous RNA, ceRNA) 在转录后水平调节相关mRNA 的表达[20], 例如HIF-1α mRNA. ncRNA 可以通过多种机制在转录后水平介导HIF-1α, 这对于调节HIF-1α 表达至关重要(见表2).

表2 ncRNA 与HIF-1α 在肝癌中的研究进展Table 2 Research progress of ncRNAs and HIF-1α in HCC
2 ncRNA 在肝癌中的调控
2.1 miRNA
2.1.1 肝癌中的致癌性miRNA针对肝病等多种疾病中的miRNA 的研究正在逐渐扩大. 下面总结致癌性miRNA 在肝癌中的发病机制和进展中的作用(见表3).
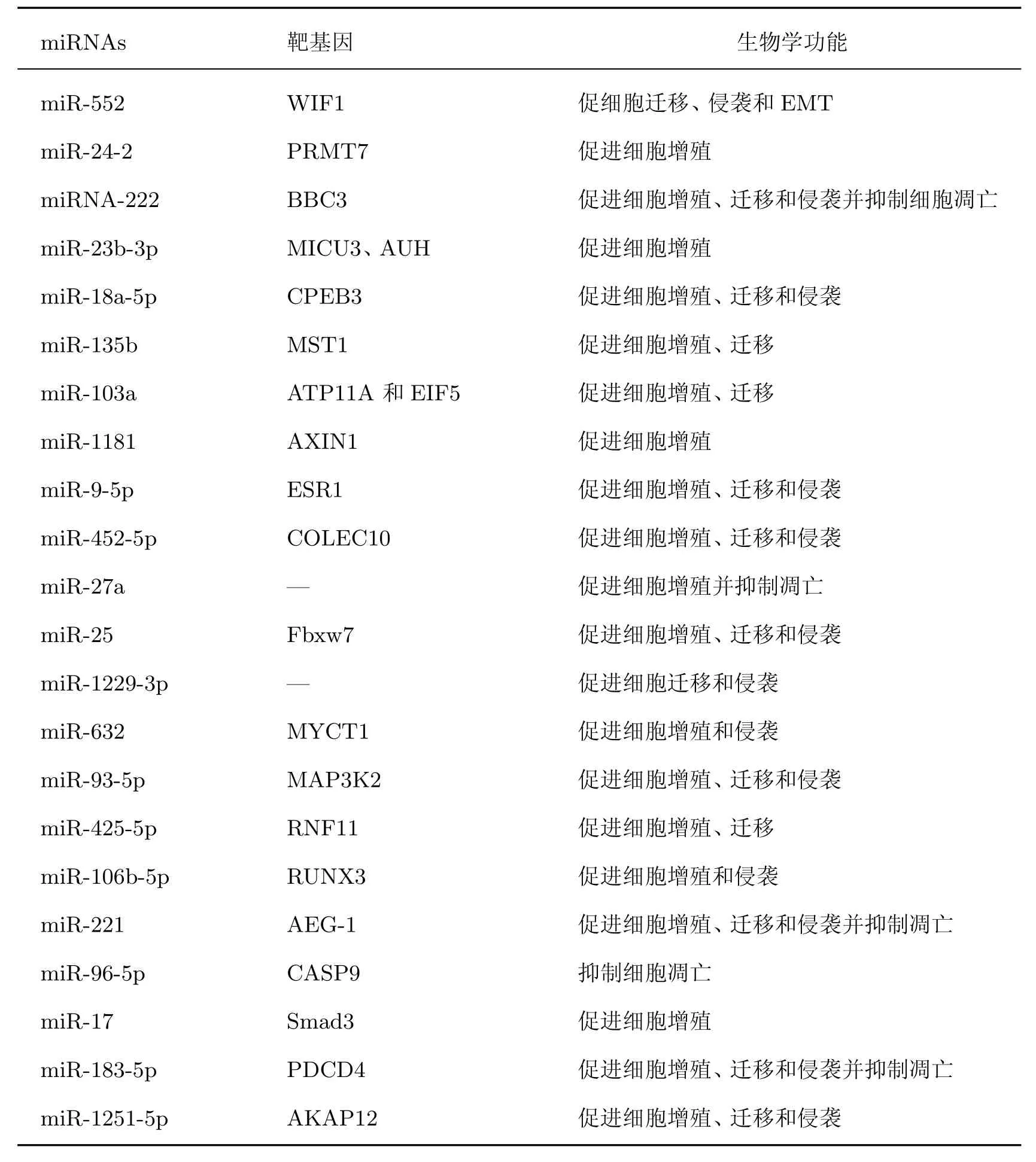
表3 致癌性miRNA 在HCC 中的调控作用Table 3 Regulatory role of oncogenic miRNAs in HCC
miR-18a 在人类癌症中失调并与肿瘤发展有关. miR-18a-5p 是miR-18a 的主要成熟体,在HCC 组织中显著上调, 其表达与HCC 的预后呈负相关. 通过体外实验验证, miR-18a-5p表达的下调显著抑制了HCC 细胞的进展. 机制上, miR-18a-5p 通过靶向细胞质多腺苷酸化元件结合蛋白3(cytoplasmic polyadenylation element binding protein 3, CPEB3) 促进HCC 细胞的进展. 该研究有助于人们更好地了解miR-18a-5p 潜在的HCC 进展机制, 也有助于寻觅有关HCC 靶向新的治疗方案.
Li 等[21]探讨了miR-552 在HCC 中的作用机制, 与癌旁组织相比, HCC 组织中的miR-552 的表达显著增加, 并且该基因高表达预示着HCC 患者的预后较差. 接着, 通过细胞功能试验表明miR-552 在HCC 细胞中发挥着显著的致癌功能. 机制上, miR-552 通过与其直接靶点Wnt 抑制因子1 (wnt inhibitory factor 1, WIF1) 结合, 使WIF1 介导的糖原合酶激酶3β(glycogen synthase kinase-3β, GSK-3β)/β-catenin 信号通路的激活降低, 从而在HCC 中发挥其致癌作用.
miR-23a/24-2/27a 簇可以促进肝转移, 为了确定其在肝癌中的调节机制, Yang 等[22]发现, 与癌旁组织相比, 肝癌组织中成熟的miR-24-2 显著增加, 并通过体内和体外实验证明了miR-24-2 加速肝癌细胞的生长. Hayashi 等[23]专注于miR-23b-3p 的双重作用, 以确定它是否在HCC 组织中作为肿瘤抑制或致癌miRNA 发挥作用, 通过过表达miR-23b-3p 显示其与肿瘤恶性和不良预后相关, 证明miR-23b-3p 在HCC 癌变过程中充当致癌miRNA, 并且线粒体钙摄取家族成员3(mitochondrial calcium uptake family member 3, MICU3) 和烯酰辅酶A水合酶(the AU binding homolog of enoyl-CoA hydratase, AUH) 都可能是miR-23b-3p 的候选基因靶标.
2.1.2 肿瘤抑制性miRNA 和肝癌
基于miRNA 的双重性, 总结肿瘤抑制性miRNA 在HCC 中的生物学功能, 结果见表4.

表4 肿瘤抑制性miRNAs 在HCC 中的调控作用Table 4 Regulatory role of tumor suppressor miRNAs in HCC
Furuta 等[24]发现miR-203 表达对HCC 细胞系的生长有抑制作用, 并指出miR-203 可能为肿瘤抑制因子. 聚焦于HCC 患者临床病理特征的研究表明, miR-203 在HCC 组织中表达显著低于在癌旁组织中的表达[25]. Zhang 等[26]发现, miR-203 过表达可以使HepG2 和Hep3B 细胞活力和细胞增殖显著下降. 机制上, miR-203 通过直接靶向PIK3CA 下调磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B, PI3K/Akt) 信号传导, 并且miR-203 在原发性肝癌中还可调节原癌基因c-Jun 和p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases, p38 MAPK) 的表达, 从而发挥其抑癌功能.
通过分析健康供体和肝癌患者的肝组织样本中miR-378a 的表达水平, 发现与正常肝脏样本相比, 肝癌样本中miR-378a 的表达水平显著降低. 通过双荧光实验表明, miR-378a 靶向血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)、血小板衍生生长因子受体β (platelet derived growth factor receptor β, PDGFRβ) 和c-RAF, 这3 个基因也是多靶点抑制剂索拉非尼的重要靶点. 此外, miR-378a 增强了肝癌细胞对索拉非尼的敏感性[27].
与癌旁组织相比, HCC 组织中miR-300 的表达显著下调, 并预示着HCC 患者的不良预后. 机制上, miR-300 通过直接靶向黏附斑激酶(focal adhesion kinase, FAK)/PI3K/AKT 信号通路抑制EMT 从而抑制HCC 细胞的迁移和侵袭[28]. miR-300 可通过下调肿瘤细胞周期相关蛋白(cell cycle-related and expression-elerated protein in tumor, CREPT)/Wnt/β-catenin信号通路, 抑制肝细胞癌细胞的生长[29]. 因此, miR-300 在HCC 的侵袭和转移中起重要作用,可作为一个有前途的治疗靶点.
2.2 lncRNA
lncRNA 作为癌基因或抑癌基因, 在调节HCC 的发生发展中起关键作用. lncRNA 除了调节靶基因外, 还可以作为miRNA 海绵竞争性结合miRNA, 从而减弱miRNA 对靶基因mRNA 的抑制作用, 间接提高靶基因mRNA 的表达水平, 这些lncRNA 被称ceRNA[30](见图2).

图2 lncRNA 相关ceRNA 在HCC 中介导的功能Fig.2 lncRNA-associated ceRNA mediated functions in HCC
2.2.1 lncRNA 在细胞增殖和抗凋亡中的作用
Tang 等[31]用双荧光素酶报告基因实验, 证实了lncRNA 牛磺酸上调基因1(taurine upregulated gene 1, TUG1) 与miR-1-3p 之间的靶向结合关系. 从机制上看, lncRNA TUG1 可以作为ceRNA 吸附miR-1-3p, 促进胰岛素样生长因子1(insulin-like growth factor 1, IGF1)的表达, 促进细胞在肝癌发生中的增殖. lncRNA ASMTL-AS1 是HCC 发生和发展的关键调控因子, 为了确定其在HCC 恶变过程中的功能. Mou 等[32]评估了ASMTL-AS1、miR-1343-3p 和LAMC1 在HCC 组织和细胞中的表达, 发现ASMTL-AS1 和LAMC1 在HCC 组织和细胞中高表达, 而miR-1343-3p 则低度表达. 在机制中, ASMTL-AS1 海绵吸附了miR-1343-3p, 从而减弱了miR-1343-3p 对LAMC1 的3′-UTR 的靶向作用, 抑制了HCC 细胞的增殖. LINC00473 已被确认为许多癌症的肿瘤因子, 有研究表明LINC00473 在HCC 细胞中也明显升高. Mou 等[33]使用RNA 免疫沉淀(RNA immcenoprecipitation, RIP) 实验证实了LINC00473 与miR-195 之间的结合相关性, 其中miR-195 是各种癌症中著名的肿瘤抑制因子. 在体内实验中, 结果显示LINC00473 能够通过抑制miR-195 作为ceRNA 来促进HCC 肿瘤的生长. 因此, LncRNA-miRNA 网络是治疗癌症的一个有希望的目标.
2.2.2 lncRNA 在迁移、侵袭和EMT 中的作用
Li 等[34]发现一个lncRNA-LINC02362 与HCC 患者的预后良好有关. MTT (噻唑蓝) 分析、EdU 标记实验等分析表明, LINC02362 抑制了HCC 细胞的生存、迁移、侵袭和EMT. 此外, LINC02362 作为海绵调节miR-516b-5p 的内源水平, 并作为肿瘤抑制性lncRNA 发挥作用. 数据显示, 与对照组相比, LINC01572 在HCC 组织中异常上调, 特别是在并发T2DM 的患者中[35]. LINC01572 的过量表达明显促进了HCC 细胞的增殖、迁移、侵袭和EMT,而敲除LINC01572 则有相反的效果. LINC01572 作为miR-195-5p 的ceRNA, 限制其对PFKFB4 的抑制,从而增强糖酵解,激活PI3K/AKT 信号,引发HCC 恶变.Zhou 等[36]通过CCK8、EdU、菌落形成、划痕实验, 测量LINC00355:8 对HCC 细胞增殖、迁移和侵袭的影响. 结果表明,LINC00355:8 通过作为ceRNA 抑制miR-6777-3p 的表达来激活Wnt10b, 从而促进HCC 细胞的增殖、迁移和侵袭.
2.3 circRNA
circRNA 可以代表临床相关的生物标志物用于癌症患者的管理[37]. 图3 总结了近年发现的失调circRNA 及它们在HCC 中的调控功能.
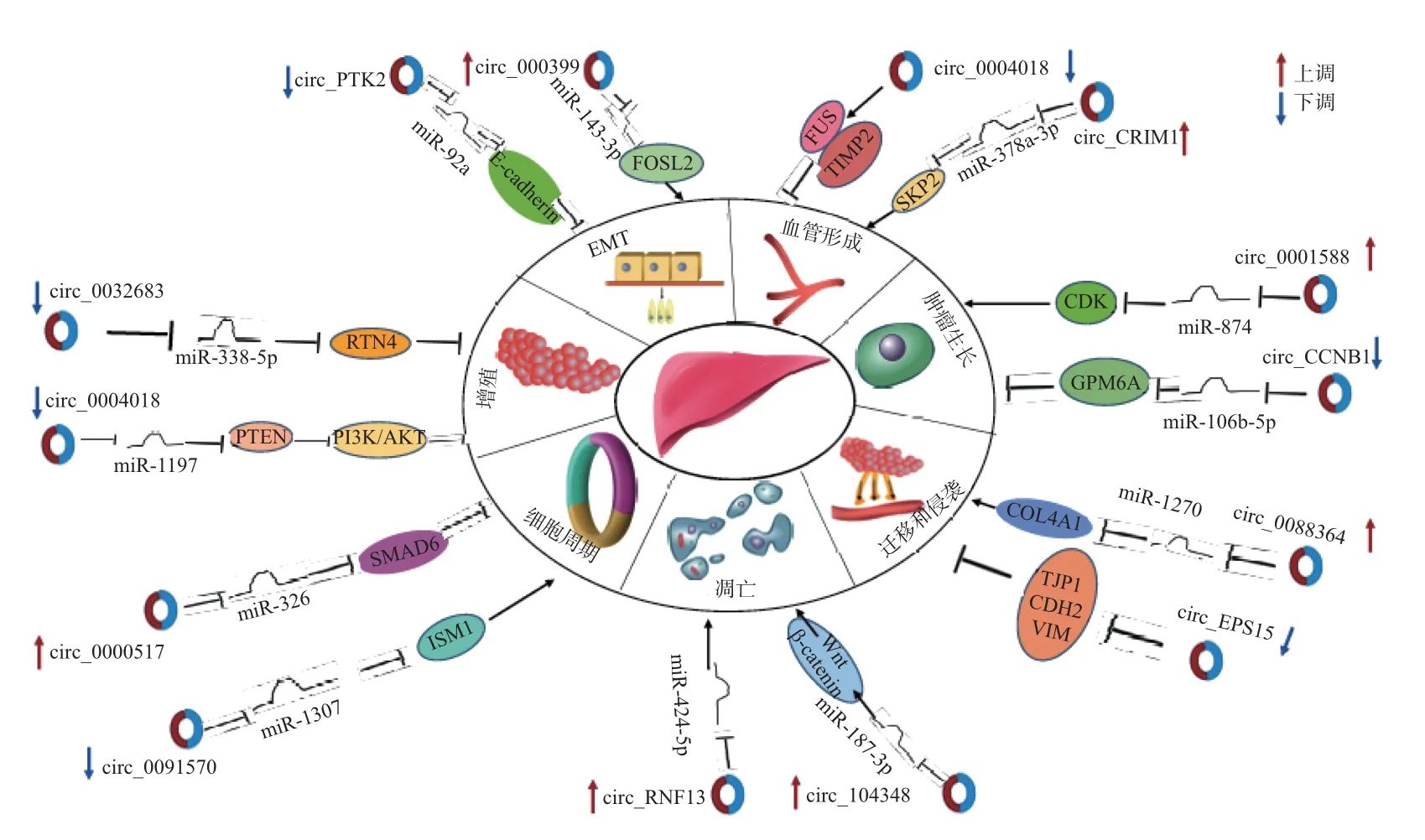
图3 circRNA 的作用及调控网络机制Fig.3 Role of circRNA and regulatory network mechanism
2.3.1 circRNA 在细胞增殖和抗凋亡中的作用
circ-0032683 在HCC 组织中的表达显著低于正常肝组织, 并被证明是miR-338-5p 的海绵,体外和体内功能实验表明,其作为肿瘤抑制因子发挥作用. 在HCC 中circ-0032683 的表达减少导致miR-338-5p 活性增加, 从而其靶标神经突生长抑制剂(reticulon-4, RTN4) 的表达减少. 因此,circ-0032683 通过ceRNA 机制抑制了HCC 的增殖能力. HCC 中细胞增殖途径的失调也可以由促癌circRNA 介导, 其中, circ-0003945 在HCC 组织中上调, 较高的circ-0003945表达与肿瘤大小和肿瘤分期呈正相关. 机制上, circ-0003945 可作为miR-34c-5p 海绵发挥作用, 上调其靶基因-富含亮氨酸重复的G 蛋白偶联受体4 (leucine-rich repeat-containing G protein-coupled receptor 4, LGR4) 的表达, 激活β-catenin 通路, 最终促进HCC 的增殖[38].
研究证明, circ-0036412 /miR-579-3p/ GLI2 网络可以影响HCC 的细胞周期进程.circ-0036412 在HCC 细胞中过表达, 并通过竞争性结合miR-579-3p 上调GLI2 的表达,从而促进HCC 细胞的增殖并抑制细胞周期停滞[39].
细胞凋亡是程序性细胞死亡, 对凋亡程序的研究对于阐明肿瘤发展为高度恶性和对于治疗肿瘤耐药性至关重要. 最近, 有报道称circRNA 在调控肝癌细胞凋亡机制的信号通路中具有相关性[40]. 已有多项研究确定了可以调节细胞凋亡的circRNA(见图3). 除此之外, Duan等[41]在HCC 中发现一种高表达的circRNA-circMAP3K4, 其可预防肝细胞癌的细胞凋亡.circMAP3K4 在HCC 中具有编码潜力, 在N6-甲基腺苷(N6-methyladenosine, m6A) 修饰的驱动下, 可编码一个455aa 多肽circMAP3K4-455aa. circMAP3K4-455aa 通过与凋亡诱导因子线粒体相关1(apoptosis inducing factor mitochondria associated 1, AIF) 相互作用, 抑制顺铂诱导的HCC 细胞凋亡, 这可能为化疗耐药的HCC 患者提供一种新的治疗策略.
2.3.2 circRNA 在侵袭、转移和血管生成中的作用
侵袭和转移与EMT 密切相关, EMT 是指上皮细胞从分化特性转变为间质特性的生物学过程, 其在源自上皮细胞的恶性肿瘤细胞获得能够侵袭的特征能力中起着至关重要的作用[42]. 最近的研究表明, 一些EMT 相关的circRNA 可以影响HCC 的EMT 过程. 例如,circPTK2 可以调节HCC 中的EMT.研究发现,miR-92a 在HCC 组织和HCC 细胞系中上调,circPTK2 可作为miR-92a 的海绵抑制其表达, 从而下调其靶向E-钙黏蛋白(E-cadherin) 的能力, 进而来抑制肝细胞癌中的EMT. Song 等[43]在有/无门静脉肿瘤血栓(portal vein tumor thrombosis, PVTT) 转移的HCC 患者中发现, circ000399 在PVTT 组织和HCC 组织中的表达显著上调, 其表达与HCC 患者的侵袭性特征相关. 进一步研究发现, circ0003998 可以作为miRNA-143-3p 的ceRNA, 从而减轻其对FOS 样2(FOS-like 2, FOSL2) 的抑制; 同时,circ0003998 可以与poly(rC) 结合蛋白1 (poly(rC) binding protein 1, PCBP1) 结合, 提高了EMT 相关基因CD44v6 的表达水平, 从而促进肝细胞癌中的上皮向间质转化.
Wu 等[44]通过qRT-PCR 在HCC 中发现一种下调的circRNA-circ-0004018, 通过一系列功能试验, 发现circ-0004018 的过表达显著抑制了HCC 中的血管生成. 机制上, 由雌激素受体1(estrogen receptor 1,ESR1)激活的circ-0004018 通过与肉瘤融合蛋白(fused in sarcoma,FUS) 结合并稳定TIMP 金属肽酶抑制剂2(TIMP metallopeptidase inhibitor 2, TIMP2) 表达, 从而抑制HCC 中的血管生成. Yang 等[45]发现HCC 组织中circCRIM1 的表达高于相应的相邻正常样本, 并与预后不良有关. 进一步研究发现, circCRIM1 可以充当miR-378a-3p 的海绵从而上调其靶基因S 期激酶相关蛋白2(S-phase kinase-associated protein 2, SKP2) 的表达, 促进肝细胞癌增殖、转移和血管生成.
3 结论与展望
越来越多的研究证实, ncRNA 作为治疗HCC 的有希望的预后生物标志物和治疗靶点. 其中, 研究最多的ncRNA 是miRNA, 其中一些已被证明在HCC 中显著失调, 促进肝肿瘤进展并与HCC 患者的预后明显相关[46]. 此外, 不同类型ncRNA 之间的调控网络, 如lncRNA-miRNA、circRNA-miRNA, 表明ncRNA 在TME 调控中的复杂性. 鉴于ncRNA 的组织特异性表达, 一些ncRNA 生物标志物或治疗靶点可能对单一肝脏疾病具有高度特异性,从而可以快速诊断和更好地管理HCC. 这些发现为ncRNA 介导的HCC 微环境、代谢和肿瘤细胞状态之间的相互作用提供了新的见解.
TME 在肝癌的发生和发展中起着关键作用. 持续的肝损伤和同时发生的再生可能会产生一个环境, 最终导致缺氧和炎症的形成, 这是TME 关键特征[47-48]. 在缺氧条件下, HIF-1α是一种重要的转录因子, 它介导缺氧对肿瘤细胞和TME 的适应性调节的影响[49]. HCC 中HIF-1α 的表达明显高于正常肝细胞中的表达. HIF-1α 是HCC 细胞适应缺氧微环境的关键调节因子, 许多研究已经证明了HIF-1α 作为治疗靶点的可行性, 这表明通过直接或间接方式改变HIF-1α 活性的干预措施可能对治疗HCC 有效.
已发现许多ncRNA 通过转录后水平调节HIF-1α 的表达, 进而调控TME. 因此, 基于抗ncRNA 的癌症干预疗法的临床前研究受到了极大的关注, 并衍生出了一系列临床药物. 例如:Ghosh 等[50]通过体内和体外实验验证了miR-199a-3p 通过下调TME 中的趋化因子-血管内皮生长因子A(Vascular endothelial growth factor A, VEGFA), 来减弱HCC 中的多个细胞间串扰, 并证明了这是一种有价值的治疗HCC 的方法. miR-34a 是一种天然存在的肿瘤抑制因子, 基于miR-34a 的癌症治疗已经在晚期实体瘤患者中进行了研究[51]. 虽然由于免疫毒性, 这项基于miRNA 疗法的首次人体临床试验提前结束, 但不能否认miR-34a 在治疗HCC 原位小鼠模型中显著抑制了肿瘤生长这一事实[52]. 因此, 在ncRNA 水平上探索和研究天然药物对TME 的调节作用是有希望的.
由此可见, ncRNA 对肝癌的发生发展及其对TME 的调控为HCC 的探索和治疗提供了新的方向, 其中基于ncRNA 的调控网络, ncRNA 的靶基因及相关的信号通路正在成为新的药物研发的目标. 我们相信, ncRNA 在未来可能被用作液体活检和非侵入性生物标志物, 用于癌症的早期检测、诊断和治疗.

