长链非编码RNA DLX6-AS1调控喉癌细胞的机制研究
穆妮热·贾帕尔,阿依恒·曲库尔汗,雍 军,皮力东·库亚西,穆扎排尔·米尔扎克木 (新疆医科大学第一附属医院耳鼻喉科,新疆 乌鲁木齐 830000)
喉癌是头颈部常见的恶性肿瘤,饮酒和吸烟是喉癌的主要诱因,研究发现在过去30年里,早期喉癌患者主要通过手术及放化疗手段进行治疗,但大多数患者发现时为中晚期,治疗效果不佳,导致患者的生存率有所下降[1-2]。因此,找到喉癌靶向治疗的有效标志物至关重要。有研究发现,肿瘤样本被大量的炎症细胞浸润,如I型辅助性T淋巴细胞、调节性T细胞和肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)[3]。TAMs是肿瘤微环境中至关重要的免疫细胞,与肿瘤不良预后相关,根据巨噬细胞的激活状态可分为M1表型和M2表型。一般情况下,M1极化的巨噬细胞能够分泌促炎细胞因子来消灭肿瘤细胞,以白细胞介素10(interleukin 10,IL-10)和精氨酸酶1(arginase 1,Arg-1)为主要标记物,参与血管生成和肿瘤进展[4]。TAMs主要属于M2极化的巨噬细胞,可促进肿瘤生长、侵袭和转移[5-6],在肿瘤进展中起重要作用,但其在喉癌发展中的分子机制尚未完全阐明。长链非编码RNA(long non-coding RNA,lncRNA)与多种病理过程密切相关,特别是肿瘤发生[7-8]。研究发现,lncRNA DLX6-AS1作为一种新型的lncRNA参与了肺癌、胃癌、膀胱癌等癌症的发生发展[8-10],然而lncRNA DLX6-AS1对喉癌发展的影响及其作用机制尚不明确,因此本研究深入探讨了lncRNA DLX6-AS1在喉癌细胞发展中的生物学功能。
1 材料与方法
1.1 主要仪器与试剂
人喉表皮样癌细胞Hep-2购自中国科学院上海细胞库。qRT-PCR仪器购自西安天隆生物科技有限公司,酶标仪购自美国赛默飞世尔科技有限公司,细胞培养箱购自上海航佩仪器有限公司。Transwell Insert小室(膜孔径为0.4 μm)购自美国Corning公司,lncRNA DLX6-AS1干扰质粒(si-lncRNA DLX6-AS1)及其阴性对照(si-NC)、lncRNA DLX6-AS1过表达质粒(pcDNA-lncRNA DLX6-AS1)及其过表达对照[pcDNA-3.1(+)]、miR-144抑制剂(miR-144 inhibitor)和miR-144模拟物(miR-144 mimics)购自上海吉玛基因有限公司,CCK-8试剂盒购自上海碧云天生物科技有限公司,RPMI 1640培养基购自美国Gibco公司,TaqMan Universal Master Mix Ⅱ和Taq-Man microRNA购自杭州沃森生物技术有限公司,CD163、E-cadherin和N-cadherin抗体购自英国Abcam公司,LipofectamineTM2000购自美国赛默飞世尔科技有限公司。
1.2 人外周血单核细胞(peripheral blood mono⁃nuclear cells,PBMCs)和TAMs的分离
本研究经我院医学伦理委员会批准(K202104-05)。采集健康志愿者新鲜外周血,使用Ficoll-Hypaque(GE Healthcare)密度梯度离心法分离PBMCs,将稀释的全血加入分离层的上层,离心后吸出囊泡细胞,PBS冲洗,沉淀重悬于含10%胎牛血清的RPMI 1640培养基中,培养1.5 h,收集贴壁细胞。将新鲜的肿瘤组织用胶原酶消化得到单细胞悬液,抗CD11b磁珠孵育。使用MACS-LS色谱柱分离CD11b阳性细胞。细胞培养1 h,采用流式细胞术检测CD11b阳性的TAMs。
1.3 细胞培养和细胞转染
人喉表皮样癌细胞Hep-2在DMEM培养基中培养,置于37 ℃、5% CO2的湿室中。将人单核细胞白血病细胞THP-1置于含10%胎牛血清、10 000 U/mL青霉素、2 mmol/L L-谷氨酰胺和10 000 μg/mL链霉素的RPMI 1640培养基中培养。将THP-1细胞与100 ng/mL佛波酯(phorbol myristate acetate,PMA)孵育48 h,诱导THP-1向巨噬细胞分化后,用白细胞介素4(interleu⁃kin 4,IL-4)20 ng/mL继续诱导THP-1细胞,使其分化为M2型巨噬细胞。共培养实验中,THP-1细胞(M2型巨噬细胞)接种于Transwell Insert小室中,Hep-2细胞在底孔中培养。培养的细胞分为Control组(THP-1与Hep-2细胞共培养,Hep-2细胞不作任何处理)和IL-4组(20 ng/mL IL-4作用于THP-1细胞,THP-1与Hep-2细胞共培养)。为了检测下调lncRNA DLX6-AS1对巨噬细胞M2极化诱导的Hep-2细胞增殖、侵袭和上皮间质转化的影响,将IL-4组细胞分为IL-4+si-NC组(Hep-2细胞转染4 μg si-NC质粒)与IL-4+si-DLX6-AS1组(Hep-2细胞转染4 μg si-DLX6-AS1质粒)。为了检测lncRNA DLX6-AS1与miR-144的关系,将Control组细胞分为DLX6-AS1 WT+mimics NC组(Hep-2细胞转染4 μg lncRNA DLX6-AS1 WT+mimics NC质粒)、DLX6-AS1 WT+miR-144 mimics组(Hep-2细胞转染4 μg DLX6-AS1 WT+miR-144 mimics质粒)、DLX6-AS1 MUT+mimics NC组(Hep-2细胞转染4 μg DLX6-AS1 MUT+mimics NC质粒)、DLX6-AS1 MUT+miR-144 mimics组(Hep-2细胞转染4 μg DLX6-AS1 MUT+miR-144 mimics质粒)。为了检测上调lncRNA DLX6-AS1通过miR-144对巨噬细胞M2极化诱导的Hep-2细胞增殖、侵袭和上皮间质转化的影响,将IL-4组细胞分为pcDNA-3.1(+)+mimics NC组[Hep-2细胞转染4 μg pcDNA-3.1(+)+mimics NC质粒]、pcDNA-DLX6-AS1+mimics NC组(Hep-2细胞转染4 μg pcDNA-DLX6-AS1+mimics NC质粒)、pcDNA-3.1(+)+miR-144 mimics组(Hep-2细胞转染4 μg pcDNA-3.1(+)+miR-144 mimics质粒)、pcDNA-DLX6-AS1+miR-144 mimics组(Hep-2细胞转染4 μg pcDNA-DLX6-AS1+miR-144 mimics质粒)。为了检测上调miR-144对巨噬细胞M2极化诱导的Hep-2细胞增殖、侵袭和上皮间质转化的影响,将IL-4组细胞分为IL-4+mimics NC组(Hep-2细胞转染4 μg mim⁃ics NC质粒)、IL-4+miR-144 mimics组(Hep-2细胞转染4 μg miR-144 mimics质粒)。用LipofectamineTM2000将质粒共转染到细胞中。
1.4 qRT-PCR检测lncRNA DLX6-AS1、miR-144、IL-10和Arg-1的表达
分离总RNA,逆转录酶反应合成cDNA。采用TaqMan Universal Master Mix Ⅱ和Taq-Man microRNA进行qRT-PCR。以U6或GAPDH分别作为内源对照,采用2-ΔΔCt法计算mRNA相对表达量。引物序列见表1。
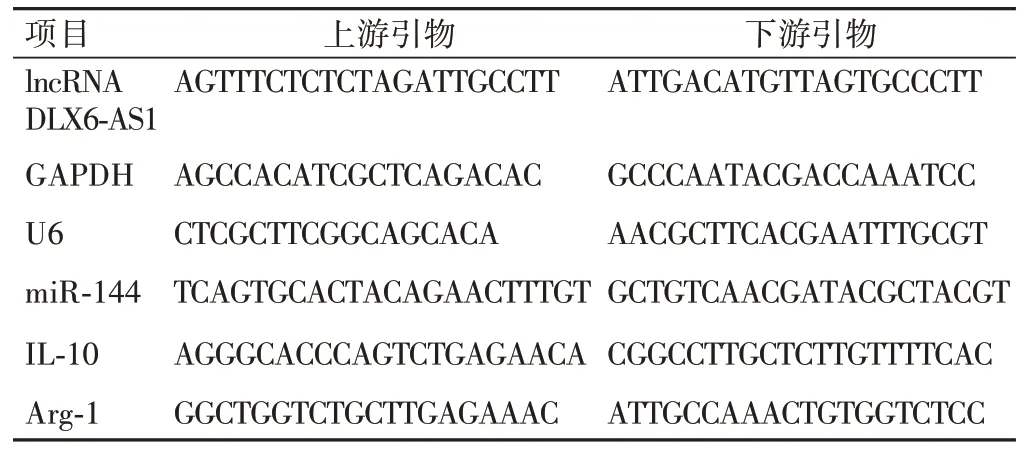
表1 引物序列
1.5 Western blot检测CD163、E-cadherin和N-cadherin的蛋白表达
提取的40 μg蛋白经SDS-PAGE转移到硝酸纤维素膜上,用5%脱脂乳阻断,与抗CD163(1∶1 000)、E-cadherin(1∶5 000)、N-cadherin(1∶6 000)和GAPDH(1∶4 000)的一抗于4 ℃孵育12 h,用二抗室温孵育2 h,对免疫复合物进行可视化检测。
1.6 CCK-8实验检测Hep-2细胞增殖活力
与THP-1细胞(M2型巨噬细胞)共培养48 h后,收集Hep-2细胞,接种于96孔板。在每孔中加入100 μL CCK-8,置于细胞培养箱孵育4 h,按说明书测定细胞增殖活力。
1.7 Transwell实验检测Hep-2细胞侵袭数目
在Transwell上腔室中添加200 μL无血清DMEM培养基,用于培养Hep-2细胞(4×104细胞)。将含5%胎牛血清的DMEM培养基加入下腔,在37 ℃、5% CO2条件下培养24 h,对侵袭的细胞进行固定和结晶紫染色,随机选取6个区域计数侵袭的细胞。
1.8 双荧光素酶报告系统测定荧光素酶活性
使用在线软件miRcode进行生物信息学分析,预测lncRNA DLX6-AS1与靶基因miR-144的结合位点。Hep-2细胞置于24孔板过夜。用LipofectamineTM2000分别将DLX6-AS1 WT+mimics NC、DLX6-AS1 WT+miR-144 mimics、DLX6-AS1 MUT+mimics NC和DLX6-AS1 MUT+miR-144 mimics质粒共转染至Hep-2细胞,48 h后检测荧光素酶活性。
1.9 统计学处理
数据采用SPSS 17.0软件进行分析,结果以3次重复独立实验的均数±标准差()表示,多组间比较采用单因素方差分析,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA DLX6-AS1与miR-144在PBMCs与TAMs中的表达
与PBMCs相比,TAMs中IL-10和Arg-1的mRNA表达明显升高(P<0.01),见图1a。与PBMCs相比,TAMs中lncRNA DLX6-AS1表达显著升高(P<0.01),miR-144表达显著降低(P<0.01),见图1b。
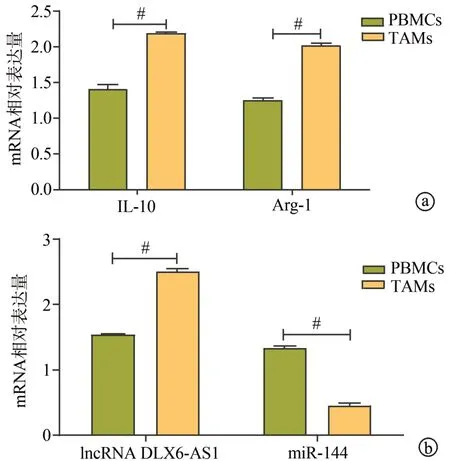
图1 qRT-PCR检测PBMCs和TAMs中IL-10、Arg-1、lncRNA DLX6-AS1和miR-144的表达
2.2 下调lncRNA DLX6-AS1抑制IL-4诱导的巨噬细胞M2极化
qRT-PCR结果显示,与Control组相比,IL-4组THP-1巨噬细胞的lncRNA DLX6-AS1 mRNA表达显著上调(P<0.01);与IL-4+si-NC组相比,IL-4+si-DLX6-AS1组THP-1巨噬细胞的lncRNA DLX6-AS1 mRNA表达显著下调(P<0.01),见图2a。与Control组相比,IL-4组THP-1巨噬细胞IL-10和Arg-1的mRNA表达显著上调(P<0.01);与IL-4+si-NC组相比,IL-4+si-DLX6-AS1组THP-1巨噬细胞IL-10和Arg-1的mRNA表达则显著下调(P<0.01),见图2b、c。在THP-1巨噬细胞中,与Control组相比,IL-4组M2巨噬细胞标志物CD163蛋白的表达显著增加(P<0.01);与IL-4+si-NC组相比,IL-4+si-DLX6-AS1组CD163蛋白的表达显著降低(P<0.01),见图2d、e。

图2 下调lncRNA DLX6-AS1抑制IL-4诱导的巨噬细胞M2极化
2.3 下调lncRNA DLX6-AS1抑制巨噬细胞M2极化诱导的Hep-2细胞增殖、侵袭和上皮间质转化
CCK-8实验结果显示,与Control组相比,IL-4组Hep-2细胞活力显著增加(P<0.05);与IL-4+si-NC组相比,IL-4+si-DLX6-AS1组Hep-2细胞活力显著下降(P<0.05),说明巨噬细胞M2极化促进了Hep-2细胞增殖,见图3a。与Control组相比,IL-4组Hep-2细胞侵袭数目明显增加(P<0.01),N-cadherin表达显著上调(P<0.01),E-cadherin表达显著下调(P<0.01);与IL-4+si-NC组相比,IL-4+si-DLX6-AS1组Hep-2细胞侵袭数目明显减少(P<0.01),N-cadherin表达显著下调(P<0.01),E-cadherin表达显著上调(P<0.01),见图3b~e。
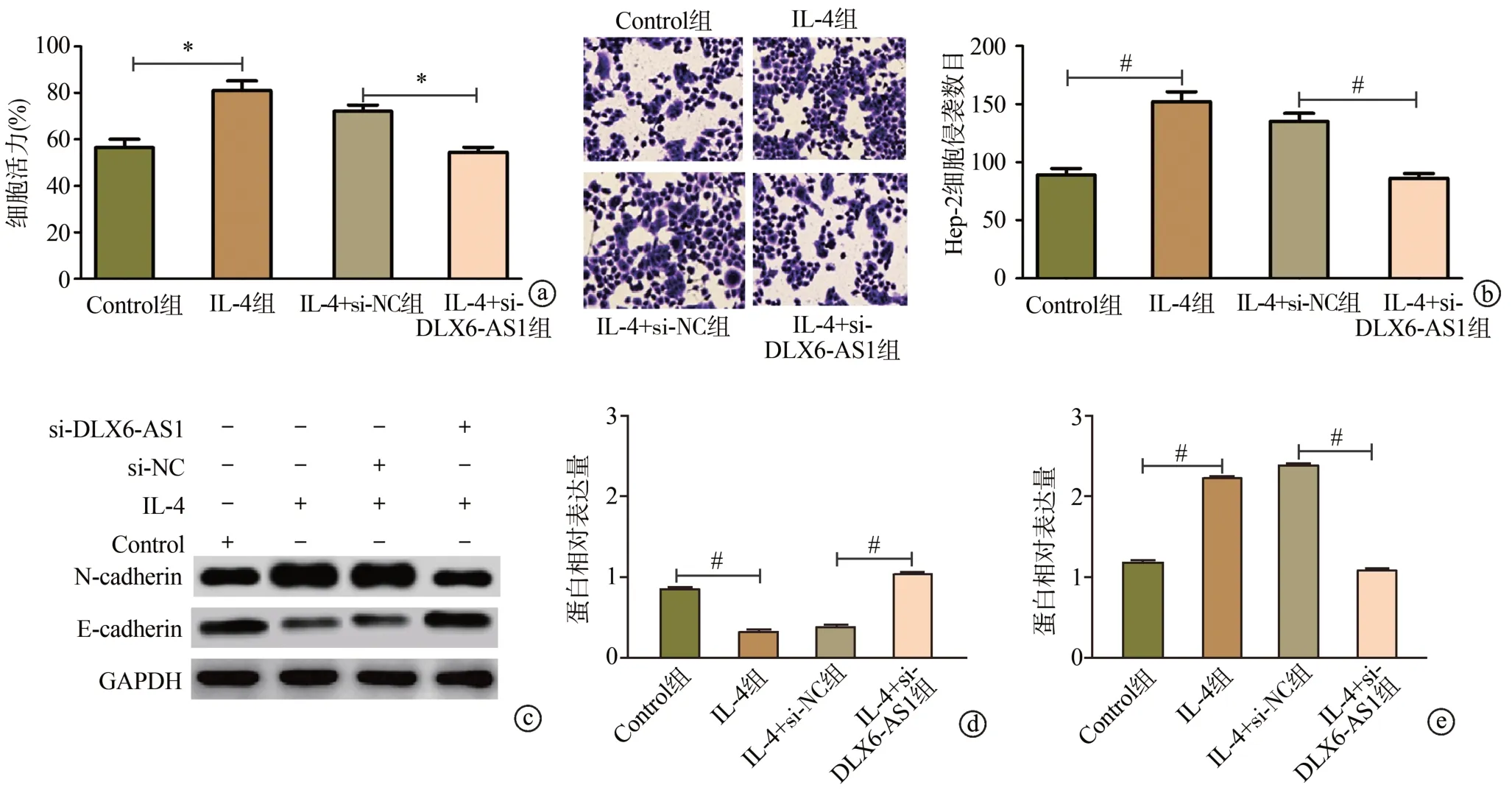
图3 下调lncRNA DLX6-AS1抑制巨噬细胞M2极化诱导的Hep-2细胞增殖、侵袭和上皮间质转化
2.4 lncRNA DLX6-AS1可与miR-144相互作用
使用在线软件miRcode进行生物信息学分析发现,lncRNA DLX6-AS1与miR-144之间存在潜在的结合位点(图4a)。双荧光素酶报告系统检测显示,lncRNA DLX6-AS1与miR-144之间存在直接相互作用,与DLX6-AS1 WT+mimics NC组相比,DLX6-AS1-WT+miR-144 mimics组荧光素酶活性显著降低(P<0.01),与 DLX6-AS1 MUT+mimics NC组相比,DLX6-AS1 MUT+miR-144 mimics组荧光素酶活性无显著变化(P>0.05),图4b。

图4 lncRNA DLX6-AS1与miR-144的靶点预测和相互关系分析
2.5 过表达lncRNA DLX6-AS1通过miR-144促进巨噬细胞M2极化
qRT-PCR结果显示,与Control组相比,IL-4组THP-1巨噬细胞中的miR-144表达水平降低(P<0.01),与IL-4+mimics NC组相比,IL-4+miR-144 mimics组THP-1巨噬细胞中的miR-144 mRNA表达水平显著上调(P<0.01),见图5a。IL-4处理THP-1巨噬细胞后,与pcDNA-3.1(+)+mimics NC组相比,pcDNA-DLX6-AS1+mimics NC组细胞内IL-10和Arg-1的mRNA表达以及CD163蛋白表达显著上调(P<0.01);与pcDNA-3.1(+)+miR-144 mimics组相比,pcDNA-DLX6-AS1+miR-144 mimics组细胞内L-10和Arg-1的mRNA表达以及CD163蛋白表达显著上调(P<0.01),见图5b~e。
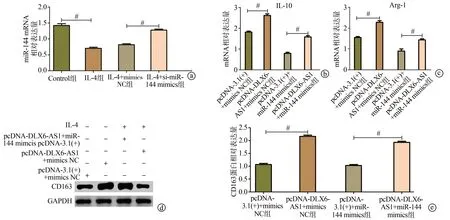
图5 过表达lncRNA DLX6-AS1通过miR-144促进巨噬细胞M2极化
2.6 过表达lncRNA DLX6-AS1通过miR-144促进Hep-2细胞增殖、侵袭和上皮间质转化
IL-4处理THP-1巨噬细胞后,与pcDNA-3.1(+)+mimics NC组相比,pcDNA-DLX6-AS1+mimics NC组Hep-2细胞活力及细胞侵袭数目显著增加(P<0.01),N-cadherin表达显著上调(P<0.01),E-cadherin表达显著下调(P<0.01);与pcDNA-3.1(+)+mimics NC组相比,pcDNA-3.1(+)+miR-144 mimics组Hep-2细胞活力显著下降(P<0.01),细胞侵袭数目显著减少(P<0.01),N-cadherin表达显著下调(P<0.01),E-cadherin表达显著上调(P<0.01);与pcDNA-3.1(+)+miR-144 mimics组相比,pcDNA-DLX6-AS1+miR-144 mimics组Hep-2细胞活力及细胞侵袭数目显著增加(P<0.01),N-cadherin表达显著上调(P<0.01),E-cadherin表达显著下调(P<0.01),见图6。
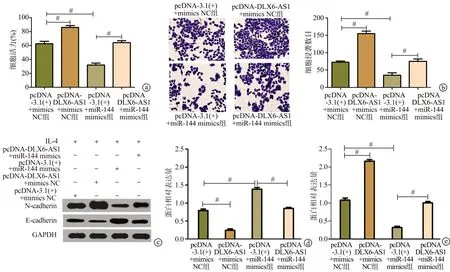
图6 过表达lncRNA DLX6-AS1通过miR-144促进Hep-2细胞增殖、侵袭和上皮间质转化
3 讨论
有研究表明,在前列腺癌、乳腺癌、胃癌等多种癌症中,巨噬细胞极化均与预后不良具有很强的相关性[11-13]。TAMs参与肿瘤细胞的增殖、侵袭和肿瘤血管生成。李旭等[12]报道TAMs可通过促进MCF-7细胞发生上皮间质转化进而促进乳腺癌的浸润转移。由于TAMs主要为M2表型,有研究表明,来自单核细胞的M2型巨噬细胞比M1型巨噬细胞更能促进肿瘤的生长和侵袭[13]。M2型巨噬细胞可明显减少依托泊苷诱导的癌细胞凋亡,而与M1型巨噬细胞共培养的THP-1细胞凋亡显著增加[14]。有研究发现,M2型巨噬细胞依赖于M2型巨噬细胞来源的外泌体调节结直肠癌细胞迁移和侵袭;同时,M2型巨噬细胞来源的外泌体还可促进结肠癌细胞的迁移和侵袭[15]。因此,本研究深入探讨了M2型巨噬细胞在喉癌细胞发展过程中的生物学功能,结果发现,THP-1巨噬细胞衍生的M2型巨噬细胞进一步促进了Hep-2细胞的增殖、侵袭和上皮间质转化。
lncRNA通过调节人单核细胞/巨噬细胞的分化和极化,在多种病理过程中发挥调节作用。Zeng等[16]研究发现,M2型肿瘤相关巨噬细胞分泌的表皮生长因子通过激活EGFR-ERK信号通路和抑制lncRNA LIMT表达促进上皮性卵巢癌转移。M2型巨噬细胞来源的外泌体lncRNA AFAP1-AS1和microRNA-26a会影响食管癌细胞的迁移和转移[17]。此外,lncRNA可能通过调节单核细胞/巨噬细胞极化而发挥致癌或抑癌的作用。lncRNA COX-2可通过改变M1/M2巨噬细胞极化来阻止肝癌的免疫逃逸和转移[18]。lncRNA LINC00662可通过激活Wnt/β-catenin信号通路促进M2型巨噬细胞极化和肝癌进展[19]。然而,目前关于lncRNA对喉癌进展中巨噬细胞极化的作用和机制的研究还很有限。本研究首先用qRT-PCR实验检测了lncRNA DLX6-AS1在PBMCs与TAMs中的差异表达,结果发现与PBMCs相比,TAMs中lncRNA DLX6-AS1表达显著升高。随后我们使用干扰技术下调了lncRNA DLX6-AS1的表达,进一步分析了lncRNA DLX6-AS1的作用机制,结果表明下调lncRNA DLX6-AS1表达可抑制IL-4诱导的THP-1巨噬细胞M2极化。本研究发现M2型巨噬细胞进一步促进了Hep-2细胞的增殖、侵袭和上皮间质转化,而下调lncRNA DLX6-AS1表达对巨噬细胞M2极化诱导的Hep-2细胞增殖、侵袭和上皮间质转化的影响尚不明了,因此我们继续探讨了下调lncRNA DLX6-AS1表达后的影响,结果提示lncRNA DLX6-AS1表达降低可通过抑制巨噬细胞M2极化抑制Hep-2细胞增殖、侵袭和上皮间质转化。本研究结果初步揭示了lncRNA DLX6-AS1对喉癌Hep-2细胞恶性发展的影响及其作用机制,提示lncRNA DLX6-AS1在喉癌发展过程中发挥了明显的促癌作用。
在后续的研究中我们发现lncRNA DLX6-AS1可以与miR-144相互作用。miR-144已在多项研究中被证实参与了调控巨噬细胞极化以及肿瘤的发生发展,如miR-144可通过减轻M1型巨噬细胞相关炎症来阻止实验性腹主动脉瘤的形成[20];miR-144可通过调控PBX3抑制结直肠癌细胞的迁移和侵袭[21];此外,miR-144可通过下调激活增强因子结合蛋白4抑制胃癌细胞增殖和侵袭[22]。本研究发现,miR-144在喉癌患者分离出的TAMs中表达上调,且过表达lncRNA DLX6-AS1可通过miR-144促进IL-4诱导的THP-1巨噬细胞M2极化,并增强Hep-2细胞的增殖、侵袭和上皮间质转化能力,这表明miR-144在lncRNA DLX6-AS1调节M2极化和Hep-2细胞增殖、侵袭及上皮间质转化过程中扮演了非常重要的角色。
综上所述,lncRNA DLX6-AS1可通过调控miR-144表达来促进M2型巨噬细胞的激活,而M2型巨噬细胞激活后可促进Hep-2细胞的增殖、侵袭和上皮间质转化。这些结果表明,lncRNA DLX6-AS1通过诱导喉癌巨噬细胞M2极化,在喉癌细胞发展进程中发挥了重要作用。

