金耳类酵母型菌株分离与高产胞外多糖培养基优化
张 璐,李翘楚,王增利,丁 强,王鸿磊,*
(1.中国农业大学 烟台研究院,山东 烟台 264670; 2.中国农业大学 食品科学与营养工程学院,北京 100083)
金耳(Tremellaaurantialba)隶属担子菌门(Basidiomycota)银耳纲(Tremellomycetes)银耳目(Tremellales)银耳科(Tremellaceae)银耳属(Tremella)[1-2],是一种珍稀的食用菌。野生金耳分布于贵州、福建、甘肃、西藏、四川、云南等省份,其中滇西北和西藏东部等高海拔地区分布最广,产量最高[3]。金耳新鲜子实体胶质丰富、肉质细嫩、滑润可口、味香色美,含多种维生素和人体必需的氨基酸,具有较高的食用价值。此外,金耳还具药用价值,多糖是金耳的主要活性物质,已有研究表明,金耳多糖具有抗氧化[4-5]、提高机体免疫力[6-7]、抗肿瘤[8]、降血脂降血糖[9-10]、抗炎[11]等多种功效,有良好的应用前景。但是,与大宗菇类相比,金耳人工栽培规模较小,产量较低,价格昂贵,这极大地限制了金耳资源的开发利用[12]。与传统的人工栽培技术相比,液体发酵具有生产周期短、不受季节和地域限制、成本低、菌种质量稳定等优点。通过食用菌液态发酵,能够在短时间内获得菌体和代谢产物,符合工业化发展的趋势,是获取多糖的一种有效方式。然而,金耳子实体是由金耳菌丝和毛韧革菌菌丝(Stereumhirsutum)组成的异质复合体,其二型菌丝体结构的特殊性导致其生态、生理的复杂性。市售的金耳菌种多为混合菌种,以此为研究对象发酵产生的多糖为金耳多糖和毛韧革菌多糖的混合物,且两者的比例无法确定,这为金耳多糖的研究和开发带来了困难[13-14]。
本研究从金耳子实体中分离获得了金耳类酵母型菌株,研究了金耳产胞外多糖的最佳营养条件,并且通过单因素试验和正交试验对金耳产胞外多糖培养基进行了优化,获得了高产胞外多糖的培养基配方,为金耳胞外多糖工厂化生产提供参考。
1 材料与方法
1.1 材料
金耳子实体取自招远东萍食用菌有限公司。本研究用到的培养基有马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖(PDB)培养基、多糖发酵基础培养基(葡萄糖20 g·L-1、酵母浸粉5 g·L-1、磷酸二氢钾2 g·L-1、土豆浸粉3 g·L-1、维生素B10.2 g·L-1,pH值6.0)。
1.2 仪器设备
A200基因扩增仪,杭州朗基科学仪器有限公司;凝胶成像分析系统,北京君意东风电泳设备有限公司;奥林巴斯BX51显微镜,奥林巴斯;旋转蒸发仪,上海亚荣生化仪器厂;电泳仪,北京君意东风电泳设备有限公司;核酸蛋白检测仪,北京五洲东方科技发展有限公司。
1.3 方法
1.3.1 金耳类酵母型菌株的分离鉴定
金耳类酵母型菌株的分离:将新鲜金耳子实体表面用75%乙醇擦拭,无菌水洗涤3次,无菌风吹干表面水分后,取小块金耳子实体,脑状表面向下悬挂于盛有PDA培养基的无菌锥形瓶中,耳片距离培养基约2~3 cm。将锥形瓶置于22 ℃恒温培养箱中,4 d后移去子实体。挑取少量培养基表面形成的白色菌落进行平板划线分离,取单菌落接种于PDA斜面上,22 ℃培养,菌种长满斜面后,置于4 ℃冰箱保藏。
金耳类酵母型菌株形态观察:取金耳类酵母型菌种涂片,美蓝染色,显微镜观察。
金耳类酵母型菌株的ITS鉴定:采用CTAB法[15-16]提取金耳子实体和金耳类酵母型菌株基因组DNA,使用真菌ITS通用引物ITS1(5′-TCCGTAGGTGAACGG-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS序列。PCR产物送生工生物工程(上海)股份有限公司测序,所得基因序列通过BLAST程序与GenBank数据库的序列比对,进行分子生物学鉴定。用MEGA 5.0软件构建系统发育树。
1.3.2 金耳胞外多糖的提取与抗氧化性测定
胞外多糖的提取:将金耳类酵母型菌株接种到PDB培养基中,22 ℃、150 r·min-1培养4 d,培养液12 000×g离心20 min,取上清液,真空旋转蒸发浓缩,加3倍体积无水乙醇低温沉淀,离心取多糖沉淀,干燥后称其质量。
金耳胞外多糖抗氧化能力测定:配置6 mg·mL-1金耳胞外多糖溶液,采用试剂盒法分别测定金耳胞外多糖溶液的羟自由基、超氧阴离子自由基和DPPH自由基清除能力。
1.3.3 金耳高产胞外多糖培养基优化
最佳碳源、氮源和无机盐筛选。多糖发酵基础培养基中的碳源有葡萄糖、甘露醇、麦芽糖、蔗糖、乳糖,氮源有酵母浸粉、胰蛋白胨、牛肉浸膏、酒石酸铵、大豆蛋白胨,无机盐有氯化钙、硫酸镁、磷酸二氢钾、氯化钠、氯化钾。以粗多糖干重为指标,确定最佳碳源、氮源和无机盐。
单因素试验。设置蔗糖质量浓度为20、30、40、50、60 g·L-1,22 ℃培养5 d,测定其胞外粗多糖干重,确定最佳的碳源质量浓度;设置酒石酸铵的质量浓度为5.0、7.5、10.0、12.5、15.0 g·L-1,确定最佳的氮源质量浓度;设置磷酸二氢钾的质量浓度为2、4、6、8、10 g·L-1,确定最佳的无机盐质量浓度。
正交试验。根据单因素试验结果,选取蔗糖质量浓度(A)、酒石酸铵质量浓度(B)、磷酸二氢钾质量浓度(C)为影响胞外多糖产量的3个因素,设计3因素3水平正交试验,因素水平设置见表1。按照正交试验确定的最佳培养基配方进行液体培养,22 ℃培养5 d,测定其胞外多糖干重。
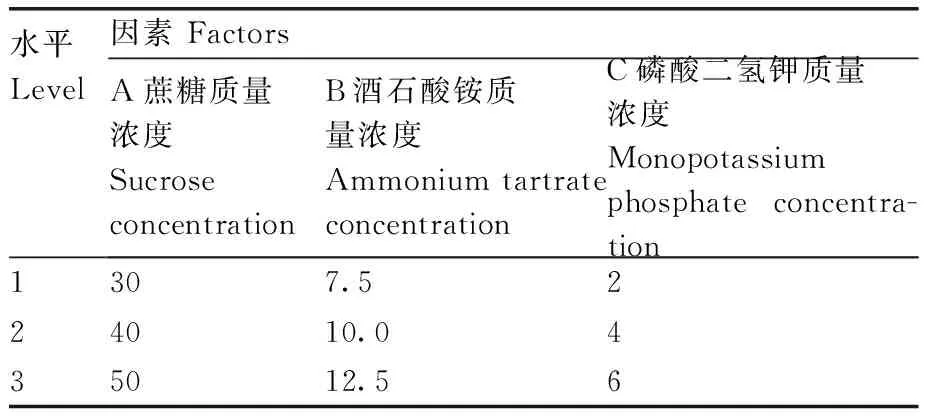
表1 正交试验因素与水平设置表Table 1 The factor and level of orthogonal experiment g·L-1
1.4 数据处理
用MEGA5.0软件进行多序列比对并构建系统发育树。采用WPS和SPSS软件分析试验数据,利用Origin软件作图。
2 结果与分析
2.1 金耳类酵母型菌株分离鉴定
子实体悬挂2 d后,培养基表面有水珠状凸起的孢子印,4 d后形成乳白色菌落(图1-A),平板划线得到金耳类酵母型菌株单菌落,命名为EF145。EF145菌株的菌落为乳白色、表面凸起、光滑、湿润(图1-B)。PDB培养基培养5 d的发酵液为乳白色黏稠液体,无颗粒,质地均匀,无异味(图1-C)。显微镜观察发现,EF145菌株单个细胞为卵圆形,大小约为(2.5~4.0)μm×(2.0~4.0)μm,出芽增殖(图1-D)。
以ITS1、ITS4为引物进行PCR扩增,凝胶电泳检测结果如图2所示:金耳子实体PCR产物为2条分子量不同的条带(大条带编号为1.1,小条带编号为1.2),从分子水平证明金耳子实体是由2种菌丝构成。EF145菌株的PCR产物只1个条带,其分子量与金耳子实体小条带一致。
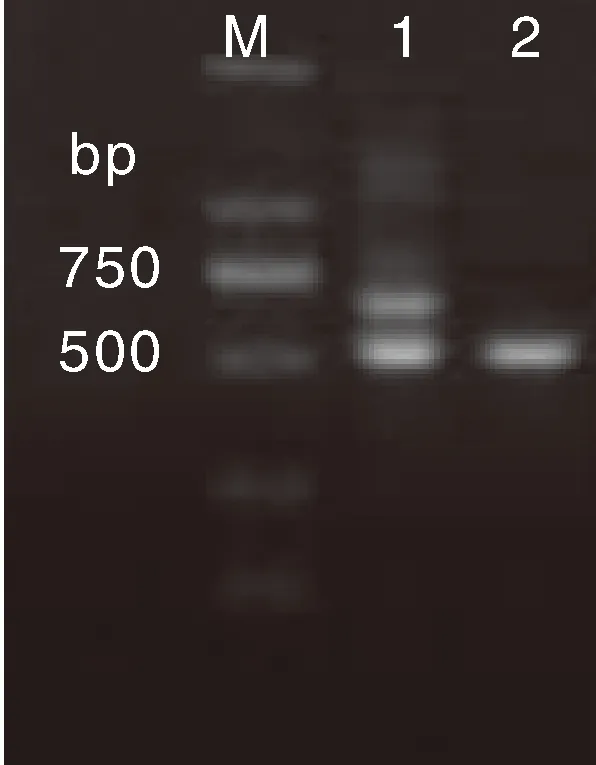
M,DL2000 marker;1,金耳子实体;2,EF145 菌株。M, DL2000 marker; 1, Fruiting body of Tremella aurantialba; 2. Strain EF145.图2 PCR产物电泳图Fig.2 Electrophorogram of PCR products
测序结果显示,金耳子实体小条带的碱基数量为481,EF145菌株的PCR扩增产物的碱基数量为478,两者基本一致。BLAST比对显示两者均与金耳(Tremellaaurantialba)同源性最高,为96%~98%,证明本实验通过担孢子弹射法获得的菌株确为金耳。系统发育树(图3)显示,EF145菌株与金耳子实体小条带(1.2)聚为一小支,且两者与金耳聚为一支,遗传距离最小,亲缘关系最近。
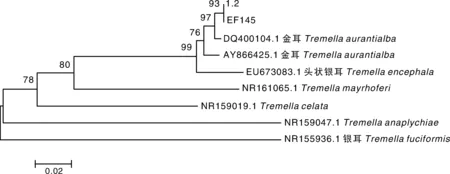
图3 EF145菌株系统发育树Fig.3 Phylogenetic tree of strain EF145
2.2 金耳胞外多糖抗氧化能力测定
如4图所示,金耳胞外多糖对羟自由基、DPPH自由基、超氧阴离子自由基均有一定的清除能力,其中,金耳胞外多糖对羟自由基和超氧阴离子的清除率较高,分别为56.67%和51.73%,对DPPH自由基清除能力较差,仅为17.43%。

图4 金耳胞外多糖抗氧化能力测定Fig.4 Determination of antioxidant capacity of exopolysaccharide from T.aurantialba EF145
2.3 高产胞外多糖培养基优化
2.3.1 最佳碳源、氮源和无机盐筛选
如图5-A所示,胞外多糖产量较高的几种碳源分别是葡萄糖、蔗糖、乳糖,其中以蔗糖为碳源时胞外多糖产量达到最高,为(4.180±0.176)g·L-1。麦芽糖为碳源时胞外多糖产量最低。无机氮源酒石酸铵最有利于胞外多糖的产生,其产量达到(3.936±0.449)g·L-1,显著高于其他4种有机氮源(图5-B)。如图5-C所示,以磷酸二氢钾为无机盐时,胞外多糖产量最高,为(3.367±0.133)g·L-1,显著(P<0.05)高于其他无机盐。以氯化钠为无机盐时多糖产量最低。
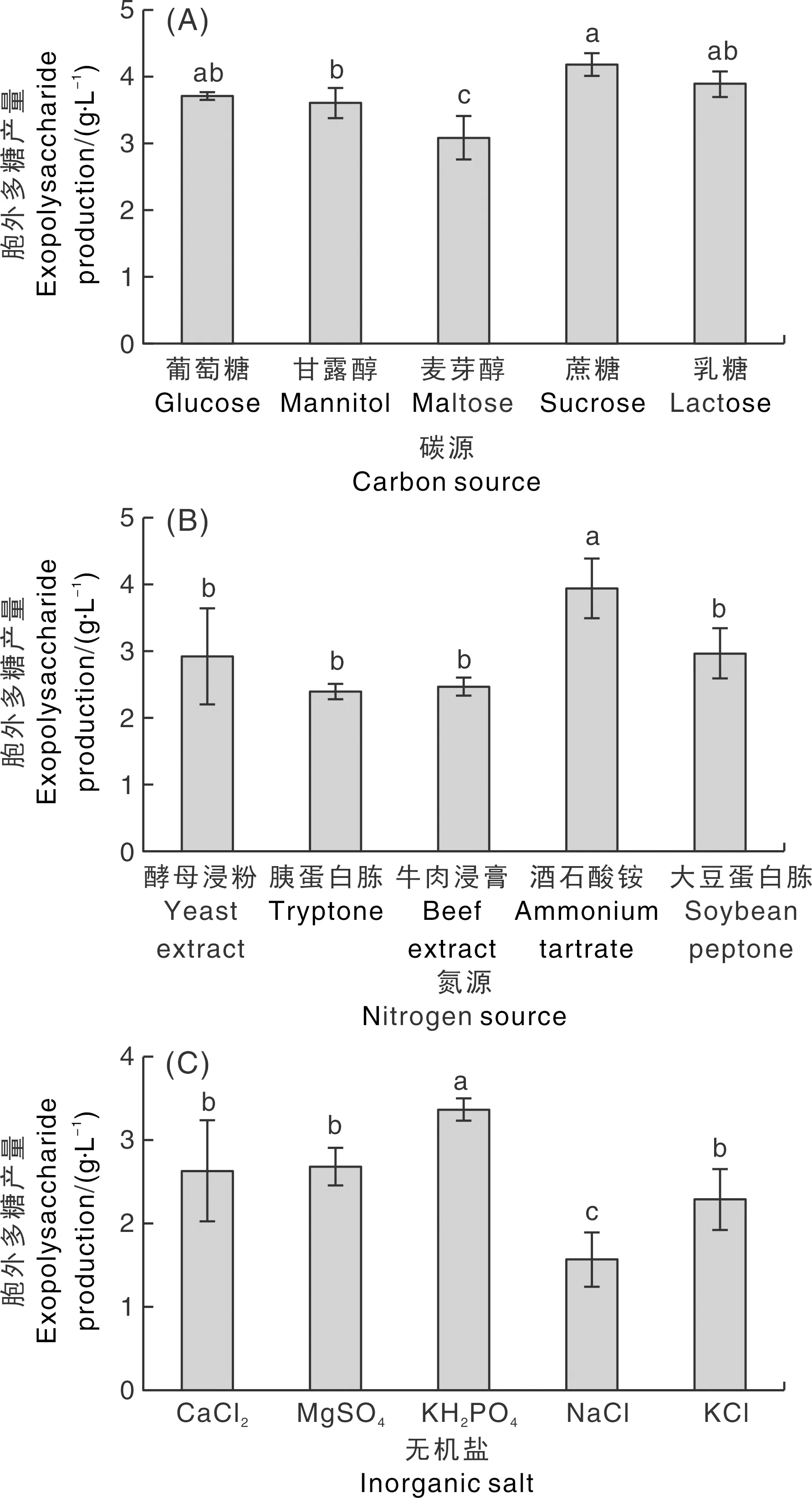
柱上无相同小写字母表示差异显著(P<0.05)。下同。Data marked without the same lowercase letter indicated significant differences at P<0.05.The same as below.图5 碳源、氮源和无机盐对胞外多糖产量的影响Fig.5 Effect of carbon sources, nitrogen sources and inorganic salts on exopolysaccharide production
2.3.2 单因素试验
在确定最佳碳源、氮源和无机盐的基础上,探究浓度对胞外多糖产量的影响,结果如下:随着蔗糖质量浓度增大,胞外多糖产量先升高后下降,当蔗糖质量浓度达到40 g·L-1时胞外多糖产量达到最高,继续增大蔗糖质量浓度多糖产量下降(图6-A),故40 g·L-1为最佳蔗糖质量浓度。

图6 蔗糖(A)、酒石酸铵(B)、磷酸二氢钾(C)质量浓度对胞外多糖产量的影响Fig.6 Effect of concentration of sucrose (A), ammonium tartrateon (B) and monopotassium phosphate (C) on exopolysaccharide production
当酒石酸铵质量浓度达到10.0 g·L-1时,胞外多糖的产量最高,质量浓度继续增大胞外多糖产量无显著性变化(图6-B),考虑经济因素选择10.0 g·L-1为最佳酒石酸铵质量浓度。较低质量浓度的磷酸二氢钾就可促进胞外多糖的产生,质量浓度增高胞外多糖的产量反而有所下降,当质量浓度达到10 g·L-1时会抑制胞外多糖的产生(图6-C),故磷酸二氢钾的最佳质量浓度为4 g·L-1。
2.3.3 正交试验优化
正交试验结果如表2。极差分析结果如表3所示。通过极差R值可以看出,蔗糖质量浓度(A)、酒石酸铵质量浓度(B)、磷酸二氢钾质量浓度(C)对胞外多糖产量的影响依次为A>C>B。根据k值可以看出,高产胞外多糖培养基最优组合为A2B1C2,即蔗糖40 g·L-1、酒石酸铵7.5 g·L-1、磷酸二氢钾4 g·L-1。方差分析结果(表4)表明,蔗糖质量浓度、酒石酸铵质量浓度、磷酸二氢钾质量浓度均对胞外多糖产量有显著性影响。
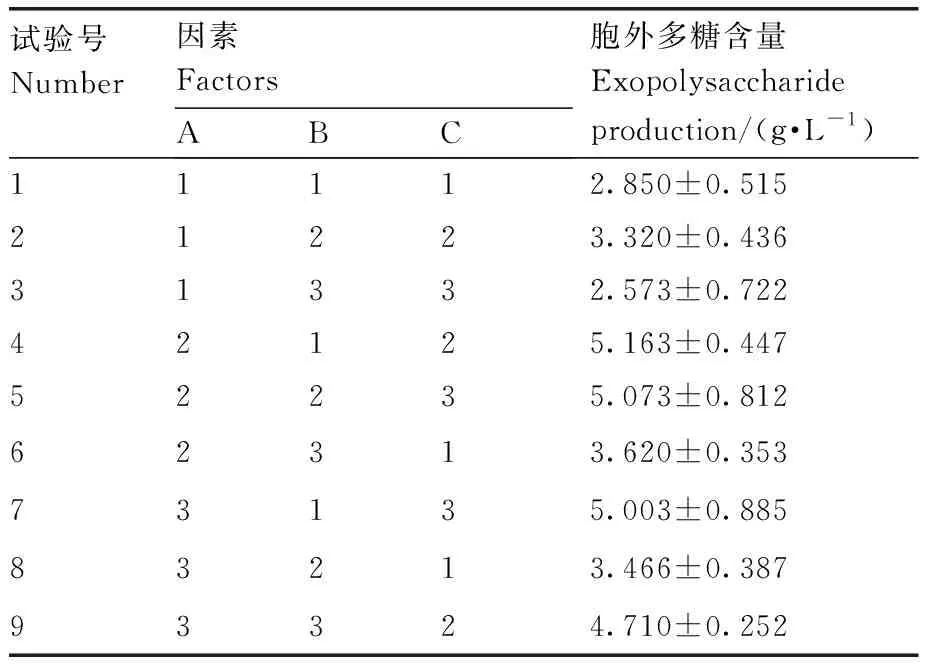
表2 正交试验结果Table 2 Results of orthogonal experiment
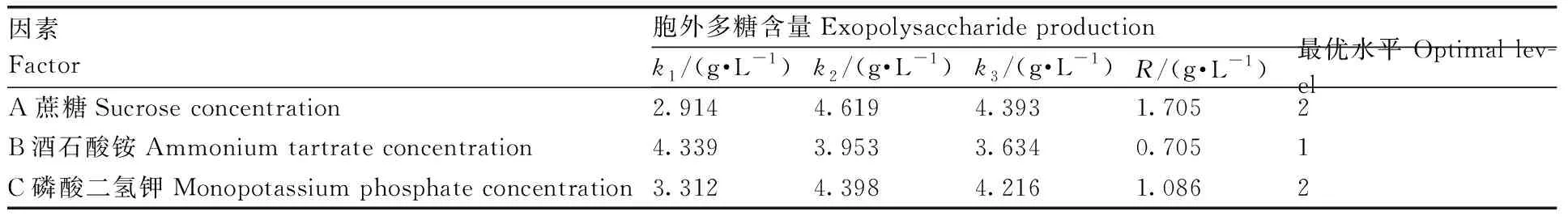
表3 极差分析结果Table 3 Result of range analysis
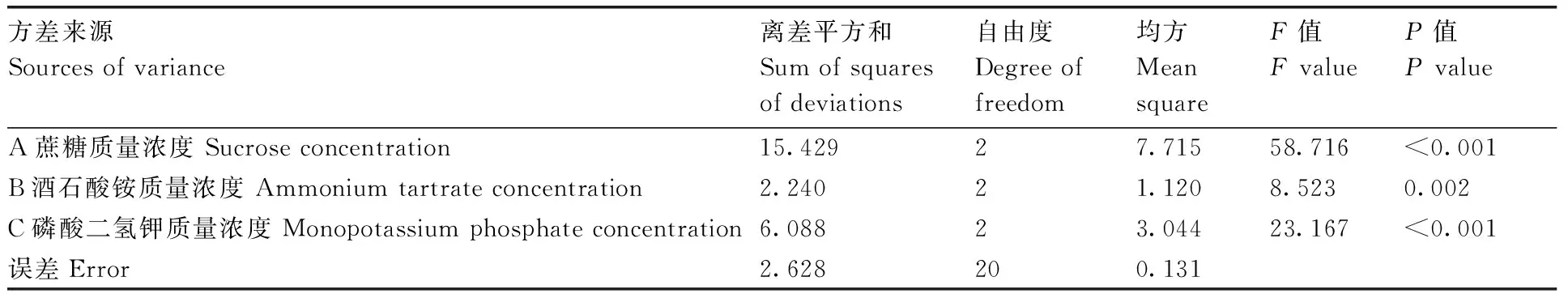
表4 正交试验方差分析结果Table 4 The variance analysis results of orthogonal experiment
根据最优培养基配方进行验证试验,以基础培养基作为对照,优化培养基后,胞外多糖产量达到(5.092±0.473)g·L-1,与基础培养基相比产量提高了56.78%。
3 结论与讨论
本文通过担孢子弹射法分离到了类酵母型菌株EF145,经分子生物学鉴定为金耳。金耳胞外多糖的羟自由基、超氧阴离子自由基和DPPH自由基的清除率分别为57.67%、51.73%和17.43%;EF145菌株产胞外多糖培养基的最佳配方为蔗糖40 g·L-1、酒石酸铵7.5 g·L-1、磷酸二氢钾4 g·L-1、土豆浸粉3 g·L-1、维生素B10.2 g·L-1。
金耳多糖是金耳主要的活性物质,由于金耳人工栽培困难,利用子实体提取多糖成本较高,液体发酵是金耳多糖工业化生产的有效解决方案,具有较好的应用前景[17-18]。金耳有菌丝型和和类酵母型2种类型。菌丝型金耳生活能力差,需要伴生菌的帮助才能正常地生长发育。通过组织分离获得的菌种均为金耳和伴生菌的混合菌种,这种菌种无法确定二者的数量关系[19-20],发酵产物不稳定。类酵母型金耳可以像酵母菌一样通过出芽方式快速生长繁殖,利用此菌种可以发酵产生纯正的金耳多糖[21],故利用金耳类酵母型菌株生产金耳多糖是现阶段发酵金耳多糖的主要途径。笔者在研究时发现,在分离金耳类酵母型菌株时经常会有隐球酵母污染,其形态与金耳类酵母型菌株非常相似且亦会产生大量多糖,故在分离到酵母样细胞后需要对其进行分子生物学鉴定以排除隐球酵母污染。
本文获得了金耳类酵母型菌株,优化了高产金耳胞外多糖发酵培养基,并初步探讨了金耳多糖的抗氧化性,为金耳多糖的发酵生产和开发利用提供了一定的数据支持。

