肉制品中猪肉源成分的Proofman-梯型熔解温度等温扩增检测
王博锐 许丹丹 谷蒙林 姚蔚 王耀 肖付刚 王德国

摘 要:建立一种基于Proofman探针(proofreading enzyme-mediated probe cleavage)的梯型熔解温度等温扩增(ladder-shape melting temperature isothermal amplification,LMTIA)方法检测肉制品中的猪肉成分。选取猪细胞核中的特异性基因PRLR为靶基因,设计LMTIA引物和Proofman探针。通过优化反应体系,对所建立的方法进行特异性、灵敏度和最低检测限结果评价。结果表明:所建立的Proofman-LMTIA方法可在30 min内完成检测;相对于从鸡肉、鸭肉、牛肉、羊肉、猫肉、狗肉、玉米淀粉、红薯淀粉、木薯淀粉、绿豆淀粉、小麦粉中提取的基因组DNA,可特异性检测猪基因组DNA;检测灵敏度为1 ng/μL,对人工模拟的混合肉样中猪肉的最低检测限为0.1%。所建立的Proofman-LMTIA方法对猪肉成分有较好的特异性,能够快速、准确检测出肉制品中的猪肉成分,可对猪肉掺假进行快速检测。
关键词:Proofman探针;梯型熔解温度等温扩增技术;猪肉;快速检测
Development of Proofman-Ladder-Shape Melting Temperature Isothermal Amplification Method for
Detection of Pig-Derived Components in Meat Products
WANG Borui1,2, XU Dandan1,2, GU Menglin2,3, YAO Wei1,2, WANG Yao1, XIAO Fugang2, WANG Deguo2,*
(1.College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471000, China;
2.Key Laboratory of Biomarker Based Rapid-Detection Technology for Food Safety of Henan Province,
College of Food and Pharmacy, Xuchang University, Xuchang 461000, China; 3.College of Food Science and Engineering,
Henan University of Technology, Zhengzhou 450001, China)
Abstract: The study aimed to establish a proofreading enzyme-mediated probe cleavage combined with ladder-shape melting temperature isothermal amplification (Proofman-LMTIA) method for detection of pig-derived components in meat products. The LMTIA primers and Proofman probes were designed using the porcine prolactin receptor (PRLR) gene as the target. The LMTIA reaction system was optimized, and the specificity, sensitivity and limit of detection (LOD) of the proposed method were determined. The results showed that the amplification could be completed within 30 min, and the Proofman-LMTIA method could specifically detect the genomic DNA of pigs rather than of chicken, ducks, cattle, sheep, dogs, sweet potato, cassava, mung bean and wheat. The sensitivity was 1 ng/μL, and the LOD for artificially adulterated meat samples was 0.1%. The Proofman-LMTIA method has high specificity for pig-derived components, and can quickly and accurately detect pig-derived components in meat products and rapidly detect meat adulteration.
Keywords: proofreading enzyme-mediated probe cleavage; ladder-shape melting temperature isothermal amplification; pork; rapid detection
DOI:10.7506/rlyj1001-8123-20221215-156
中圖分类号:TS251.51 文献标志码:A 文章编号:1001-8123(2023)03-0028-05
引文格式:
王博锐, 许丹丹, 谷蒙林, 等. 肉制品中猪肉源成分的Proofman-梯型熔解温度等温扩增检测[J]. 肉类研究, 2023, 37(3): 28-32. DOI:10.7506/rlyj1001-8123-20221215-156. http://www.rlyj.net.cn
WANG Borui, XU Dandan, GU Menglin, et al. Development of proofman-ladder-shape melting temperature isothermal amplification method for detection of pig-derived components in meat products[J]. Meat Research, 2023, 37(3): 28-32.
(in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20221215-156. http://www.rlyj.net.cn
隨着生活水平的不断提高,人们对肉类的需求逐渐变高,部分商家为了较高的商业利润,使用廉价的猪肉来代替昂贵的牛羊肉[1]。这种以次充好、以假乱真的现象损害了消费者的合法权益,扰乱了市场秩序[2]。尽管许多国家建立了肉制品的相关食品安全标准,要求肉制品标签需标注物种信息类别和含量[3],但是消费者从外观上还是很难分辨出掺假肉。因此,为了确保市场秩序的稳定和食品安全,需要一种简单实用、成本低廉的快速检测方法对肉及肉制品掺假进行检测。
目前肉类掺假检测方法主要分为基于蛋白质分子和基于DNA分子的检测技术[4]。其中基于蛋白质的检测技术有电泳法[5-6]、质谱技术[7-8]、酶联免疫吸附法[9-10]
和蛋白质组学[11]等。但蛋白质在加工过程中易发生变性,在对热加工处理的食品进行检测时有很大的局限性[12]。
而基于DNA分子的实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)[13-14]、数字PCR[15-16]、环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术[17-18]、滚环扩增技术[19-20]及重组酶聚合酶扩增技术[21-22]等检测方法凭借特异性强、灵敏度高等优点已成为目前肉类掺假的主要检测方法[23]。但这些技术存在引物设计困难、易产生假阳性、扩增时间长、对靶序列长度要求高等缺点,导致这些方法不能够得到更广泛的应用。因此,亟需建立一种快速、高效、操作简单、成本较低的检测新技术,以满足市场的需求。
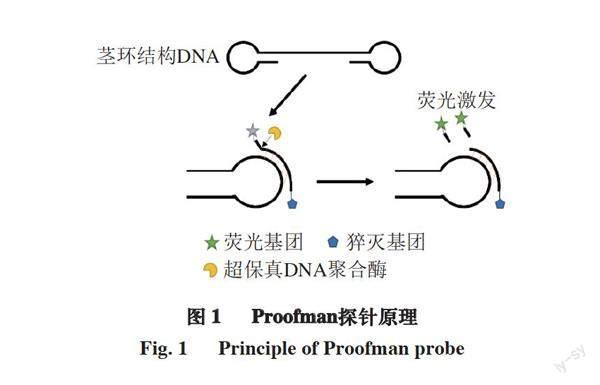
Wang Deguo等[24]在解决LAMP技术中的假阳性问题并阐明了单链模板的产生机理后,开发了一种新型核酸等温扩增技术——梯型熔解温度等温扩增(ladder-shape melting temperature isothermal amplification,LMTIA)技术。该技术引物设计简单、反应时间迅速、灵敏度高、所需靶序列短等[25],已应用于食品掺假检测[26-27]和病毒检测[28]中。本研究以猪细胞核中的催乳素受体(prolactin receptor,PRLR)[29]基因为靶标,将一种新型荧光杂交探针,即Proofman探针(proofreading enzyme-mediated probe cleavage)[30]与LMTIA技术相结合,其检测原理如图1所示。Proofman探针是根据LMTIA的环引物所设计,在Proofman探针的3端设计1 个错配碱基,将荧光基团标记在该错配碱基上,猝灭基团标记在探针的5端。反应开始时,在引物F和B的作用下,形成茎环结构DNA;Proofman探针与茎环结构进行互补配对,3端发生碱基错配,在超保真DNA聚合酶的作用下切除错配碱基,释放荧光基团,通过收集荧光信号即可对目标物质进行检测。旨在建立一种简单、快速的Proofman-LMTIA方法检测肉制品中的猪肉源基因,以期为市场上肉制品掺假提供一种快速、简便的检测方法。
1 材料与方法
1.1 材料与试剂
鲜肉(鸡肉、鸭肉、猪肉、羊肉、牛肉)、淀粉制品(玉米淀粉、红薯淀粉、木薯淀粉、绿豆淀粉、小麦粉)及加工肉制品(熟牛肉、熟羊肉、牛肉卷、羊肉卷)购于许昌各大超市;猫肉、狗肉购于淘宝网。
血液/细胞/组织基因组DNA提取试剂盒 天根生化科技(北京)有限公司;Nucleo Spin?Food试剂盒 德国Macherey-Nagel公司;通用型LMTIA反应预混液 德歌生物技术有限公司;GPV8超保真DNA聚合酶(2 U/?L) 通用生物系统有限公司。
1.2 仪器与设备
Gentier 96E全自动医用PCR分析系统 西安天隆科技有限公司;Nano Drop One超微量核酸蛋白测定仪、SCI-VS可调式混匀仪 美国Thermo公司;1-15K高速冷冻离心机 德国Sigma公司;F6/10匀浆机 上海净信科技有限公司;Archimed时间分辨荧光定量PCR系统 鲲鹏基因(北京)科技有限责任公司。
1.3 方法
1.3.1 模拟样品的制备
将所购鸡肉、鸭肉、猪肉、羊肉、牛肉、猫肉、狗肉等肉类去除表皮、脂肪和骨头后使用匀浆机打成肉糜,于-20 ℃保存。
以牛羊肉为基质,向其中加入质量分数分别为0%、0.1%、1.0%、5.0%、10.0%、20.0%、100.0%的猪肉。参考Chen Xiaoyu等[31]的方法进行模拟样品的制备:以牛肉为例,使用高速匀浆机将肉糜状的牛肉(80 g)与猪肉(20 g)间歇性混合5 min,得到猪肉质量分数为20.0%的样品(编号为A1);将50 g牛肉糜与50 g A1间歇性混合5 min,得到猪肉质量分数为10.0%的样品(编号为A2);将50 g牛肉糜与50 g A2间歇性混合5 min,得到猪肉质量分数为5.0%的样品(编号为A3);用上述方法依次制备质量分数为1.0%(A4)、0.1%(A5)的混合肉样。再以同样的方法制备以羊肉为基质的猪肉混合肉样。其中在进行肉糜混合时加入了不影响反应的有色染料,混合至颜色均匀,每组实验设置5 个平行。所有样品保存于-20 ℃备用。
1.3.2 DNA提取
称取100 mg各样品的肉糜及1.3.1节所制备的模拟肉样,使用血液/细胞/组织基因组DNA提取试剂盒提取肉样DNA。称取玉米淀粉、红薯淀粉、木薯淀粉、绿豆淀粉等样品各200 mg,使用Nucleo Spin?Food试剂盒提取各植物淀粉DNA。提取完成后使用超微量核酸蛋白测定仪测定DNA的浓度和纯度,A260 nm/A280 nm为1.6~2.0可用于LMTIA。所提取的DNA均于-20 ℃保存。
1.3.3 LMTIA引物和Proofman探针设计
根据GenBank数据库中公布的猪源基因,本研究选取猪细胞核中的高度保守序列PRLR(GenBank ID:DQ453511.1)为靶标,将该段序列使用Oligo 7软件进行分析,选取具有梯型熔解温度的片段,再使用Primer 3 Plus在线软件(http://www.primer3plus.com)进行LMTIA引物设计。根据环引物来设计Proofman探针,荧光基团标記在3端错配的碱基上,猝灭基团标记在5端碱基末端。用于LMTIA的引物序列和Proofman探针序列见表1。引物及探针均由通用生物系统(安徽)有限公司合成。
1.3.4 反应温度优化
使用10 ?L的反应体系进行LMTIA反应温度的优化,反应体系为:1.3 μmol/L引物F、B,0.6 μmol/L引物LF、0.3 μmol/L引物LB和探针、1×通用型LMTIA反应预混液1 μL(20 mmol/L Tris-HCl(pH 8.8)、10 mmol/L KCl、10 mmol/L (NH4)2SO4、6 mmol/L MgSO4、0.1% TritonTM X-100)、0.32 U/μL Bst DNA聚合酶和2 μL提取的猪肉基因组DNA。反应温度设置为57、58、59、60 ℃,反应条件为90 s采集一次荧光信号,共40 个循环。
1.3.5 灵敏度测定
将提取的猪肉基因组DNA梯度稀释至10、1 ng/μL和100、10、1 pg/μL,测定所建立的Proofman-LMTIA检测方法的灵敏度。由于样品新鲜度、人为因素和DNA降解等原因都有可能造成检测结果不一致,故每次实验进行5 次重复,以保证检测结果的准确性。
1.3.6 特异性分析
以H2O为阴性对照,猪肉基因组DNA为阳性对照,向优化好的LMTIA反应体系中加入从鸡肉、鸭肉、牛肉、羊肉、猫肉、狗肉、玉米淀粉、红薯淀粉、木薯淀粉、绿豆淀粉、小麦粉中提取的基因组DNA,观察扩增结果。
1.3.7 猪肉样品检测限测定
将所提取的猪肉质量分数分别为0%、0.1%、1.0%、5.0%、10.0%、20.0%、100.0%的混合肉样DNA分别加入到优化的Proofman-LMTIA反应体系中,每组实验重复2 次,观察扩增结果。
1.3.8 实际样品猪肉源成分检测
利用本研究建立的Proofman-LMTIA检测方法与实时荧光定量PCR检测方法(猪肉源实时荧光定量PCR检测试剂盒)对市售牛羊肉及其制品进行猪肉源成分检测,对检测结果进行分析比较。
1.4 数据处理
使用Gentier 96E全自动医用PCR分析系统(V1)对检测结果进行分析,获取扩增曲线图,再使用Excel、PowerPoint软件对结果和扩增图进行分析处理。
2 结果与分析
2.1 反应温度优化结果
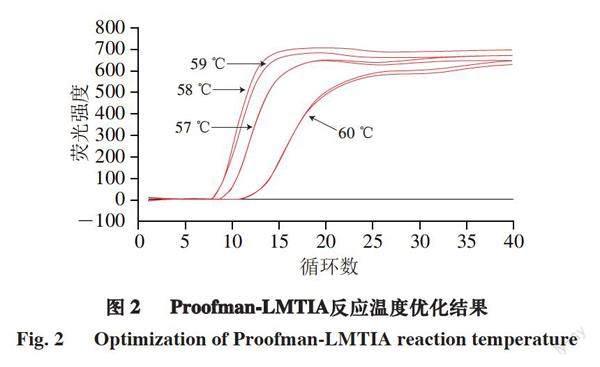
由图2可知,反应温度对扩增效率的影响较大,在58 ℃和59 ℃时阴性对照不扩增,阳性对照扩增效率最好,结合后续特异性和灵敏度实验选择58 ℃作为Proofman-LMTIA反应体系的最适温度。
2.2 灵敏度测定结果
使用优化好的反应体系和最适温度对梯度稀释至10、1 ng/μL和100、10、1 pg/μL的猪肉基因组DNA进行测定。由图3可知,10 ng/μL和1 ng/μL的DNA发生扩增,而100、10、1 pg/μL和阴性对照均未出现扩增。因此,该方法对猪基因组DNA的检测灵敏度为1 ng/μL。
2.3 特异性分析结果
由图4可知,只有猪DNA发生扩增,其余DNA及阴性对照均未扩增。说明该引物特异性较强,能够区分猪DNA和其他物种DNA,能够进行肉制品中猪源基因的检测。
2.4 猪肉样品检测限测定结果
1~6. 猪肉质量分数分别为100.0%、20.0%、10.0%、5.0%、1.0%、0.1%的混合肉样;7. 阴性对照及猪肉质量分数为0%的混合肉样。
由图5可知,所制备的猪肉质量分数分别为0%、0.1%、1.0%、5.0%、10.0%、20.0%、100.0%的混合模拟肉样在20 个循环数以内只有质量分数为0%的模拟肉样和阴性对照未发生扩增,其余均发生扩增。说明该方法能在30 min之内检出猪肉质量分数为0.1%及以上的掺假样品,即每1 kg肉制品中掺入1 g猪肉也可被检出。
2.5 实际样品检测结果
用所建立的猪肉源基因Proofman-LMTIA检测方法对24 份市售牛羊肉及其肉制品进行检测,由表2可知,本研究建立的猪肉源Proofman-LMTIA检测方法与实时荧光定量PCR检测方法的检测结果一致,总符合率为100.0%。由于目前样品数量不多,阳性样品检出数较少,后续将增加样品数量以验证2 种方法的一致性。
3 结 论
本研究建立了一种基于Proofman探针的LMTIA方法以检测肉制品中的猪肉源基因,将Proofman探针和超保真酶加入到LMTIA反应体系中,更好地实现了反应的不开盖、可视实时检测。本方法选取猪细胞核中单拷贝的PRLR基因,对所测试的十几种非目标DNA无交叉反应,具有较强的特异性,且可检测到灵敏度为1 ng/μL的猪基因组DNA。对混合模拟肉样的检测,检测限达到0.1%。较其他分子生物学检测方法具有相同或更高的检测限,如TaqMan实时荧光PCR法的检出限为5.0%[32],可视化LAMP方法的检出限为1%[17]。但目前本研究只能够检测肉制品中的猪肉源成分,无法检测是否掺入鸡鸭肉成分,故还不能得到更好的应用,后续将致力于结合不同的荧光基团,做到高效、快速进行多物种同时检测,早日应用于肉制品掺假的市场监管中。
本研究建立的Proofman-LMTIA检测方法具有操作简单、灵敏度高、特异性强、反应时间短、适用范围广等优点,可作为肉制品掺假快速检测的有效手段,为规范肉制品市场秩序提供技术支持。
参考文献:
[1] ZHANG Wenjing, XUE Jianhong. Economically motivated food fraud and adulteration in China: an analysis based on 1553 media reports[J]. Food Control, 2016, 67: 192-198. DOI:10.1016/j.foodcont.2016.03.004.
[2] QIN Panzhu, LI Yulin, YAO Bangben, et al. Rational incorporating of loop-mediated isothermal amplification with fluorescence anisotropy for rapid, sensitive and on-site identification of pork adulteration[J]. Food Control, 2022, 137: 108863. DOI:10.1016/j.foodcont.2022.108863.
[3] FLOREN C, WIEDEMANN I, BRENIG B, et al. Species identification and quantification in meat and meat products using droplet digital PCR (ddPCR)[J]. Food Chemistry, 2015, 173: 1054-1058. DOI:10.1016/j.foodchem.2014.10.138.
[4] 秦盼柱, 陸剑锋, 陈伟. 基于功能化引物设计的荧光比色法检测牛肉品中鸭肉掺假成分[J]. 合肥工业大学学报(自然科学版), 2020, 43(6): 844-848. DOI:10.3969/j.issn.1003-5060.2020.06.022.
[5] KIM G D, SEO J K, YUM H W, et al. Protein markers for discrimination of meat species in raw beef, pork and poultry and their mixtures[J]. Food Chemistry, 2017, 217: 163-170. DOI:10.1016/j.foodchem.2016.08.100.
[6] MONTOWSKA M, POSPIECH E. Species-specific expression of various proteins in meat tissue: proteomic analysis of raw and cooked meat and meat products made from beef, pork and selected poultry species[J]. Food Chemistry, 2013, 136(3): 1461-1469. DOI:10.1016/j.foodchem.2012.09.072.
[7] SARAH S A, FARADALILA W N, SALWANI M S, et al. LC-QTOF-MS identification of porcine-specific peptide in heat treated pork identifies candidate markers for meat species determination[J]. Food Chemistry, 2016, 199: 157-164. DOI:10.1016/j.foodchem.2015.11.121.
[8] 古淑青, 詹丽娜, 赵超敏, 等. 基于液相色谱-串联质谱法的肉类特征肽段鉴别及掺假测定[J]. 色谱, 2018, 36(12): 1269-1278. DOI:10.3742/SP.J.1123.2018.08005.
[9] THIENES C P, MASIRI J, BENOIT L A, et al. Quantitative detection of pork contamination in cooked meat products by ELISA[J]. Journal of AOAC International, 2018, 101(3): 810-816. DOI:10.5740/jaoacint.17-0036.
[10] BENLI H, BARUT?U E. Sequential use of real-time polymerase chain reaction and enzyme-linked immunosorbent assay techniques verifies adulteration of fermented sausages with chicken meat[J]. Animal Bioscience, 2021, 34(12): 1995-2002. DOI:10.5713/ab.21.0139.
[11] 王忠合, 胡文梅, 卢燎源, 等. 非标记蛋白组学法鉴别牛肉丸中肉类掺假的方法研究[J]. 中国食品学报, 2022, 22(4): 295-308. DOI:10.16429/j.1009-7848.2022.04.029.
[12] 施姿鶴, VOGLMEIR J, 刘丽. 肉及其加工制品的掺假鉴别技术研究进展[J]. 食品科学, 2019, 40(23): 319-326. DOI:10.7506/spkx1002-6630-20181229-354.
[13] LI Jiapeng, WEI Yixuan, LI Jinchun, et al. A novel duplex SYBR Green real-time PCR with melting curve analysis method for beef adulteration detection[J]. Food Chemistry, 2021, 338: 127932. DOI:10.1016/j.foodchem.2020.127932.
[14] SARLAK Z, SHOJAEE-ALIABADI S, REZVANI N, et al. Development and validation of TaqMan real-time PCR assays for quantification of chicken adulteration in hamburgers[J]. Journal of Food Composition and Analysis, 2022, 106: 104302. DOI:10.1016/j.jfca.2021.104302.
[15] HE Chuan, BAI Lan, CHEN Yifan, et al. Detection and quantification of adulterated beef and mutton products by multiplex droplet digital PCR[J]. Foods, 2022, 11(19): 3034. DOI:10.3390/foods11193034.
[16] 任君安, 邓婷婷, 黄文胜, 等. 微滴式数字聚合酶链式反应精准定量检测羊肉中掺杂猪肉[J]. 食品科学, 2017, 38(2): 311-316. DOI:10.7506/spkx1002-6630-201702049.
[17] 朱凯, 康怀彬, 王德国. 可视化LAMP检测常见肉制品中猪肉成分[J].
食品科学, 2019, 40(12): 296-302. DOI:10.7506/spkx1002-6630-20180526-369.
[18] ZHANG Huang, CAO Weiwei, ZHANG Yilin, et al. Identification for meat adulteration (pork, beef, sheep and duck) in foodstuff by microfluidic chip-based real-time fluorescent LAMP[J]. Journal of Food Composition and Analysis, 2023, 119: 105223.
[19] HU Xuejia, XU Hui, ZHANG Yunzhe, et al. Saltatory rolling circle amplification (SRCA) for sensitive visual detection of horsemeat adulteration in beef products[J]. European Food Research and Technology, 2021, 247(11): 2667-2676. DOI:10.1007/s00217-021-03720-2.
[20] 胡学佳, 卢鑫, 张蕴哲, 等. 可视化跨越式滚环等温扩增技术在猪肉掺假检测中的应用[J]. 食品工业科技, 2020, 41(24): 75-80. DOI:10.13386/j.issn1002-0306.2020040328.
[21] FU Ming, ZHANG Quanwang, ZHOU Xiang, et al. Recombinase polymerase amplification based multiplex lateral flow dipstick for fast identification of duck ingredient in adulterated beef[J]. Animals, 2020, 10(10):1765. DOI:10.3390/ani10101765.
[22] KISSENK?TTER J, B?HLKEN-FASCHER S, FORREST M S, et al. Recombinase polymerase amplification assays for the identification of pork and horsemeat[J]. Food Chemistry, 2020, 322: 126759. DOI:10.1016/j.foodchem.2020.126759.
[23] 胡谦, 陈颖, 倪凯, 等. 肉制品异源基因检测技术研究进展[J]. 食品科学, 2018, 39(15): 275-282. DOI:10.7506/spkx1002-6630-201815040.
[24] WANG Deguo, WANG Yongzhen, ZHANG Meng, et al. Ladder-shape melting temperature isothermal amplification of nucleic acids[J]. BioTechniques, 2021, 71(1): 358-369. DOI:10.2144/btn-2020-0173.
[25] 王德国, 张萌, 王永真, 等. 梯型熔解温度等温扩增检测食品中植物源成分的内标方法构建[J]. 食品安全质量检测学报, 2021, 12(21): 8439-8445. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.21.019.
[26] WANG Yongzhen, WANG Borui, WANG Deguo. Detection of chicken adulteration in beef via ladder-shape melting temperature isothermal amplification (LMTIA) assay[J]. Biotechnology and Biotechnological Equipment, 2022, 36(1): 339-345. DOI:10.1080/13102818.2022.2081514.
[27] ZHANG Yongqing, WANG Yongzhen, OUYANG Xingmei, et al.
Development of a ladder-shape melting temperature isothermal amplification (LMTIA) assay for the identification of cassava component in sweet potato starch noodles[J]. Molecules, 2022, 27(11): 3414. DOI:10.3390/molecules27113414.
[28] WANG Yongzhen, WANG Borui, XU Dandan, et al. Development of a ladder-shape melting temperature isothermal amplification (LMTIA) assay for detection of African swine fever virus (ASFV)[J]. Journal of Veterinary Science, 2022, 23(4): e51. DOI:10.4142/jvs.22001.
[29] BIGNON C, BINART N, ORMANDY C, et al. Long and short forms of the ovine prolactin receptor: cDNA cloning and genomic analysis reveal that the two forms arise by different alternative splicing mechanisms in ruminants and in rodents[J]. Journal of Molecular Endocrinology, 1997, 19(2): 109-120. DOI:10.1677/jme.0.0190109.
[30] DING Sheng, CHEN Gangyi, WEI Yinghua, et al. Sequence-specific and multiplex detection of COVID-19 virus (SARS-CoV-2) using proofreading enzyme-mediated probe cleavage coupled with isothermal amplification[J]. Biosensors and Bioelectronics, 2021, 178: 113041. DOI:10.1016/j.bios.2021.113041.
[31] CHEN Xiaoyu, LU Lixia, XIONG Xiaohui, et al. Development of a real-time PCR assay for the identification and quantification of bovine ingredient in processed meat products[J]. Scientific Reports, 2020, 10(1): 2052. DOI:10.1038/s41598-020-59010-6.
[32] 杨瑶, 斯能武, 严钰澳, 等. 实时荧光PCR定量检测肉制品中猪源性成分[J]. 食品工业科技, 2022, 43(3): 268-274. DOI:10.13386/j.issn1002-0306.2021050232.
收稿日期:2022-12-15
基金项目:国家自然科学基金青年科学基金项目(31701689);国家自然科学基金面上项目(32172300);
河南省科技攻关项目(212102110214);河南省高校重点研发项目(21B550006)
第一作者简介:王博锐(1997—)(ORCID: 0000-0003-2275-7525),男,硕士研究生,研究方向为食品质量与安全快速检测。
E-mail: wangborui1997@163.com
通信作者简介:王德国(1975—)(ORCID: 0000-0003-0594-9533),男,教授,博士,研究方向為食品质量与安全快速检测。
E-mail: wangdg666@126.com

