利用可视基因膜芯片技术与实时荧光定量聚合酶链式反应技术分析肉制品中动物源性成分
邵彪 高利亭 徐陈红 张霞 陈刚 汪少芸

摘 要:为调查了解肉制品中动物源性成分,以帮助判别掺假情况,应用可视基因膜芯片检测技术对市售的肉松、香肠、肉卷、预制调理肉、肉干及肉脯等23 份样品动物源性成分进行筛查分析,同时,针对筛查结果采用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)法进一步确证。结果表明:可视基因膜芯片检测法与实时荧光定量PCR法检测结果一致,提高了未知样品的筛查效率;在本次随机分析的样品中,动物源性成分检测结果与标签标示不一致的情况占比高达21.7%,肉制品掺假虚标情况不容忽视。
关键词:可视基因膜芯片;实时荧光定量聚合酶链式反应;肉制品;动物源性成分;掺假
Analysis of Animal Derived Ingredients in Meat Products by using Optical Gene Thin-Film Biosensor Chips and Real-Time Fluorescence Quantitative Polymerase Chain Reaction (RT-qPCR)
SHAO Biao1, GAO Liting1, XU Chenhong1, ZHANG Xia1, CHEN Gang1, WANG Shaoyun2,*
(1.Nantong Products Quality Supervision and Inspection Institute, Nantong 226011, China;
2.College of Biological Science and Engineering, Fuzhou University, Fuzhou 350108, China)
Abstract: For the purse of investigating animal derived ingredients in meat products in order to help in identifying adulteration in meat products, optical gene thin-film biosensor chip technology was used to screen and analyze the animal derived components of 23 samples of meat floss, sausage, meat roll, pre-processed meat and dried meat sold on the market. The obtained results were consistent with those of real-time fluorescent quantitative polymerase chain reaction (RT-qPCR). The biosensor chip enabled more efficient screening of unknown samples. When random samples were analyzed using the biosensor chip, the results for 21.7% of these samples were inconsistent with the label information, so adulteration and false labeling of meat products should not be ignored.
Keywords: optical gene thin-film biosensor chips; real time fluorescent quantitative polymerase chain reaction; meat products; animal derived ingredients; adulteration
DOI:10.7506/rlyj1001-8123-20221027-143
中图分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2023)03-0007-07
引文格式:
邵彪, 高利亭, 徐陈红, 等. 利用可視基因膜芯片技术与实时荧光定量聚合酶链式反应技术分析肉制品中动物源性成分[J].
肉类研究, 2023, 37(3): 7-13. DOI:10.7506/rlyj1001-8123-20221027-143. http://www.rlyj.net.cn
SHAO Biao, GAO Liting, XU Chenhong, et al. Analysis of animal derived ingredients in meat products by using optical gene thin-film biosensor chips and real-time fluorescence quantitative polymerase chain reaction (RT-qPCR)[J]. Meat Research, 2023, 37(3): 7-13. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20221027-143. http://www.rlyj.net.cn
肉类是人类饮食结构中不可或缺的组成部分。随着我国居民消费水平的提高,对肉类的需求量逐年增加,据统计,2021年国内畜禽肉总产量达9 645 万t,居世界之首。肉制品是以畜禽肉为主要原料,经调味后采用不同加工工艺制作的熟肉制成品或半成品,因风味独特、口感多样、便于加工、贮藏等特点深受人们喜爱,常见的如香肠、火腿、肉松、肉干、肉铺、肉串、培根、腌腊肉、酱卤肉、烧烤肉和肉罐头等。然而,由于不同动物来源的肉类价格差异较大,在利益的驱动下,肉制品中掺假掺杂现象屡见不鲜,不法商人利用加工过程绞碎、成形、腌制、热处理等工艺对原有形状的改变,并借助调味料、食品添加剂的掩饰,将价格低廉的肉类冒充或掺入到价格较高的肉类中,达到以假乱真的目的。肉制品掺假不仅直接损害消费者的经济利益,而且带来潜在的安全风险,如存在不明来源肉类药物残留超标、疫病风险、过敏原危害及添加剂危害等问题,此外,还涉及民族信仰与宗教伦理问题[1-3]。因此,对肉制品掺假实施监管非常必要。
围绕肉类掺假甄别,国内外已开发出很多种分析检测方法,包括:波谱分析法,如红外光谱法[4-5]、拉曼光谱法[6-7]、核磁共振法[8-9]、高光谱成像法[10-11]等;蛋白质分析法,如电泳法[12]、色谱法[13]、酶联免疫法[14]、
质谱法[15-16];分子生物学分析法,如普通聚合酶链式反应(polymerase chain reaction,PCR)法[17-18]、荧光定量PCR法[19-20]、等温扩增法[21-22]、限制性片段长度多态性分析法[23-24]、DNA条形码鉴别技术[25-26]、数字
PCR法[27-29]等。由于肉制品加工工艺复杂,通常涉及调味、热处理等工序,导致干扰因素增多、蛋白质变性等情况发生,在一定程度上制约了波谱分析法、蛋白质分析法的使用。遗传物质DNA分子具有高度的稳定性和物种特异性,因此,以DNA为检测对象的分子生物学法无疑成为肉制品动物源性成分分析最为理想的选择方案。其中,实时荧光定量PCR法因灵敏度高、特异性好、操作便捷且具有一定的定量功能,是当前分子生物学检测最常用的手段,然而其对于未知成分的检测需要设计不同的引物、探针逐一排查,增加了检测成本。可视基因膜芯片技术是一种利用特异探针杂交产生可见信号的基因芯片技术,该方法利用反向斑点杂交原理,将核苷酸探针顺序排列于支持膜表面,形成探针阵列,采用多重PCR技术将待检测目标基因进行扩增后,扩增产物经过变性后形成的单链DNA与膜芯片上的探针杂交,经底物显色形成可視的检测结果[30-32]。一般情况下,芯片上固定多个基因靶点,可同时检测多个目的基因。因此,该技术具有操作简单、通量高、成本低和结果肉眼可见的特点,已在微生物检测、转基因检测、过敏原检测等多个领域使用[33-35]。
本研究利用可视基因膜芯片对市售肉制品进行筛查分析,并采用实时荧光定量PCR方法进行确认,以证实2 种方法的一致性和可行性,同时,对目前肉制品中动物源性成分与标签不一致而涉嫌掺假行为进行调查,为行业监管提供依据。
1 材料与方法
1.1 材料与试剂
肉松(6 份)、香肠(6 份)、肉卷(4 份)、预制调理肉(4 份)、肉干(2 份)、肉脯(1 份)均购自南通地区市场及超市。
深加工食品DNA提取试剂盒 天根生化科技(北京)
有限公司;TaqProbe 2×qPCR-Low-ROX预混液 生工生物工程(上海)股份有限公司;膜芯片动物源性成分检测试剂盒 四川华汉三创生物科技有限公司;三氯甲烷(纯度≥99.0%) 上海凌峰化学试剂有限公司;无水乙醇(纯度≥99.7%) 上海振兴化工一厂;异丙醇(色谱级,纯度99.8%) 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
MFS-24膜芯片杂交仪 四川华汉三创生物科技有限公司;7500实时荧光定量PCR仪 美国ABI公司;C1000 Touch梯度PCR仪 美国Bio-Rad公司;H1650R高速冷冻离心机 上海卢湘仪离心机仪器有限公司;移液器(2.5、10、200、1 000 μL) 德国Eppendorf公司;DEAOU-US 200超微量分光光度计 广州迪澳生物科技有限公司;GC-100恒温干浴器、MINI-6K离心机 杭州佑宁仪器有限公司。
1.3 方法
1.3.1 DNA提取
选择代表性样品,粉碎、碾磨均匀后,按照深加工食品DNA提取试剂盒说明书进行操作,整个过程应避免交叉污染。DNA提取完成后,使用核酸蛋白测定仪进行测定,确保A260 nm/A280 nm为1.8~2.0。
1.3.2 膜芯片检测
1)多重PCR扩增体系配制。反应体系总体积为20 μL,其中多重PCR反应预混液(2×Multiplex PCR Master Mix)10 μL,加入一定体积的样品,确保反应体系中样品DNA含量为50~400 ng,用无核酸酶水补充至20 μL。
2)多重PCR扩增。包括3 个步骤:50 ℃预处理2 min,95 ℃预变性10 min;95 ℃变性30 s,55 ℃退火30 s,68 ℃延伸15 s,30 个循环;68 ℃延伸30 min,4 ℃保持。
3)膜芯片杂交。产物变性:将PCR产物95 ℃变性5 min后立即置于冰上放置备用;按要求配制好相关试剂,加入杂交液后执行杂交显示程序,包括杂交(45 ℃、10 min)、杂交清洗(52 ℃、3 min)2 次、酶孵育标记(42 ℃、10 min)、酶标清洗Ⅰ(42 ℃、3 min)、酶标清洗Ⅱ(37 ℃、3 min)2 次、显色液显色(37 ℃、10 min)、显色清洗(37 ℃、1 min)2 次。
1.3.3 实时荧光定量PCR检测
实时荧光定量PCR引物及探针(表1)由生工生物工程(上海)股份有限公司合成。
实时荧光定量PCR反应体系(20 μL):TaqProbe qPCR Mastermix 10 μL、上游引物(10 μmol/L)1 μL、下游引物(10 μmol/L)1 μL、TaqMan探针0.5 μL、DNA模板2 μL、无核糖核酸酶ddH2O 5.5 μL。
實时荧光定量PCR反应参数:95 ℃变性10 min;95 ℃变性15 s,60 ℃退火/延伸60 s并收集荧光信号,循环40 次。
1.4 数据处理
基因膜芯片结果由膜芯片杂交仪自动拍照并经
MFS-24自动分析软件(版本号MFS24.V.1.0.5.21.03)处理;实时荧光定量PCR结果图片由实时荧光定量PCR仪配套7500软件(版本号V2.3)处理而成。
2 结果与分析
2.1 可视基因膜芯片点阵图及阳性质控结果
本研究所采用的11 种动物源性成分膜芯片点阵如
图1所示,依据试剂盒说明书,对11 种动物源性成分的检出限为0.1%(质量分数)。利用试剂盒所带的11 种动物源性成分多重PCR阳性质控进行测试,结果如图2所示。
由图1~2可知,膜芯片上PC点、内参点及11 种动物源性成分阳性质控点均显色,而NC点及空白对照均不显色,符合预期要求。
2.2 样品的可视基因膜芯片检测结果
根据11 种动物源性成分膜芯片点阵图与膜芯片显色结果,可以判别测试结果的有效性及样品中所含的动物源性成分。由表2~6可知,PC点均显色,而NC点及空白对照均未显色,表明测试结果均有效。由表2可知,6 份肉松样本中有1 份(6#)配料表中标识为猪肉,实际检出猪和鸡成分。由表3可知,6 份香肠样本中有2 份标识与实际分析结果不一致,其中香肠1#标识为牛肉,实际检出牛、猪和鸡成分,香肠5#标识为鸡肉、猪肉,实际只检出鸡成分。由表4可知,4 份肉卷样本中有2 份标识与实际分析结果不一致,其中肉卷2#标识为牛肉,实际检出猪、牛、鸡成分,肉卷3#标识为羊肉,实际不仅检出羊成分,还检出猪成分。由表5~6可知,4 份预制调理肉、2 份肉干及1 份肉脯样本实际检测结果均与标识一致。
由此可以看出,利用可视基因膜芯片技术,通过一次多重PCR反应,在芯片所包含的11 种动物源性成分范围内实现了对未知样品成分的筛查,操作简单、快速,显色结果肉眼可视。
2.3 实时荧光定量PCR确认结果
对于可视基因膜芯片检测与标识不符的5 个样品,根据样品筛查出的成分,分别采用实时荧光定量PCR技术对各组分进行确认。
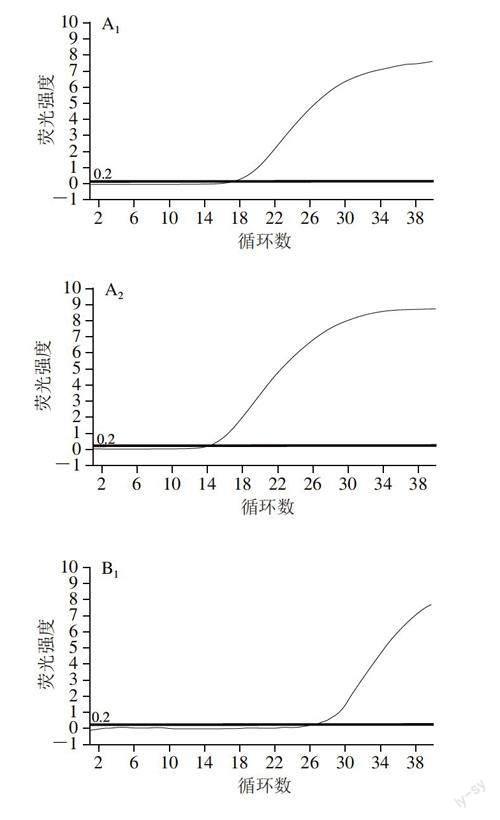
A. 肉松6#(A1、A2. 猪、鸡目标基因);B. 香肠1#(B1、B2、B3. 牛、猪、鸡目标基因);C. 香肠5#(C1、C2. 鸡、猪目标基因);D. 肉卷2#(D1、D2、D3. 猪、牛、鸡目标基因);E. 肉卷3#(E1、E2. 羊、猪目标基因)。
实时荧光定量PCR法是目前分子生物学检测领域使用最为普遍的方法,能够通过对探针所标记荧光信号的监测,实时显示PCR扩增结果,并可以通过循环阈(cycle threshold,Ct)值判断样本中目标核酸起始浓度,具有定量功能。由图3A可知,猪、鸡目标基因出现典型扩增曲线。由图3B可知,牛、猪、鸡目标基因出现典型扩增曲线。由图3C可知,鸡目标基因出现典型扩增曲线,而猪目标基因无扩增曲线;由图3D可知,猪、牛、鸡目标基因出现典型扩增曲线。由图3E可知,羊、猪目标基因出现典型扩增曲线。上述所有扩增曲线相应的Ct值均小于30,表明各目标组分检出,通过与可视基因膜芯片检测结果比较可以看出,2 种技术测定结果一致,证实了可视基因膜芯片筛查结果的可靠性。
另外,对于本次用于分析检测的23 份各类肉制品样品,存在5 批次的掺假、虚标情况,占比达21.7%,主要涉及在价格较高的牛、羊肉制品中掺加价格低廉的猪肉或鸡肉,或在猪肉制品中掺加鸡肉。
3 结 论
本研究利用可视基因膜芯片技术对南通地区市售的肉松、香肠、肉卷、预制调理肉、肉干和肉脯等肉类加工制品动物源性成分进行筛查,同时对于检出成分与标识不符的样品采用实时荧光定量PCR法进行验证确认。实验结果显示,2 种方法所获得的结果一致。可视基因膜芯片技术以多重PCR为基础并在芯片上集成了多个目标探针,能够实现1 次反应、多个目标组分同时定性检测,具有通量高、操作简便的特点,同时,相较于荧光定量PCR技术,其对仪器的依赖程度不高,结果肉眼可见,所使用引物及探针使用亲和素和氨基标记,成本相较于荧光探针标记也更加低廉。实时荧光定量PCR技术更为灵敏且具有定量功能,对于食品掺假鉴别而言,过高的灵敏度没有实际意义,反而增加了样本接触性污染结果的干扰识别难度;核酸定量分析虽然在食品成分分析中具有重要意义,能够反映食品各组分比例关系,但由于受DNA提取效率及缺乏有效标准品等因素的影响,导致目前实时荧光定量PCR法在动物源成分鉴别中难以有效发挥其定量优势,国内外报道的鉴别方法主要将其作为定性的手段。由此可见,对于成分未知的样品而言,使用可视基因膜芯片技术可以在芯片标记的物种探针范围内实现快速筛查,能够避免直接使用实时荧光定量PCR方法逐一分析带来的繁琐程序和高昂成本。
本研究利用11 种常见动物源性成分基因膜芯片随机分析的23 份样品中,检测结果与标识不符的占比达21.7%,表明肉制品中虚标比例较高,涉嫌产品掺假问题需要引起监管部门和社会的关注,应加大力度打击生产加工过程弄虚作假,维护消费者权益,确保食品质量与安全。
参考文献:
[1] 施姿鹤, VOGLMEIR J, 刘丽. 肉及其加工制品的掺假鉴别技术研究进展[J]. 食品科学, 2019, 40(23): 319-326. DOI:10.7506/spkx1002-6630-20181229-354.
[2] 李欣南. 基于核酸分子检测的肉类源性成分快速鉴别技术的开发与应用[D]. 沈阳: 中国医科大学, 2018: 1-2.
[3] CAVIN C, COTTENET G, BLANCPAIN C, et al. Food adulteration: from vulnerability assessment to new analytical solutions[J]. Chimia (Aarau), 2016, 70(5): 329-333. DOI:10.2533/chimia.2016.329.
[4] 何鸿举, 王魏, 马汉军, 等. 近红外光谱技术在肉品掺假检测方面的研究进展[J]. 食品工业科技, 2020, 41(3): 345-356. DOI:10.13386/j.issn1002-0306.2020.03.057.
[5] GAO Fei, ZHOU Simiao, HAN Lujia, et al. A novel FT-IR spectroscopic method based on lipid characteristics for qualitative and quantitative analysis of animal-derived feedstuff adulterated with ruminant ingredients[J]. Food Chemistry, 2017, 237: 342-349. DOI:10.1016/j.foodchem.2017.05.011.
[6] 韓爱云, 张振冉, 解立斌, 等. 拉曼光谱技术在肉类掺假检测方面的应用研究进展[J]. 肉类研究, 2021, 35(7): 50-54. DOI:10.7506/rlyj1001-8123-20210316-073.
[7] BOYACI I H, UYSAL R S, TEMIZ T, et al. A rapid method for determination of the origin of meat and meat products based on the extracted fat spectra by using of Raman spectroscopy and chemometric method[J]. European Food Research and Technology, 2014, 238(5): 845-852. DOI:10.1007/s00217-014-2168-1.
[8] JAKES W, GERDOVA A, DEFERNEZ M, et al. Authentication of beef versus horse meat using 60 MHz 1H NMR spectroscopy[J]. Food Chemistry, 2015, 175: 1-9. DOI:10.1016/j.foodchem.2014.11.110.
[9] 吴艺影, 章倩汝, 韩剑众, 等. 基于低场核磁共振技术的注胶肉快速检测[J]. 肉类研究, 2013, 27(3): 26-29.
[10] KAMRUZZAMAN M, MAKINO Y, OSHITA S. Rapid and non-destructive detection of chicken adulteration in minced beef using visible near-infrared hyperspectral imaging and machine learning[J]. Journal of Food Engineering, 2016, 170: 8-15. DOI:10.1016/j.jfoodeng.2015.08.023.
[11] ZHENG Xiaochun, LI Yongyu, WEI Wensong, et al. Detection of adulteration with duck meat in minced lamb meat by using visible near-infrared hyperspectral imaging[J]. Meat Science, 2019, 149:
55-62. DOI:10.1016/j.meatsci.2018.11.005.
[12] ?ZGUN-ARUN O, UGUR M. Animal species determination in sausages using an SDS-PAGE technique[J]. Archive für Lebensmittelhygiene, 2000, 51: 49-53.
[13] GIUSEPPE A, GIARRETTA N, LIPPERT M, et al. An improved UPLC method for the detection of undeclared horse meat addition by using myoglobin as molecular marker[J]. Food Chemistry, 2015, 169: 241-245. DOI:10.1016/j.foodchem.2014.07.126.
[14] MANDLI J, ELFATIMI I, SEDDAOUI N, et al. Enzyme immunoassay (ELISA/immunosensor) for a sensitive detection of pork adulteration in meat[J]. Food Chemisty, 2018, 255: 380-389. DOI:10.1016/j.foodchem.2018.01.184.
[15] WANG Guiji, ZHOU Guangyun, REN Haowei, et al. Peptide biomarkers identified by LC-MS in processed meats of five animal species[J]. Journal of Food Composition and Analysis, 2018, 73:
47-54. DOI:10.1016/j.jfca.2018.07.004.
[16] PRANDI B, LAMBERTINI F, FACCINI A, et al. Mass spectrometry quantification of beef and pork meat in highly processed food: application on bolognese sauce[J]. Food Control, 2017, 74: 61-69. DOI:10.1016/j.foodcont.2016.11.032.
[17] 郭鳳柳, 熊蕊, 刘晓慧, 等. 应用PCR技术检测掺假肉类[J]. 食品安全质量检测学报, 2014, 5(2): 541-545.
[18] ALI M E, RAZZAK M A, HAMIDS B A. Multiplex PCR in species authentication: probability and prospects: a review[J]. Food Analytical Methods, 2014, 7(10): 1933-1949. DOI:10.1007/s12161-014-9844-4.
[19] 中国检验检疫科学研究院, 大连海关, 青岛海关, 等. 常见畜禽动物源性成分检测方法 实时荧光PCR法: GB/T 38164—2019[S]. 北京: 中国标准出版社, 2019.
[20] LUBIS H, SALIHAH N T, HOSSAIN M M, et al. Development of fast and sensitive real-time qPCR assay based on a novel probe for detection of porcine DNA in food sample[J]. LWT-Food Science and Technology, 2017, 84: 686-692. DOI:10.1016/j.lwt.2017.06.043.
[21] ZAHRADNIK C, MARTZY R, ROBERT L, et al. Loop-mediated isothermal amplification (LAMP) for the detection of horse meat in meat and processed meat products[J]. Food Analytical Methods, 2015, 8(6): 1576-1581. DOI:10.1007/s12161-014-0072-8.
[22] 陈珍金, 张璜, 石磊, 等. 利用LAMP技术快速检测羊肉制品中的鼠源性成分[J]. 食品科学, 2021, 42(12): 322-327. DOI:10.7506/spkx1002-6630-20201016-146.
[23] PFEIFFER I, BUEGER J, BRENIG B. Diagnostic polymorphisms in the mitochondrial cytochrome b gene allow discrimination between cattle, sheep, goat, roe buck and deer by PCR-RFLP[J]. BMC Genet, 2004, 5: 30.
[24] KUMAR D, SINGH S P, KARABASANAVAR N S, et al. Authentication of beef, carabeef, chevon, mutton and pork by a PCR-RFLP assay of mitochondrial cytb gene[J]. Journal of Food Science and Technology, 2014, 51(11): 3458-3463. DOI:10.1007/s13197-012-0864-z.
[25] 励炯, 江海, 吴琼, 等. 基于COI序列的DNA微条形码技术鉴别熟肉制品中11 种肉掺假的研究[J]. 食品工业科技, 2021, 42(2): 99-104. DOI:10.13386/j.issn1002-0306.2020040288.
[26] 王爽, 李永波, 马超峰, 等. DNA条形码COI序列在常见肉类鉴别中的应用研究[J]. 现代食品科技, 2016, 32(1): 188-193. DOI:10.13982/j.mfst.1673-9078.2016.1.030.
[27] 陈传君, 金鹭, 林华, 等. 食品中羊肉源性成分微滴数字PCR定量方法的建立[J]. 食品与发酵工业, 2020, 46(6): 229-237. DOI:10.13995/j.cnki.11-1802/ts.022599.
[28] FLOREN C, WIEDEMANN I, BRENIG B, et al. Species identification and quantification in meat and meat products using droplet digital PCR (dd PCR)[J]. Food Chemistry, 2015, 173(173): 1054-1058. DOI:10.1016/j.foodchem.2014.10.138.
[29] WANG Qiang, CAI Yicun, HE Yuping, et al. Droplet digital PCR (ddPCR) method for the detection and quantification of goat and sheep derivatives in commercial meat products[J]. European Food Research and Technology, 2018, 244(4): 767-774. DOI:10.1007/s00217-017-3000-5.
[30] 范宏偉, 吴鑫, 朱应飞, 等. 膜芯片用于肉制品中动物源性成分检测的研究[J]. 食品安全质量检测学报, 2017, 8(9): 3479-3484.
[31] 任易婕, 霍胜楠, 翟清燕, 等. 膜芯片技术对牛、羊、牦牛、驴肉源食品的掺伪鉴别[J]. 肉类研究, 2019, 33(6): 33-38. DOI:10.7506/rlyj1001-8123-20190417-081.
[32] 韩建勋, 陈颖, 王斌, 等. 应用可视芯片技术高通量鉴别8 种鱼成分[J]. 分析测试学报, 2018, 37(2): 174-179. DOI:10.3969/j.issn.1004-4957.2018.02.005.
[33] 赵金毅, 白素兰, 黄文胜, 等. 应用可视芯片技术检测食品中常见致病菌的方法研究[J]. 食品与发酵工业, 2008, 34(8): 141-144.
[34] 成晓维, 王小玉, 胡松楠, 等. 可视芯片检测大豆、水稻和玉米中的转基因成分[J]. 现代食品科技, 2013, 29(3): 654-659.
[35] WANG Wei, HAN Jianxun, WU Yajun, et al. Simultaneous detection of eight food allergens using optical thin-film biosensor chips[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 6889-6894. DOI:10.1021/jf200933b.
收稿日期:2022-10-27
基金项目:南通市科技计划项目(JC2020108);江苏省市场监督管理局科技计划项目(KJ204137);
国家自然科学基金海峡联合基金项目(U1905202)
第一作者简介:邵彪(1983—)(ORCID: 0000-0001-8749-889X),男,高级工程师,博士,研究方向为食品质量与安全分析。
E-mail: shaobiao1983@sina.com
*通信作者简介:汪少芸(1970—)(ORCID: 0000-0003-1244-8964),女,教授,博士,研究方向为食品生物化学。
E-mail: shywang@fzu.edu.cn

