龟鹿补肾丸对过敏性哮喘大鼠气道炎症和Th1/Th2失衡的影响
耿春贤,张祉思,陈志钊,李志强,陈曌,江涛
(1.广州白云山花城药业有限公司,广东 广州 510555;2.广东药科大学中药学院,广东 广州 510006;3.广东药科大学实验动物中心,广东 广州 510006)
哮喘是一种常见的慢性疾病,威胁全球3.34 亿人的健康[1],2019 年我国成年人哮喘患病率为4.2%,且发病率逐年增高[2]。过敏性哮喘为最常见的哮喘亚型,主要以2型T 辅助细胞(T helper cell 2,Th2)免疫应答引起嗜酸性粒细胞(eosnophils,EOS)气道炎症以及IgE 介导的肥大细胞脱颗粒为特征[3],Th1/Th2 失衡是造成Th2 型炎症反应的主要原因[4-5]。因此,维持Th1/Th2 为主的不同亚群的T细胞功能平衡是控制哮喘发生发展的关键。
中医认为,哮喘属于“哮病”范畴,哮喘病位在肺和脾,其根在肾。往往先天肾亏或久病及肾,引发肾阳亏虚,气化摄纳功能异常,是引起哮喘屡发不愈的“夙根”[6],故可采用温补肾阳法治疗哮喘[7]。龟鹿补肾丸是收载于2020 版《中国药典》的壮阳补肾类中药复方,主要由淫羊藿、鹿角胶、龟甲胶、黄芪、山药等药味组成,具有补肾阳、壮筋骨和益气血的功效,临床用于身体虚弱、精神疲乏、腰腿酸软、头晕目眩、夜多小便、健忘失眠等症。相关研究表明,方药中的主要药味淫羊藿可显著减轻哮喘大鼠气道炎症及改善气道重塑,调节Th1/Th2 细胞失衡[8],并能上调下丘脑-垂体-肾上腺轴功能[9]。另外,黄芪能调节IL-2、IL-4 水平,改变辅助性T 淋巴细胞1 与2(Th1/Th2)的比值,缓解哮喘症状,具有预防和治疗哮喘的作用[10]。但未见龟鹿补肾丸对过敏性哮喘气道炎症和Th1/Th2细胞失衡的研究报道。
本文通过测定卵蛋白(OVA)致敏大鼠哮喘模型的引喘潜伏期、BALF 总白细胞数、外周血总白细胞数及其分类百分比、外周血IgE 水平、肺组织炎症改变和气道黏液分泌变化、Th1、Th2 代表性的细胞因子含量和Th细胞的基因转录水平等多个指标,探究龟鹿补肾丸对哮喘大鼠气道炎症的干预作用以及对Th1/Th2 细胞失衡的影响,为龟鹿补肾丸治疗过敏性哮喘提供一定的实验依据。
1 实验材料
1.1 实验动物
SPF 级SD 雄性大鼠,48 只,体质量240~260 g,由广东省医学实验动物中心提供,生产许可证号SCXK(粤)2018-0002。饲养环境:广东药科大学实验动物中心SPF 级动物房(SYXK(粤)2017-0125),室温20~25 ℃,相对湿度为40%~70%,12 h/12 h明暗交替。本动物实验方案已获得广东药科大学实验动物伦理委员会批准(批准号gdpulacspf2017319)。
1.2 药物与主要试剂
龟鹿补肾丸(广州白云山花城药业有限公司,批号:20200203,按中国药典2015 版含量测定项下以淫羊藿苷计每克水蜜丸不少于0.2 mg);地塞米松片(天津力生制药股份有限公司,批号:20200507);卵清蛋白,购自美伦生物(批号MO228A);瑞氏-吉姆萨染色液,购自Baso 公司(批号CZ01003);AB-PAS 染色试剂盒,购自森贝伽生物科技(批号20200511);大鼠白细胞介素-4(IL-4)ELISA 试剂盒(MM-0191R1)、大鼠γ 干扰素(IFN-γ)ELISA 试剂盒(MM-0785R2)、大鼠白细胞介素-5(IL-5)ELISA 试剂盒(MM-0094R1)、大鼠白细胞介素-13(IL-13)ELISA 试剂盒(MM-0085R1)和大鼠免疫球蛋白E(Ig E)ELISA试剂盒(MM-0563R2)均购自江苏酶免实业有限公司;SYBR Premix EX TaqⅡKit(2130)、Prime ScriptTMRT reagent Kit(2043)均购自日本TaKaRa公司。
1.3 实验仪器
YLS-8A 多功能诱咳引喘仪(济南益延科技发展有限公司);URIT-2981 型全自动血细胞分析仪(广西优利特科技有限公司);VarioskanLUX 多功能酶标仪(Termo Fisher Scientific);BA310-1 生物显微镜(麦克奥迪实业集团有限公司);TC-120型智能程控生物组织自动脱水机、TK-48 恒温推片烤片机、TB-718D 生物组织自动包埋机和TB-180I 生物组织全自动染色机均购自湖北泰维科技实业有限公司;7300 荧光定量仪(美国ABI 公司);C1000 Thermal cycler PCR 扩增仪(美国BIO-RAD 公司);Q6000UV超微量紫外分析仪(美国Quawell Technology公司)。
2 方法
2.1 大鼠过敏性哮喘模型的制备与给药
将48 只雄性SD 大鼠,按体质量随机分为正常对照组,模型组,地塞米松阳性药物组,龟鹿补肾丸低、中、高剂量组,每组8只。除正常对照组外,其余各组于第1、8 天腹腔注射10%卵蛋白抗原液1 mL致敏,正常对照组腹腔注射等量生理盐水。从造模第15 天开始,除了正常对照组外,其余各组均超声雾化1%卵蛋白激发,每天1 次,每次30 min。连续雾化激发3 周后,以2%卵蛋白持续雾化1 周,正常对照组超声雾化等量生理盐水。从造模第15 天开始,每次雾化激发前1 h,灌胃给予高、中、低剂量的龟鹿补肾丸(高、中、低剂量分别为临床剂量的4、2、1 倍,即7.2 g/kg、3.6 g/kg、1.8 g/kg)和地塞米松(0.5 mg/kg),正常对照组和模型组给予等量生理盐水,每天1次,连续4周。
2.2 行为学观察和引喘潜伏期测定
第43 天雾化激发时,观察10 min 内大鼠抓鼻、挠痒以及哮喘发作症状等哮喘行为学特征并评分:无抓鼻或挠痒动作计0 分,抓鼻或挠痒出现1~2 次计1 分,3~4 次计2 分,5 次及以上的计3 分[11]。此外,观察并记录引喘潜伏期,即从卵蛋白开始激发到出现抓耳挠腮、腹式呼吸等特征较明显过敏性哮喘症状的时间。
2.3 样本采集与指标检测
2.3.1 样本采集 大鼠末次雾化激发24 h 后,腹腔注射3%(φ)戊巴比妥钠(30 mg/kg)麻醉动物,腹主动脉先采血0.5 mL(EDTA 抗凝),然后再采血约4 mL,静置30 min 后,2 ~8 ℃下冷冻离心10 min(3 500 r/min),分离血清,放入-80 ℃保存备用。取血后,于颈部气管下端作T 形切口,行气管插管,用注射器缓缓注入2 mL 生理盐水,反复3 次进行肺泡灌洗,收集肺泡灌洗液(BALF),4 °C ,1 000 r/min离心10 min,取上清液-80°C 保存。然后取出右肺组织,将右肺上叶放于预先标号的冻存管中,液氮速冻保存备用,其余肺组织用0.9%生理盐水清洗3次,4%多聚甲醛固定液中固定保存。
2.3.2 外周血和肺泡灌洗液(BALF)中总白细胞计数 采用全自动血细胞分析仪,对抗凝的外周全血检测白细胞总数。BALF 离心后,将余下细胞碎片用0.1 mL 生理盐水混匀,取其中20 μL 加入到细胞计数板,室温静置2~3 min。待白细胞完全下沉,在低倍镜下计数4 个大方格内的白细胞总数。每毫升BALF 中含白细胞总数=4 大格的细胞总数/4×10 000。
2.3.3 外周血白细胞分类计数 吸取抗凝管5~7 μL血,滴在载玻片的一端,然后用左手持载玻片,用右手持玻片,匀速将血液向载玻片的另一端快速推动,待血涂片自然晾干后进行瑞氏姬姆萨染色,镜下计数100 个白细胞中淋巴细胞数、嗜酸性粒细胞数、单核细胞数、中性粒细胞数,并计算其百分比。
2.3.4 肺泡灌洗液(BALF)中IL-4、IL-5、IL-13 以及IFN-γ含量检测 将BALF 上清液从-80°C 取出,于室温下放置15 min,按照ELISA 法试剂盒说明书,检测各组大鼠BALF 的IL-4 IL-5、IL-13 和IFN-γ水平。
2.3.5 血清总IgE 含量检测 将血清从-80 ℃中取出,室温放置15 min,采用ELISA法测定IgE浓度。2.3.6 大鼠肺组织病理形态学观察 肺组织于4%(φ)多聚甲醛固定48 h 后,常规浓度梯度酒精及石蜡中进行脱水浸蜡处理,石蜡包埋,切成厚度为4 μm 的切片,HE 染色,镜下观察肺组织的病理变化并拍照记录。按照PAS 染色试剂盒说明书进行操作,观察肺组织中黏液性物质的分泌,应用ImagePro Plus6.0 图像分析软件,以气道壁黏液染色阳性面积进行定量分析[12]。
2.3.7 过敏性哮喘模型大鼠肺组织T-bet、GATA-3的基因表达水平检测 T-bet、GATA-3 的mRNA 基因引物从Genebank 中查阅相关cDNA 序列,根据引物设计原则,用Primer Premier 6.0 辅助设计,引物由上海生工生物有限公司合成。以β-actin 为内参照,β-actin:上游引物5′-CCGTAAAGACCTCTATGC CAA-3′,下游引物5′-CGGACTCATCGTACTCCT GCT-3′;T-bet:上游引物5′-TCTGTCGAACCAGTA TCCTGT-3′,下游引物5′-CTTCACGCTCACTGC TCG GAA-3′;GATA-3′:上游引物5′-TCTGGAGG AGGAACGCTAAC-3′,下游引物5′- CTTACGGTT TCGGGTCTGGAT-3′。
将适量冻存肺组织研磨,按照TRIzol 法提取肺组织中总RNA。以1 μg 总RNA 为模板,按照Prime Script TMRT reagent Kit 说明将总RNA 逆转录合成cDNA。以β-actin 为内参基因,应用ABI Real Time PCR 仪进行荧光定量PCR。Real time PCR 反应条件:95 ℃预变性30 s;94 ℃变性20 s,58 ℃退火20 s,72 ℃延伸20 s,40 个循环。融解曲线分析:94 ℃变性30 s,65 ℃退火30 s,94 ℃延伸30 s。每个样品重复3 次。按照2-△△Ct方法处理数据。
2.3.8 统计方法 使用软件SPSS25.0 进行统计学分析,实验数据均用表示,多组间比较采用单因素方差分析。方差齐者,组间比较采用LSD法进行分析;方差不齐者,选用Tamhane's T2 法进行分析。非正态分布数据用Mann-Whineyu 检验,P<0.05 为差异有统计学意义。
3 结果
3.1 龟鹿补肾丸对过敏性哮喘大鼠的症状评分和引喘潜伏期的影响
与正常对照组相比,模型组在雾化过程中表现出明显抓鼻、挠痒等症状,症状评分明显增加,而哮喘潜伏期明显缩短(P<0.01)。与模型组比较,地塞米松组和龟鹿补肾丸低、中、高剂量组均能显著降低哮喘症状评分,并显著延长引喘潜伏期(P<0.01)。见表1。
表1 龟鹿补肾丸对哮喘模型大鼠的症状评分及潜伏期的影响Table 1 Effect of Guilubushen pill on symptom score and incubation period of asthmatic rats(±s,n=8)
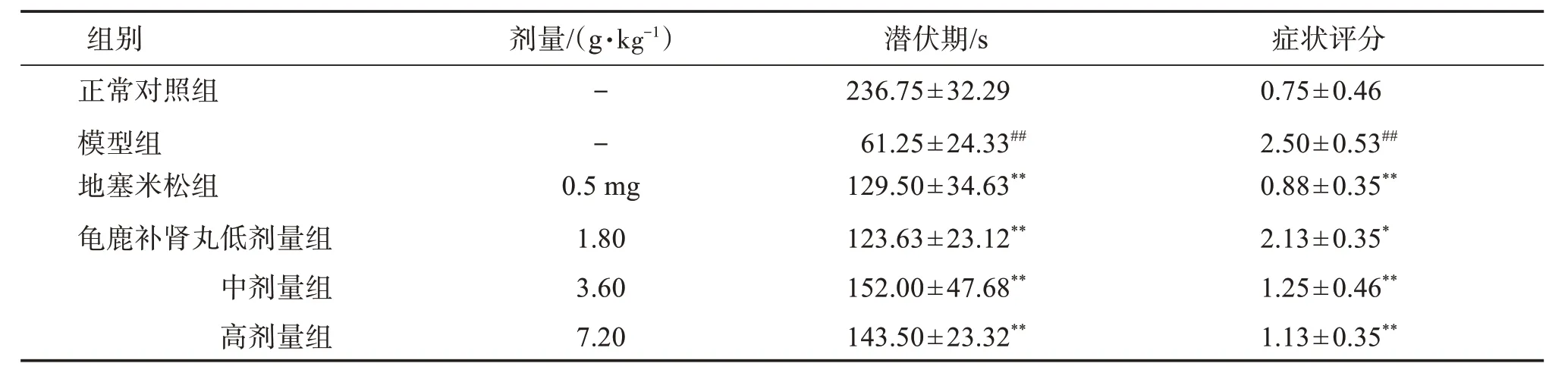
表1 龟鹿补肾丸对哮喘模型大鼠的症状评分及潜伏期的影响Table 1 Effect of Guilubushen pill on symptom score and incubation period of asthmatic rats(±s,n=8)
与正常对照组比较:##P<0.01;与模型组比较:*P<0.05,**P<0.01。
症状评分0.75±0.46 2.50±0.53##0.88±0.35**2.13±0.35*1.25±0.46**1.13±0.35**组别__________________________正常对照组模型组地塞米松组龟鹿补肾丸低剂量组中剂量组高剂量组_________________剂量/(g·kg-1)______________--0.5 mg 1.80 3.60 7.20________________潜伏期/s 236.75±32.29 61.25±24.33##129.50±34.63**123.63±23.12**152.00±47.68**143.50±23.32**
3.2 龟鹿补肾丸对过敏性哮喘大鼠外周血和BALF中总白细胞计数的影响
与正常对照组相比,模型组外周血和BALF 中总白细胞数显著增高(P<0.05 或P<0.01);与模型组相比,地塞米组、龟鹿补肾丸低、中、高剂量组均能显著降低过敏性哮喘大鼠外周血和BALF中的总白细胞数(P<0.01或P<0.05)。见表2。
表2 龟鹿补肾丸对哮喘模型大鼠BALF和外周血中总白细胞数的影响Table 2 Effect of Guilubushen pill on the total white cell counts in BALF and peripheral blood of asthmatic rats(±s,n=8)
与正常对照组比较:#P<0.05,##P<0.01;与模型组比较:*P<0.05,**P<0.01。
组别正常对照组模型组地塞米松组龟鹿补肾丸低剂量组中剂量组_______________高剂量组剂量/(g·kg-1)总白细胞数外周血(×109/L)7.88±1.38 10.33±2.59#2.35±1.36**7.33±2.67**6.61±1.29**7.40±2.94*--0.5 mg 1.80 3.60 7.20___________________BALF(×104/mL)26.32±2.24 42.91±3.53##24.28±1.15**35.34±1.68**33.25±2.04**38.53±1.58**
3.3 龟鹿补肾丸对OVA 致过敏性哮喘大鼠外周血白细胞分类百分比的影响
与正常对照组相比,模型组外周血淋巴细胞百分比、嗜酸性粒细胞百分比以及中性粒细胞百分比均显著增大(P<0.01)。与模型组相比,地塞米松组的淋巴细胞百分比和嗜酸性粒细胞百分比明显降低(P<0.01),而中性粒细胞百分比显著增大(P<0.01);龟鹿补肾丸组的淋巴细胞百分比和嗜酸性粒细胞百分比显著降低(P<0.05或P<0.01),中性粒细胞百分比则显著增大(P<0.01)。见表3。
表3 龟鹿补肾丸对哮喘大鼠的外周血白细胞分类百分比影响Table 3 Effect of Guilubushen pill on the percentage of leukocyte classification in peripheral blood of asthmatic rats(±s,n=8)
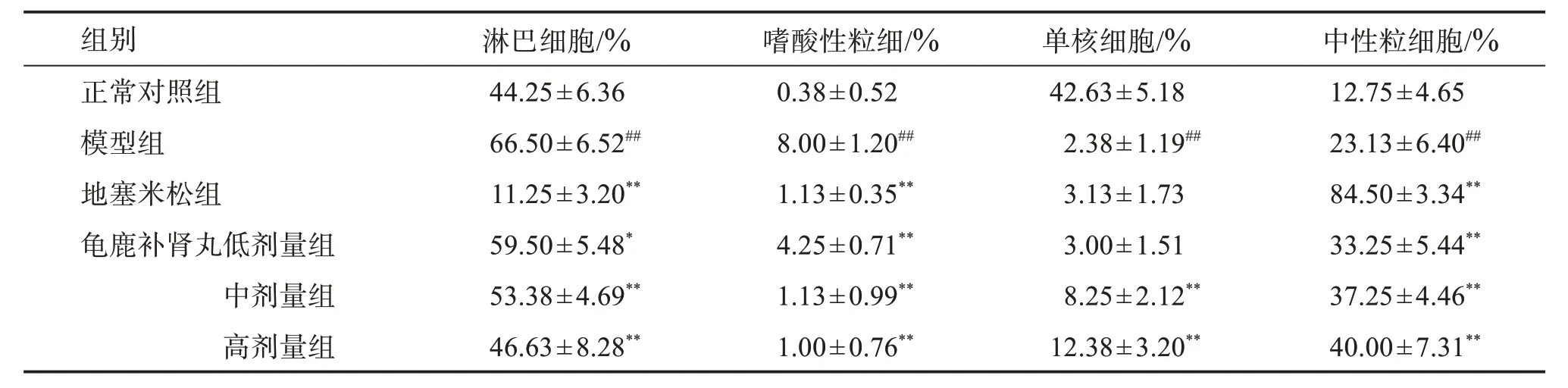
表3 龟鹿补肾丸对哮喘大鼠的外周血白细胞分类百分比影响Table 3 Effect of Guilubushen pill on the percentage of leukocyte classification in peripheral blood of asthmatic rats(±s,n=8)
与正常对照组比较:##P<0.01;与模型组比较:*P<0.05,**P<0.01。
中性粒细胞/%12.75±4.65 23.13±6.40##84.50±3.34**33.25±5.44**37.25±4.46**40.00±7.31**组别________________________正常对照组模型组地塞米松组龟鹿补肾丸低剂量组中剂量组高剂量组___________淋巴细胞/%________44.25±6.36 66.50±6.52##11.25±3.20**59.50±5.48*53.38±4.69**46.63±8.28**嗜酸性粒细/%______0.38±0.52 8.00±1.20##1.13±0.35**4.25±0.71**1.13±0.99**1.00±0.76**单核细胞/%42.63±5.18 2.38±1.19##3.13±1.73 3.00±1.51 8.25±2.12**12.38±3.20**
3.4 龟鹿补肾丸对OVA 致过敏性哮喘大鼠外周血IgE含量的影响
与正常对照组相比,模型组大鼠外周血IgE 水平显著增高(P<0.05);与模型组相比,地塞米组、龟鹿补肾丸低剂量、中剂量、高剂量组均能极显著降低过敏性哮喘大鼠外周血IgE水平(P<0.01)。见表4。
表4 龟鹿补肾丸对哮喘大鼠外周血IgE含量的影响Table 4 Effect of Guilubushen pill on IgE content in peripheral blood of asthmatic rats (±s,n=8)

表4 龟鹿补肾丸对哮喘大鼠外周血IgE含量的影响Table 4 Effect of Guilubushen pill on IgE content in peripheral blood of asthmatic rats (±s,n=8)
与正常对照组比较:#P<0.05;与模型组比较:**P<0.01。
IgE/(μg·mL-1)0.52±0.03 0.55±0.02#0.49±0.02**0.46±0.02**0.42±0.03**0.47±0.03**组别________________________________________正常对照组模型组地塞米松组龟鹿补肾丸低剂量组中剂量组高剂量组______________________________剂量/(g·kg-1)--0.5 mg 1.80 3.60 7.20
3.5 龟鹿补肾丸对OVA 致过敏性哮喘大鼠肺组织病理态学的影响
如图1 所示,HE 染色结果显示,正常对照组支气管管壁光滑,支气管上皮细胞未见增生,管壁无明显增厚,支气管及血管周围无明显炎性细胞浸润。模型组支气管上皮细胞增生,管腔峡窄,支气管及血管周围有大量炎性细胞浸润。地塞米松组支气管及血管周围有少量炎性细胞浸润,支气管平滑肌轻度增厚,未见明显管腔缩窄。龟鹿补肾丸低、中、高剂量组支气管及血管周围炎性细胞浸润逐渐减少,支气管平滑肌轻度增厚,未见明显管腔缩窄。
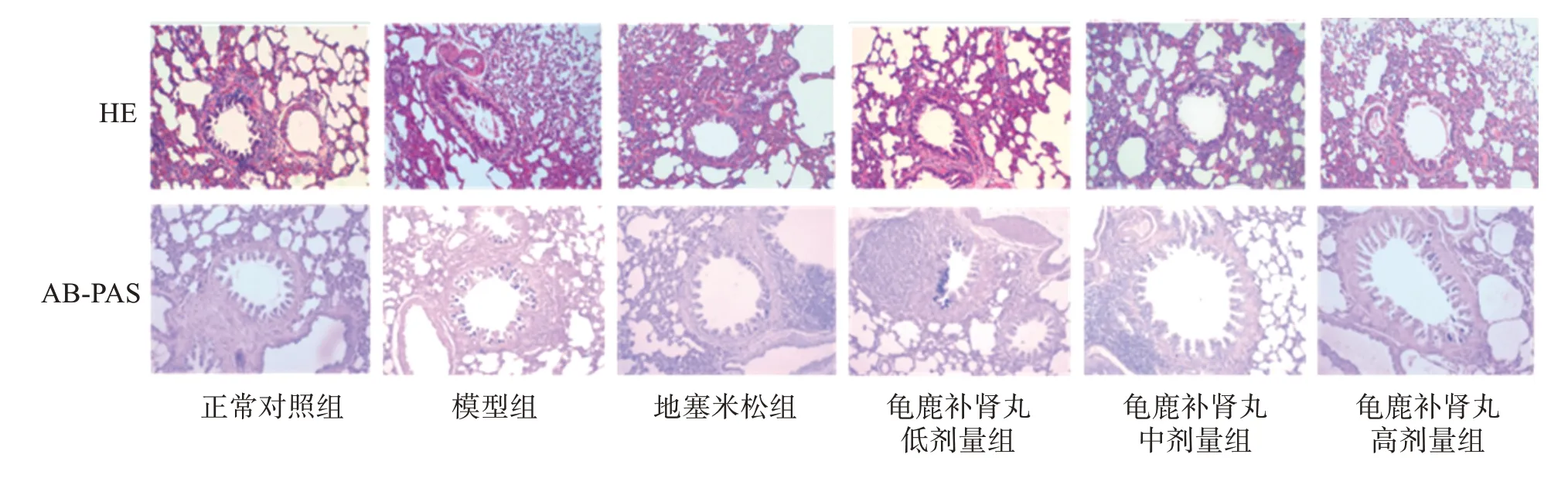
图1 龟鹿补肾丸对哮喘大鼠肺组织病理变化的影响(100×)Figure 1 Effect of Guilubushen pill on pathological change of lung tissue in asthmatic rats(100×)
AB-PAS 染色结果(图1)显示,正常对照组的大鼠气道组织无明显的杯状细胞和黏液分泌;模型组气道组织可见大量杯状细胞增生,气道黏液分泌增加,酸性黏液物质阳性面积显著高于正常对照组(P<0.01);地塞米松组和龟鹿补肾丸中剂量组大鼠气道组织杯状细胞数量明显减少,地塞米松组和龟鹿补肾丸低剂量、中剂量、高剂量组的大鼠酸性黏液物质阳性面积较模型组显著降低(P<0.01)。龟鹿补肾丸对哮喘大鼠酸性黏液物质阳性面积的影响见表5。
表5 龟鹿补肾丸对哮喘大鼠气道组织黏液物质阳性面积的影响Table 5 Effect of Guilubushen pill on the positive area of acidic mucous substances in the airway wall of asthmatic rats(±s,n=8)

表5 龟鹿补肾丸对哮喘大鼠气道组织黏液物质阳性面积的影响Table 5 Effect of Guilubushen pill on the positive area of acidic mucous substances in the airway wall of asthmatic rats(±s,n=8)
与正常对照组比较:##P<0.01;与模型组比较:**P<0.01。
酸性黏液物质阳性面积/%2.32±1.29 12.25±1.93##4.50±2.08**7.36±0.92**3.61±2.20**5.85±1.52**组别________________________________________正常对照组模型组地塞米松组龟鹿补肾丸低剂量组中剂量组高剂量组____________________________剂量/(g·kg-1)--0.5 mg 1.80 3.60 7.20
3.6 龟鹿补肾丸对哮喘模型大鼠BALF 中趋化因子、细胞因子水平影响
与正常对照组相比,模型组大鼠的BALF 中的IL-4、IL-5和IL-13水平显著升高(P<0.01),IFN-γ水平明显降低(P<0.05);与模型组相比,龟鹿补肾丸低、中、高剂量组和地塞米松组的BALF 中IL-4、IL-5 和IL-13 水平均显著下降(P<0.01 或P<0.05),龟鹿补肾丸高剂量组IFN-γ水平明显升高(P<0.01)。见表6。
表6 龟鹿补肾丸对哮喘模型大鼠BALF中趋化因子、细胞因子水平的影响Table 6 Effect of Guilubushen pill on chemokines and cytokines in BALF of asthmatic rats(±s,n=8)
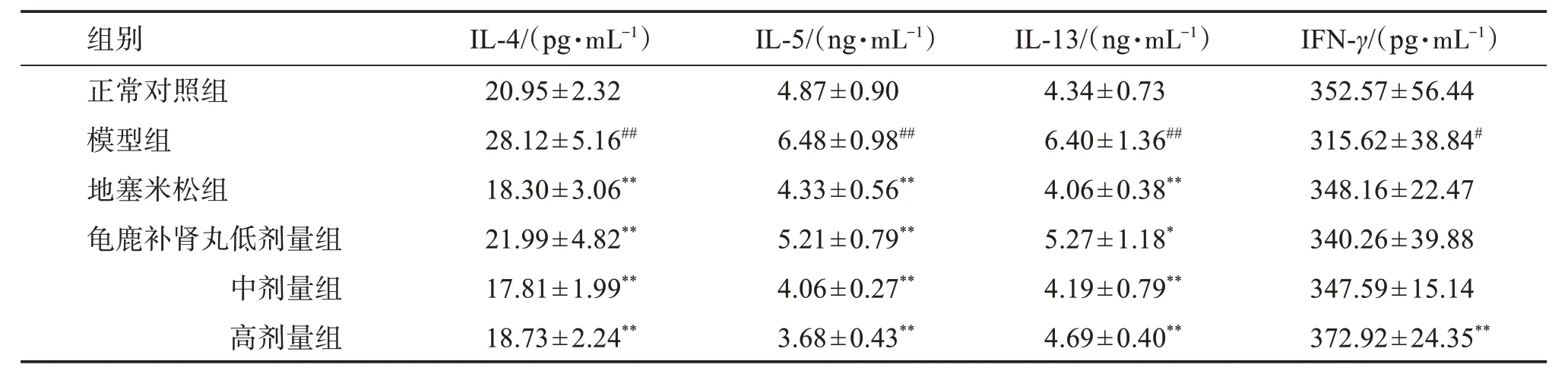
表6 龟鹿补肾丸对哮喘模型大鼠BALF中趋化因子、细胞因子水平的影响Table 6 Effect of Guilubushen pill on chemokines and cytokines in BALF of asthmatic rats(±s,n=8)
与正常对照组比较:#P<0.05,##P<0.01;与模型组比较:*P<0.05,**P<0.01。
IFN-γ/(pg·mL-1)352.57±56.44 315.62±38.84#348.16±22.47 340.26±39.88 347.59±15.14 372.92±24.35**组别_______________________正常对照组模型组地塞米松组龟鹿补肾丸低剂量组中剂量组高剂量组IL-4/(pg·mL-1)______20.95±2.32 28.12±5.16##18.30±3.06**21.99±4.82**17.81±1.99**18.73±2.24**IL-5/(ng·mL-1)_____4.87±0.90 6.48±0.98##4.33±0.56**5.21±0.79**4.06±0.27**3.68±0.43**_________________IL-13/(ng·mL-1)4.34±0.73 6.40±1.36##4.06±0.38**5.27±1.18*4.19±0.79**4.69±0.40**
3.7 龟鹿补肾丸对OVA 致哮喘模型大鼠肺组织T-bet、GATA-3 mRNA表达的影响
与正常对照组比较,模型组的大鼠肺组织T-bet mRNA 表达显著减少(P<0.01),GATA-3 mRNA 表达显著增加(P<0.01)。与模型组比较,地塞米松组的大鼠肺组织T-bet mRNA 表达显著增加(P<0.05),GATA-3 mRNA 表达显著减少(P<0.01),龟鹿补肾丸各组的大鼠肺组织T-bet mRNA 表达增加(P<0.05),GATA-3 mRNA 表达均显著减少(P<0.01)。见表7。
表7 龟鹿补肾丸对哮喘模型大鼠肺组织T-bet、GATA-3 mRNA表达的影响Table 7 Effect of Guilubushen pill on T-bet and GATA-3 mRNA in lung tissue of asthmatic rats(±s,n=8)

表7 龟鹿补肾丸对哮喘模型大鼠肺组织T-bet、GATA-3 mRNA表达的影响Table 7 Effect of Guilubushen pill on T-bet and GATA-3 mRNA in lung tissue of asthmatic rats(±s,n=8)
与正常对照组比较:#P<0.05,##P<0.01;与模型组比较:*P<0.05,**P<0.01。
GATA-3相对表达量0.96±0.04 1.35±0.25#0.45±0.07**0.58±0.06**0.78±0.17**0.69±0.24**组别_______________________正常对照组模型组地塞米松组龟鹿补肾丸低剂量组中剂量组高剂量组剂量/(g·kg-1)____________--0.5 mg 1.8 3.6 7.2 T-bet相对表达量1.05±0.25 0.10±0.02##0.47±0.12*0.49±0.26*0.61±0.28**0.82±0.14**
4 讨论
过敏性哮喘是由多种细胞(如嗜酸性粒细胞和T 淋巴细胞、肥大细胞、树突状细胞、2 型固有淋巴细胞)共同参与的慢性气道炎症。研究表明,气道炎症是引起过敏性哮喘的基本病理变化和反复发作的主要机制,而不同功能的T 细胞在气道炎症的始动和调节中起主导作用,其中辅助T 淋巴细胞(T helper cell,Th)两种亚型Th1 和Th2 的失衡是哮喘发病的重要机制[13]。在哮喘的发病中,Th2 亢进是哮喘形成及进展的关键性机制,Th2 细胞分泌的高水平致炎因子作用于呼吸道,炎症介质联合并导致平滑肌收缩、杯状细胞增生、黏液分泌增加、血管通透性增高以及EOS 浸润,慢性炎症持续进展会破坏气道上皮完整性[14]。哮喘患者气道炎症不仅与血清总IgE含量密切相关,T细胞的免疫失衡也是导致过敏性哮喘患者体内IgE 合成增多,EOS 灭活减少的重要原因[15]。本研究结果表明,与模型组比较,龟鹿补肾丸能显著降低过敏性哮喘大鼠BALF和外周血的总白细胞数,并且其淋巴细胞百分比和嗜酸性粒细胞百分比也明显减少,外周血的IgE 水平明显下降,改善支气管及血管周围炎性细胞浸润,减少黏液分泌,提示龟鹿补肾丸能缓解OVA 诱导的过敏性哮喘大鼠的气道炎症。
研究表明Th2型细胞因子增高在过敏性哮喘发病机制中起着重要的作用。Th2细胞分泌多种细胞因子,其中IL-4、IL-5 和IL-13 不仅在过敏性哮喘病理生理中起着核心作用,还可进一步促进Th2 型细胞的发育[16]。IL-4 为Th2 细胞分泌的代表因子,不仅能促进Th2 分泌IL-5 及其他促炎细胞因子,同时还能抑制Th1 分泌IFN-γ等抗炎细胞因子,促使Th1/Th2 平衡向Th2 转化;另外,IL-4 能促进B 细胞分化、增殖和活化,刺激B 细胞合成IgE。IL-13 与IL-4 均可与IL-4 受体a(IL-4 receptor,IL-4Ra)结合,两者均可诱导杯状细胞化生,促进黏液的产生。IL-5 作为EOS 的关键调节因子,可诱导EOS 从血液进入肺实质,并促进EOS 的成熟、活化[17]。相关研究也表明Th1分泌的细胞因子对哮喘的发生发展存在一定的抑制作用。IFN-γ为Thl 型细胞因子的代表,通过抑制IL-4、IL-5 合成阻断IgE 的生成,同时在Th0 的分化过程中,可以诱导其向Th1 细胞的方向分化[18]。
Th1/Th2 失衡是哮喘发病的重要基础,而决定Th0细胞定向分化的关键调控因素为转录因子的选择性表达。转录因子中T-bet 是Th1 细胞特异性的转录因子,促进Th1细胞分化和Th1型细胞因子(如IFN-γ)分泌,并具有逆转Th2 为Th1 的作用[18]。GATA-3 是Th2 细胞特异性的转录因子,GATA-3 能激活IL-4、IL-5、IL-13等所有Th2型细胞因子的启动子,诱导IL-4、IL-5、IL-13等的表达,在T细胞的发育和Th2 细胞分化中起关键作用,并可将Th1 逆转为Th2[19]。因此,促进T-bet 表达和抑制GATA-3 表达,可逆转Th2漂移,促进Th1型细胞因子的合成,抑制Th2 型细胞因子的合成,有利于控制气道炎症[20]。
本文在明确龟鹿补肾丸能减轻过敏性哮喘大鼠气道炎症作用的基础上,选取哮喘免疫调节机制中经典的Th1/Th2 失衡作为主要研究对象,通过观察龟鹿补肾丸对哮喘大鼠BALF中IL-4、IL-5、IL-13和IFN-γ水平的干预以及肺组织T-bet、GATA-3 mRNA表达的影响,探讨其对防治哮喘的作用机制。研究结果显示,OVA 刺激后模型组大鼠BALF 中的IL-4、IL-5、IL-13 含量显著上升,IFN-γ含量明显降低,大鼠肺组织的T-bet mRNA 表达量明显减少,GATA-3 mRNA 表达量显著增加。经龟鹿补肾丸干预后BALF 中IL-4、IL-5、IL-13 含量明显下降,IFN-γ含量明显升高,大鼠肺组织的T-bet mRNA 表达量显著增加,而GATA-3 mRNA 表达量明显减少,提示龟鹿补肾丸可能通过抑制Th2 分化,纠正Th1/Th2的平衡,改善由OVA 造成的气道炎症损伤。
综上所述,龟鹿补肾丸能减轻OVA 致过敏性哮喘模型大鼠气道炎症,其机制可能是通过促进T-bet mRNA表达和IFN-γ分泌,抑制GATA-3 mRNA表达和IL-4、IL-5 和IL-13 产生,从而调节Th1/Th2 失衡,调节炎性因子水平以发挥抑制哮喘性气道炎症的作用。

