黄芩苷对糖尿病大鼠血管损伤的保护作用及机制
方喜波,张英杰,王洪新
锦州医科大学1.第一附属医院心内科,2.心脑血管药物研究重点实验室,辽宁 锦州 121001
糖尿病是我国第三大死亡原因,目前仅有25.8%的糖尿病患者接受糖尿病治疗[1]。糖尿病作为一组以高血糖为特征的代谢性疾病,可致多个器官长期损伤、功能障碍和衰竭,尤其是眼、肾、心和血管[2]。血管内皮功能紊乱、血管炎症及氧化应激参与糖尿病及其引起的血管损伤的发生与发展[3]。在哺乳动物中,NF-κB 网络由5 个家族成员蛋白单体(p65/RelA、RelB、cRel、p50 和p52)组成,并受两种途径的调节:经典NF-κB 必需调节剂依赖途径和非经典途径。研究表明,NF-κB 与糖尿病有紧密联系[4]。ROS 作为氧化应激反应的主要调控因子,可通过NF-κB 激活氧化应激[5]。NF-κB/ROS 信号通路在脂多糖诱导的氧化应激及炎症反应中起重要作用[6]。黄芩最早记载于神农本草经,黄芩苷是黄芩的主要成分。大量的研究表明,黄芩苷具有抗病毒、抗氧化、抗凋亡等药理作用,且能改善糖尿病大鼠的心肌功能、肾功能受损;黄芩苷可保护胚胎心血管发育,改善脑小血管病认知障碍,并能通过降低NF-κB 活化预防糖尿病相关的高血压和血管反应性改变[7~11]。但NF-κB/ROS 信号通路在糖尿病大鼠的作用未知,因此,本实验探讨黄芩苷对糖尿病大鼠血管损伤的影响及其可能的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8 周龄的健康雄性SD 大鼠(体重180~200 g),购自锦州医科大学实验物中心,动物许可证号:SCXK(辽)2014-0004。
1.1.2 药品与试剂 黄芩苷(纯度>98%),购自南京景竹生物科技有限公司。超氧化物阴离子荧光探针(碧云天生物技术有限公司);GSH-px ELISA 试剂盒、MDA ELISA试剂盒、IL-1β ELISA试剂盒、IL-18 ELISA 试剂盒、IL-6 ELISA 试剂盒和TNF-α ELISA 试剂盒(上海Mlbio 生物科技有限公司);β-actin、eNOS抗体(美国Abclonal 公司);NF-κB 抗体(美国Absci 公司);羊抗兔FITC-IgG 荧光抗体(万类生物技术有限公司);去甲肾上腺素、乙酰胆碱、链脲佐菌素(STZ,美国Sigma 公司)。
1.1.3 仪器 Bio-Rad 电泳系统、半干转膜仪、化学发光成像仪(Bio-Rad 公司);NM-9602G 酶标分析仪(Thermo Fisher Scientific 公司);显微镜(Leica,德国);制冰机(日本大阪松下电器产业株式会社);DMT 720 M 离体微血管张力测定仪(丹麦Myotechnology 公司);干燥箱(上海福玛实验有限公司)。
1.2 方法
1.2.1 分组及给药 大鼠自由进食、进水,动物室内温度18~25 ℃,相对湿度45%~60%。将大鼠随机分为4 组,每组10 只,分别做标记。4 组处理如下。空白组:腹腔注射PBS 后以0.5%羧甲基纤维素钠灌胃;模型组:链脲佐菌素(Streptozocin,STZ)(65 mg·kg-1·d-1)腹腔注射后以0.5%羧甲基纤维素钠灌胃;中剂量给药组:STZ(65 mg·kg-1·d-1)腹 腔注射后以 黄芩 苷(50 mg·kg-1·d-1)灌胃;高剂量给药组:STZ(65 mg·kg-1·d-1)腹腔注射后以黄芩苷(100 mg·kg-1·d-1)灌胃。灌胃28 d 后,通过心尖穿刺取血,离心收集血清,并收集胸主动脉组织用于后续实验。
1.2.2 HE 染色 将收集的胸主动脉组织进行石蜡包埋,切片。各组切片置于60 ℃烤箱烘烤2 h,脱蜡水化进行常规HE 染色,显微镜下观察,采用Image-pro plus6.0 软件测量各组大鼠胸主动脉中层厚度。
1.2.3 离体血管环实验 将收集的新鲜离体胸主动脉于显微镜下剥离并去除周围脂肪组织,眼科剪剪成2~3 mm 长度的血管环,置于DMT 720 M 离体微血管张力测定仪的浴槽中检测血管张力。待温度上升至37 ℃后,调节血管环静息张力为10 mN,平衡60 min。在浴槽内添加终浓度为1 μmol/L 的去甲肾上腺素(Phenylephrine,PE)。待曲线达到平台时,在浴槽内添加累积浓度乙酰胆碱(Acetylcholine,Ach,1~10 μmol/L),PE 预收缩的血管环中添加累积浓度的Ach,可引起血管的依赖性舒张,血管舒张功能检测多用于评估血管内皮功能。记录并建立剂量-反映曲线、曲线下面积(AUC)和最大舒张(Emax)。
1.2.4 ELISA法按照ELISA 试剂盒说明书,测定大鼠血清中IL-1β、IL-18,TNF-α,IL-6,MDA 和GSH-px的含量。
1.2.5 免疫蛋白印迹 在100 mg 样品中加入1 mL RIPA 裂解液(含PMSF),超声30 s 后,冰上裂解30 min,4 ℃,12 000 rpm,离心15 min,取上清,进行BCA蛋白含量测定。制样后,进行SDS-PAGE 电泳,转膜,BSA 摇床封闭1 h,按以下比例一抗4 ℃孵育过夜:eNOS(1:1000)、NF-κB(1:1000)和β -actin(1:100000)。TBST 室温下摇床洗涤3 次后,室温摇床孵育相应二抗1.5 h,TBST 洗涤后,用ECL 化学显影法显影,凝胶图像处理系统分析各个条带的密度。
1.2.6 DHE 染色 根据试剂盒说明,用DHE 染色检测大鼠血管组织中ROS 含量。
1.2.7 NO 检测 根据试剂盒说明书,采用硝酸还原酶法对NO 反应产物硝酸盐和亚硝酸盐(NO3-+NO2-)进行定量。简而言之,硝酸盐被硝酸还原酶转化为亚硝酸盐,使用Griess 试剂在550 nm 的吸光度下测定亚硝酸盐的生成量。
1.3 统计学分析
采用SPSS25.0 统计软件进行数据分析,数据均以()表示。多组间显著性检验采用单因素方差分析(ANOVA)和LSD 法。P<0.05 认为差异具有统计学意义。
2 结果
2.1 黄芩苷对糖尿病大鼠血管内皮功能影响
与空白组相比,糖尿病模型组血管舒张功能显著受损,Ach 引起的血管舒张率、AUC 和Emax 均降低。黄芩苷治疗后,糖尿病大鼠的血管舒张功能得到显著改善,Ach 引起的血管舒张率、AUC 和Emax 均提高。说明黄芩苷可以改善糖尿病诱导血管内皮功能紊乱(图1)。
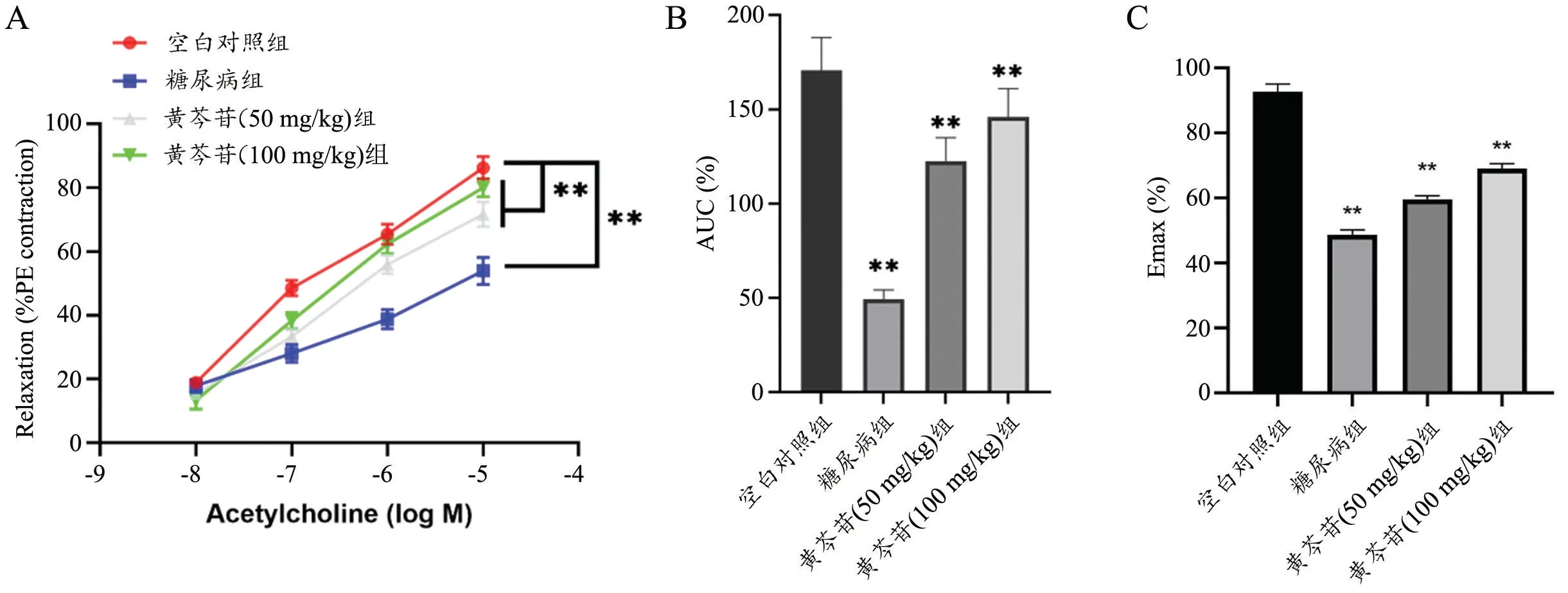
图1 黄芩苷对糖尿病大鼠血管内皮功能影响PE 预收缩后Ach 引起血管舒张率(A)、AUC(B)和Emax(C)升高n=3 **P<0.01,与模型组比较Fig.1 Effect of baicalin on vascular endothelial function in diabetic rats.Ach induced vasodilation (A),AUC (B),and Emax (C) under PE precontraction, n=3,**P<0.01 vs diabetes group
2.2 黄芩苷对糖尿病大鼠主动脉形态学影响
HE 染色观察结果表明,与空白组比较,模型组大鼠主动脉中层明显增厚,细胞膨大且排列紊乱;与模型组比较,给药组(50 mg/kg 和100 mg/kg)大鼠主动脉中层厚度明显改善,细胞形态与排列恢复(图2)。
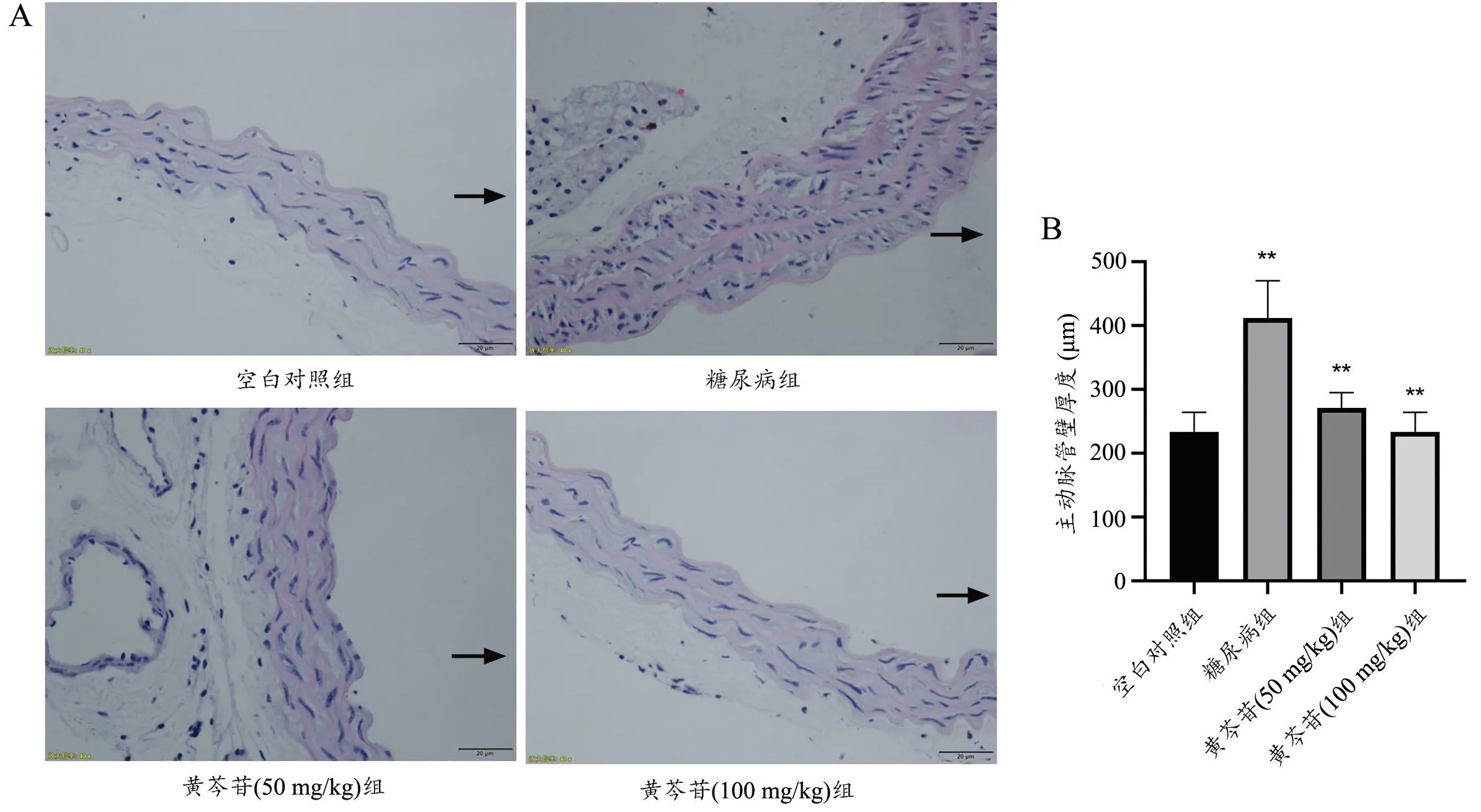
图2 黄芩苷对糖尿病大鼠主动脉形态学影响A:HE 染色(标尺20 μm)箭头指管腔侧 B:统计图n=4 ** P<0.01,与模型组比较Fig.2 Effects of baicalin on aortic morphology in diabetic ratsA: HE staining (scale bar=20 μm),the arrow pointed to the lumen side; B: Statistical chart, n=4,**P<0.01 vs diabetes group
2.3 黄芩苷对糖尿病大鼠血管炎症影响
与空白组比较,模型组大鼠血清中IL-1β、IL-18,TNF-α 和IL-6 含量显著升高;与模型大鼠比较,给药组(50 mg/kg 和100 mg/kg)大鼠血清中IL-1β、IL-18,TNF-α 和IL-6 含量显著降低(图3)。说明黄芩苷能够减轻糖尿病大鼠血管炎症反应。
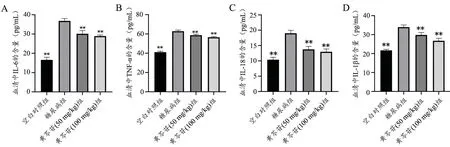
图3 黄芩苷对糖尿病大鼠血管促炎细胞因子IL-6(A)、TNF-α(B)、IL-18(C)和IL-1β(D)影响 n=6 *P<0.05,**P<0.01,与模型组比较Fig.3 Effects of baicalin on IL-6 (A),TNF-α (B),IL-18 (C) and IL-1β (D) in diabetic rats n=6,*P<0.05,**P<0.01 vs diabetes group
2.4 黄芩苷对糖尿病大鼠血管组织eNOS/NO 影响
与空白组相比,模型组大鼠主动脉组织中eNOS蛋白表达和血清NO 水平显著降低。与模型组相比,给药组主动脉eNOS 蛋白表达和血清NO 水平显著升高(图4)。
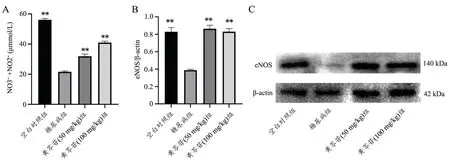
图4 黄芩苷对糖尿病大鼠血清NO(A)和主动脉eNOS 蛋白表达(B~C)影响 n=3 ** P<0.01,与模型组比较Fig.4 Effects of baicalin on serum NO (A) and aortic eNOS protein expression (B-C) in diabetic rats n=3,**P<0.01 vs diabetes group
2.5 黄芩苷对糖尿病大鼠血管氧化应激及NF-κB/ROS 信号通路影响
通过DHE 染色检测各组大鼠主动脉中ROS 形成情况,ELISA 检测各组大鼠血清中GSH-px 和MDA 水平,免疫蛋白印迹检测各组大鼠血管中NF-κB 蛋白表达水平,结果表明,与空白组比较,模型组大鼠主动脉组织中ROS 含量和NF-κB 蛋白表达水平显著升高,血清MDA 水平增加,血清中GSH-px 含量显著降低;与模型组比较,给药组大鼠主动脉ROS 含量和NFκB 蛋白表达水平显著降低,血清MDA 水平减少,血清中GSH-px 含量显著增加,说明黄芩苷能改善糖尿病大鼠血管氧化应激,并可能通过NF-κB/ROS 信号通路(图5)。

图5 黄芩苷对糖尿病大鼠血管氧化应激及NF-κB/ROS 信号通路影响A:各组大鼠主动脉组织中ROS 形成情况DHE 染色 B:各组大鼠主动脉组织中ROS 形成情况统计图 C:各组大鼠血清中GSH-px 统计图D:各组大鼠血清中MDA 水平统计图E~F:各组大鼠动脉组织中NF-κB 蛋白表达水平蛋白印迹及统计图n=3 *P<0.05,**P<0.01,与模型组比较Fig.5 Effects of baicalin on oxidative stress and NF-κB/ROS signaling pathway in diabetic ratsA: The formation of ROS in aorta tissues in each group was stained by DHE; B: Statistical chart of formation of ROS in aorta tissues in each group; C: Statistical chart of GSH-Px in serum of rats in each group; D: Statistical chart of MDA levels in serum of rats in each group; E-F: The expression level of NF-κB protein in arterial tissues of rats in each group and statistical chart; n=3,*P<0.05,**P<0.01 vs diabetes group
3 讨论
据国际糖尿病联合会估计,目前全世界有4.15 亿人被诊断糖尿病,至2040 年将增加到6.4 亿。糖尿病的心血管合并症,作为独立的危险因素,是糖尿病患者死亡率升高的主要原因[2]。血管内皮细胞为血管的第一道防线,糖尿病可通过氧化应激、炎症反应等多种机制致内皮细胞受损,受损的内皮细胞可使血管舒张功能下降,加重血管内皮功能障碍,进一步促进心血管疾病的发生[12]。NO 为内皮细胞重要的血管舒张因子,eNOS 则是一种调控NO 产生的酶,两者是早期血管内皮功能紊乱的重要检测指标。研究表明,糖尿病及其血管疾病与血管炎症反应密切相关,IL-1β、IL-18、TNF-α 和IL-6 为直接促炎细胞因子,可促进糖尿病组织和全身炎症的发展[3]。由于现在的治疗方法对糖尿病心血管合并症效果欠佳,迫切需要其他方法治疗糖尿病诱导血管损伤,以缓解糖尿病相关血管合并症的发生与发展。本实验结果表明,经黄芩苷处理28 d 后,糖尿病大鼠主动脉中层增厚缓解,细胞形态和排列恢复,受损的血管舒张功能得以改善,炎症因子(包括IL-1β、IL-18、TNF-α 和IL-6)分泌减少,eNOS 蛋白表达水平及NO 水平增加。说明黄芩苷对链脲佐菌素诱导的糖尿病大鼠血管内皮功能紊乱及血管炎症具有保护作用。
在糖尿病动物模型中,氧化应激所致的活性氧水平和谷胱甘肽水平增加及脂质过氧化增加,加重糖尿病血管并发症的发生[12]。研究证实,NF-κB 可激活ROS 信号通路;也可通过增加抗氧化蛋白表达影响ROS 的水平[13];NF-κB/ROS 信号通路在脂多糖诱导的氧化应激及炎症反应中起重要作用[6]。因此推测黄芩苷是否通过NF-κB/ROS 信号通路在糖尿病大鼠血管损伤发病机制中起至关重要的作用。结果表明,黄芩苷能减少糖尿病大鼠主动脉组织中ROS 含量和NF-κB 蛋白表达水平,增加血清中MDA 和GSH-px 水平。说明黄芩苷能减轻链脲佐菌素诱导的糖尿病大鼠血管氧化应激,并可能通过NF-κB/ROS 信号通路,从而改善其引起的血管损伤。
本实验结果表明,黄芩苷能改善链脲佐菌素诱导的糖尿病大鼠血管损伤,其可能作用机制是通过NFκB/ROS 信号通路。本研究可为糖尿病的临床治疗提供依据。