TNF-α联合H2O2诱导对大鼠心肌细胞氧化应激和炎症损伤的影响
徐文珍,邓泽元,李红艳
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330031)
机体内氧化和抗氧化反应失衡,是造成机体氧化应激的重要原因,其中活性氧的过量产生是导致心肌细胞损伤的主要因素之一[1,2]。过氧化氢(H2O2)是致使细胞氧化应激的重要因子,使细胞产生大量ROS,加速凋亡进程,进而诱发心血管疾病。H2O2对心肌细胞的氧化损伤是实验室中用来模拟心肌细胞损伤的常用方法[3]。
适量的免疫因子可以提高机体抵抗外界刺激和修复机体损伤的能力,而持续过量的刺激物产生的免疫活性物质则会引起细胞的炎症反应,导致细胞的损伤和凋亡[4]。肿瘤坏死因子α(Tumor Necrosis Factor-α,TNF-α)是体内重要的炎症细胞因子,在急性心肌梗死、冠状动脉硬化及心力衰竭等心血管疾病中起着重要作用[5],TNF-α可诱导趋化因子和细胞粘附分子,从而诱导心肌细胞损伤和破坏心肌组织[6,7]。TNF-α激活核转录因子-κB( nuclear factor κB,NF-κB),NF-κB信号通路的激活可以干预炎症反应。
然而,传统的心肌细胞损伤模型往往采用单一的高浓度脂多糖(LPS)或TNF-α诱导炎症损伤,或者单一地用H2O2诱导氧化应激,并不能达到心肌细胞同时产生氧化应激和慢性炎症的效果。所以,本研究以低浓度TNF-α联合H2O2共同诱导大鼠心肌细胞,同时达到氧化和炎症损伤的效果,为抗氧化、抗炎作用研究提供参考。
1 材料与方法
1.1 细胞
从武汉普诺赛生物购入大鼠心肌细胞(H9c2)。
1.2 仪器与试剂
EXL800全自动酶标仪购买自美国Biotek Instruments有限公司;FACS Calibur流式细胞仪购买自美国Becton Dickinson公司;转膜仪、ChemiDocTMXRS+化学发光成像仪和CRX96 Touch 实时定量PCR均购买自美国Bio-Rad公司;自蛋白质电泳仪购买自北京六一生物科技有限公司;Nano Drop 8000超微量分光光度计购自Thermo Fisher科技公司;Neofuge 15R型台式高速冷冻离心机和JY-86-2-50型-80 ℃冰箱均购买自香港力康发展有限公司;HH-4型数显恒温水浴锅购买自国华电器有限公司;GPST200型CO2恒湿恒温培养箱均购买自长沙长锦科技有限公司;37XC (XDS-1A)型倒置显微镜购买自上海蔡康化学仪器公司;BHC-1300A/B3型生物安全柜购买自苏州安泰空气技术有限公司。
TNF-α购于美国PeproTech有限公司;二甲基亚砜和30 % H2O2溶液购于美国Sigma 公司;胎牛血清和DMEM高糖培养基购于以色列Biolnd公司;链霉素/青霉素、胰蛋白酶、丙酮酸钠和DEPC水购于北京索莱宝科技有限公司;磷酸缓冲盐(PBS)购于北京中杉金桥生物技术有限公司;活性氧(ROS)检测试剂盒、总SOD活性检测试剂盒、脂质氧化(MDA)检测试剂盒、CCK-8试剂盒、BCA蛋白浓度测定试剂盒、RIPA、蛋白酶抑制剂、蛋白酶抑制剂苯基磺酰氟(phenylmethylsulfonyl fluorid ,PMSF)购于上海碧云天生物技术有限公司;南京建成生物工程研究所购入TNF-α 酶联免疫吸附试剂盒和IL-1β 酶联免疫吸附试剂盒;TRIzolTMReagent购于Thermo Fisher科技公司,PrimeScriptTMRT reagent Kit with Gdna Eraser (Perfect Real Time)和Beastar© qPCR mastermix(SYBR Green)购于日本TaKaRa公司。其他试剂均为国产分析纯。
1.3 细胞培养
用10%胎牛血清+ 1%青霉素-链霉素+1%丙酮酸钠配制成10% DMEM完全培养基,培养H9c2大鼠心肌细胞,将细胞传代后放在37 ℃,5% CO2恒温培养箱中培养。
1.4 CCK-8法检测H2O2和TNF-α对H9c2大鼠心肌细胞细胞活力的影响
将H9c2细胞以5×104mL接种到96孔板中,在细胞达到70%~90%细胞密度后舍弃原始培养基,将药物按一定的剂量进行分组处理。采用0(Control组),50、100、150、200、250、300、350 μmol·L-1H2O2处理H9c2细胞1 h。在确定TNF-α的最佳浓度实验中,采用0(Control组),10、20、40、60、80、100、200 ng·mL-1TNF-α处理H9c2细胞12 h,每组 6 个复孔。倒掉旧培养基,用 PBS 洗涤 2 次。每孔加入10 μL CCK-8溶液,培养箱孵育1 h,在酶标仪450 nm 处读取光密度(OD) 值,以公式“细胞存活率 = OD待测孔/O D对照孔×100%” 计算各组细胞存活率,以反映细胞的增殖活性。在后续研究中,按照细胞存活率分别选取了H2O2和TNF-α的最佳刺激剂量。
1.5 流式细胞术检测H9c2细胞内ROS水平
将H9c2细胞以5×104mL接种到十二孔板中,细胞融合到70%~90%后弃去原培养基,再加入不同剂量的药物进行分组处理。随后,用无血清培养基将DCFH-DA配制成5 μmol·L-1。PBS清洗3次后,每孔加入500 μL DCFH-DA,37 ℃培养箱孵育20 min[8]。加入无血清培养基清洗3次,加入0.15%的胰酶消化液,收集细胞后离心,流式细胞仪检测荧光强度。
1.6 酶联免疫吸附实验
将H9c2细胞以5×104mL接种到十二孔板中,细胞融合到70%~90%后弃去原培养基,再加入不同剂量的药物进行分组处理。采用0(Control组),10,20,40,60,80,100 ng·mL-1TNF-α诱导H9c2细胞12 h后,收集H9c2细胞上清液后,根据ELISA试剂盒的使用方法,按步骤检测TNF-α和白细胞介素1β(interleukin-1β,IL-1β)的分泌量。
1.5 蛋白免疫印迹法(Western Blot)检测大鼠心肌细胞炎症相关蛋白的表达
H9c2细胞接种到小平皿中,细胞融合到70%~90%后弃去原培养基,再加入不同剂量的药物进行分组处理。采集各组H9c2细胞,加入配制的冰冷裂解液(1 mL RAPA中加入10 μL蛋白磷酸酶抑制剂和10 μL苯甲基磺酰氟),在冰上裂解 30 min 后,离心并收集上清液,提取细胞总蛋白,然后使用 BCA 试剂盒检测蛋白浓度,用10% SDS-PAGE凝胶电泳对蛋白质分离,随后利用恒流转到PVDF膜上[9]。随后用5%脱脂乳在室温下封闭PVDF膜2 h,并与相应的一抗[ICAM(1:5000),TNF-α(1:1000),IL-6(1:1000),VCAM(1:3000)]4 ℃ 孵育过夜。TBST清洗3个10 min,3个5 min后,将膜和相应二抗置于摇床上孵育2 h 。最后,利用ECL化学发光液,避光孵育10~30 s,用凝胶成像仪对目的条带拍照,并用 Image Lab 软件对其进行分析,以目标蛋白条带灰度值与 β-actin 条带灰度值比值为指标进行蛋白质表达的相对定量[9]。
1.6 SOD和MDA水平
将H9c2细胞以5×104mL接种到十二孔板中,细胞融合到70%~90%后弃去原培养基,再加入不同剂量的药物进行分组处理。采用Control组、只加80 ng·mL-1TNF-α处理12 h组、只加200 μmol·L-1H2O2处理1 h组和200 μmol·L-1H2O2处理1 h联合80 ng·mL-1TNF-α处理12 h组,分别诱导H9c2细胞后,用组织裂解液裂解细胞后收集H9c2细胞上清液,参照SOD酶活力检测分析试剂盒测定细胞内SOD活力,参照MDA检测试剂盒测定细胞内MDA活性。
1.7 荧光定量PCR技术测定炎症因子mRNA的表达
H9c2细胞接种到六孔板中,细胞融合到70%~90%后弃去原培养基,再加入不同剂量的药物进行分组处理。实验分为采用Control组、只加80 ng·mL-1TNF-α处理12 h组、只加200 μmol·L-1H2O2处理1 h组和200 μmol·L-1H2O2处理1 h联合80 ng·mL-1TNF-α处理12 h组诱导H9c2细胞。随后,PBS清洗3次,每孔加入1mL的TRIzol 试剂,4 ℃孵育10 min,将细胞吹散后,转移至1.5 mL EP管中,加入200 μL三氯甲烷后用力上下振荡,室温静置10 min,后离心(4 ℃,12 000 r·min-1,15 min),吸取上清液至新的干净EP管中,加入500 μL异丙醇,轻柔上下摇晃混匀,静置10 min后离心(4 ℃,12 000 r·min-1,15 min)。管壁可观察到RNA沉淀,弃上清后加入1 mL 75%乙醇,静置5 min后离心(4 ℃,12 000 r·min-1,15 min)。最后,吸掉多余上清,将RNA沉淀至于无菌操作台晾干,加入20 μL DEPC水混匀,后利用超微量核酸分析仪测定浓度,判断RNA样品纯度。为了测定各样品的 TNF-α、IL-6、VCAM mRNA 表达,TaKaRa 反转录试剂盒进行反转录,并采用 SYBR Green PCR Master Mix 扩增反转录后的产物,将cDNA作为模板进行荧光定量PCR,利用荧光定量PCR 仪进行扩增。引物由上海生工生物有限公司合成,引物序列如表1所示。对β-actin的mRNA表达进行标准化,根据2(-ΔΔCt)法计算每种mRNA的基因表达的相对定量。

表1 目的基因引物序列Table 1 Primer sequence of target gene
1.8 统计分析
通过 GraphPad Prism 8.0 软件进行处理,采用SPSS 26.0单因素方差分析进行统计处理,所有数据用均数±标准误(mean±SEM)表示,以Duncan多重比较进行显著性分析,p<0.05表示差异具有统计学显著性。
2 结果分析
2.1 不同浓度H2O2对H9c2细胞的细胞活力和ROS水平的影响
采用CCK-8法测定H9c2细胞活力,如图1A所示,与Control组(100%)相比,50、100、150、200、250、300、350 μmol·L-1H2O2组作用1 h后,H9c2细胞存活率分别下降至92%±1.6%、83%±1.4%、75%±3.5%、59%±2.6%、36%±1.9%、23%±0.29%、23%±0.21%。随着H2O2浓度升高,大鼠心肌细胞细胞活力不断降低。当H2O2浓度高于100 μmol·L-1时,细胞活力显著下降,并呈现出一定的剂量依赖关系(p<0.05)。当H2O2浓度为200 μmol·L-1时,细胞存活率为59%±2.6%,表明细胞处于氧化应激状态,但是当细胞活力低于40%时,细胞氧化损伤严重,无法进行修复。
如图1B所示,与Control组相比,不同浓度(50、100、150、200、250、300、350 μmol·L-1)H2O2作用1 h后,均对H9c2细胞造成了不同程度的氧化损伤。与Control组(100%)相比,50 μmol·L-1H2O2组H9c2细胞内ROS水平(97%±8.26%)无显著性差异;100、150、200、250 μmol·L-1H2O2组H9c2细胞内ROS水平上升至 166%±14.8%、276%±3.04%、266%±13.9%、107%±4.78%;300、350 μmol·L-1H2O2组H9c2细胞内ROS水平下降至83%±12.6%、84%±10%。当H2O2浓度为0~150 μmol·L-1时,细胞内ROS水平显著升高(p<0.05),且呈剂量依赖性;当H2O2浓度为150或200 μmol·L-1时,细胞内ROS水平达到最大。
结合H2O2对H9c2细胞的细胞活力和ROS水平,初步将H2O2浓度设为200 μmol·L-1。此时,ROS水平达到较高水平,细胞处于氧化应激状态,不会导致立即细胞死亡,但在抗氧化活性物质作用下,还可能被修复。
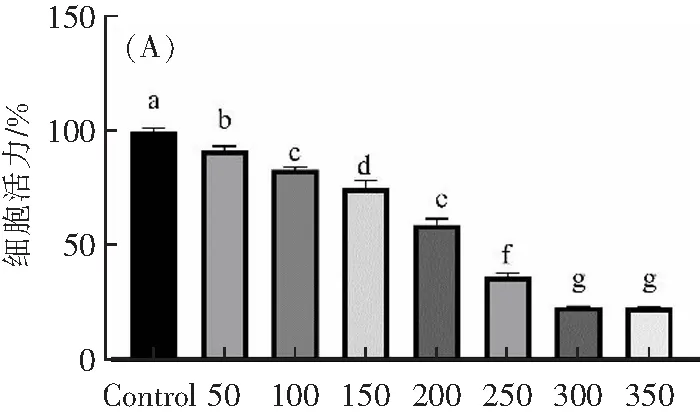
H2O2浓度/(μmol·L-1)

H2O2浓度/(μmol·L-1)
2.2 不同剂量TNF-α对H9c2细胞的细胞活力和ROS生成的影响
如图2A所示,0(Control组),10、20、40、60、80、100、200 ng·mL-1TNF-α组H9c2细胞存活率分别为100%、112%±0.89%、109%±2%、107%±2%、107%±1.1%、110%±1%、111%±1.8%、106%±1.7%,与Control组相比,没有显著性差异(p>0.05)。当TNF-α低于200 ng·mL-1时,对H9c2细胞没有毒性作用。
如图2B所示,与Control组相比,与Control组(100%)相比,10、20、40、60、80、100、200 ng·mL-1TNF-α组H9c2细胞内ROS水平分别上升至103%±26.23%、168%±33.6%、169%±6%、126%±8.7%、213%±%、314%±40.6%。与Control相比,当TNF-α作用浓度低于60 ng·mL-1时,细胞内ROS水平没有显著性差异(p>0.05);当TNF-α作用浓度高于60 ng·mL-1时,细胞内ROS水平显著提高(p<0.05)。

TNF-α浓度/(ng·mL-1)

TNF-α浓度/(ng·mL-1)
2.3 不同剂量TNF-α对H9c2细胞中炎症因子释放的影响
如图3A所示,0(Control组)、1、10、20、40、60、80、100 ng·mL-1TNF-α组作用12 h后,H9c2细胞上清液中IL-1β释放量分别约为7.5、4.6、7.7、7.1、7.4、8.6、8.2、8.8 ng·mL-1。与Control组相比,不同剂量TNF-α作用12 h后,细胞上清液中IL-1β释放量没有显著性差异(p>0.05)。如图3B所示,与Control组(4.4 ng·mL-1)相比,10、20、40、60、80、100 ng·mL-1TNF-α组作用12 h后,H9c2细胞上清液中TNF-α释放量分别上升至6.5±0.3、6.7±0.45、6±0.34、7.9±0.4、7.1±0.59、5.3±0.3 ng·mL-1。当使用TNF-α浓度高于10 ng·mL-1的TNF-α作用12 h后,细胞上清液中TNF-α释放量显著增强(p<0.05)。
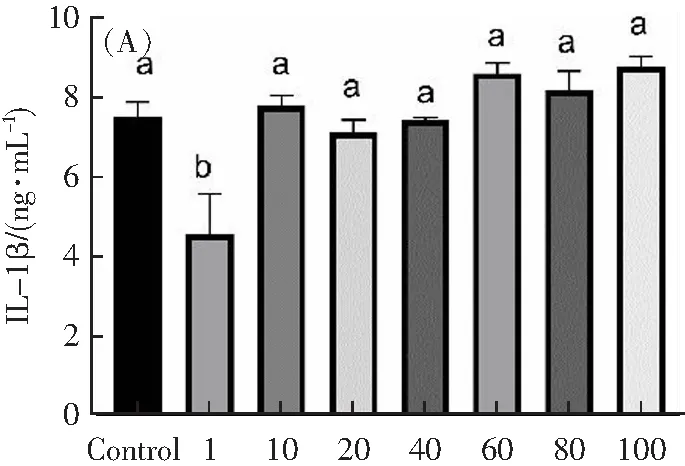
TNF-α浓度/(ng·mL-1)
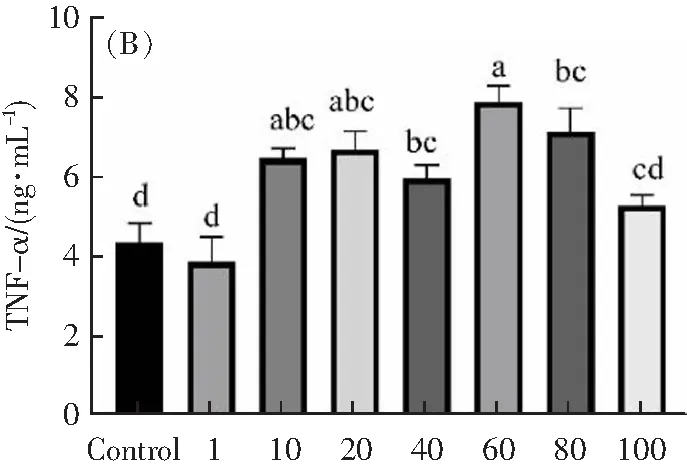
TNF-α浓度/(ng·mL-1)
综合细胞内ROS水平、上清液IL-1β释放量、上清液TNF-α释放量,初步选择80 ng·mL-1TNF-α诱导H9c2细胞炎症损伤。此时,ROS水平和上清液TNF-α释放量均与Control组有显著性差异,为Control组的2倍左右,提示出现炎症损伤。
2.4 不同剂量H2O2联合80 ng·mL-1的TNF-α对H9c2细胞ROS水平的影响
与Control组相比,100、150、200 μmol·L-1H2O2作用1 h联合80 ng·mL-1的TNF-α作用12 h后,各组H9c2细胞内ROS水平分别上升至456%±106.4%、639%±60%、845%±8.3%。当H2O2浓度不断增大时,H9c2细胞内ROS水平也不断增高。200 μmol·L-1H2O2作用1 h联合80 ng·mL-1的TNF-α作用B12 h后,细胞内ROS水平增至最大,约为Control组的8.5倍。
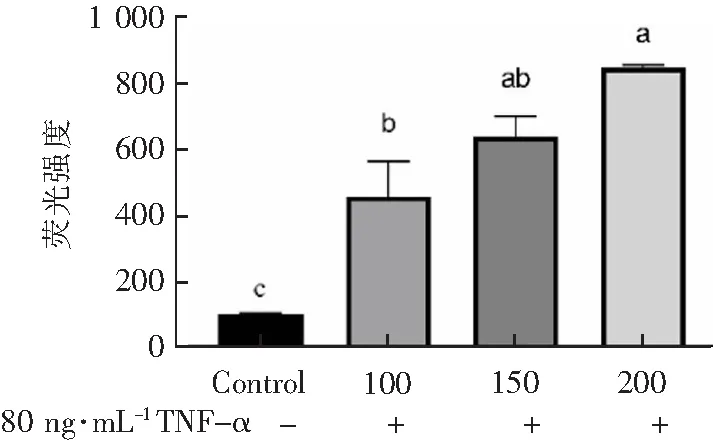
TNF-α浓度/(ng·mL-1)
2.5 200 μmol·L-1 H2O2联合不同剂量TNF-α对H9c2细胞炎症因子蛋白表达的影响
采用200 μmol·L-1的H2O2处理1 h联合不同剂量TNF-α处理12 h,与Control组相比,TNF-α相对蛋白表达量没有显著性差异(p>0.05),但是,IL-6和ICAM的相对蛋白表达量显著增加(p<0.05)。200 μmol·L-1的H2O2处理1 h联合80 ng·mL-1的TNF-α处理12 h,炎症因子ICAM相对蛋白表达量增至Control组的2.5倍,炎症因子IL-6相对蛋白表达量增至Control组的2.2倍,显著高于Control组,提示出现炎症损伤。
综合不同剂量H2O2联合80 ng·mL-1的TNF-α对H9c2细胞ROS水平以及不同剂量TNF-α联合200 μmol·L-1H2O2对H9c2细胞炎症因子蛋白表达的影响,结果表明200 μmol·L-1的H2O2和80 ng·mL-1TNF-α联合能同时诱导H9c2细胞内氧化应激(ROS水平达到最大)和炎症损伤(ICAM、IL-6和TNF-α炎症因子等蛋白表达水平显著高于Control组)。



图5 不同剂量TNF-α联合200 μmol·L-1 H2O2对H9c2细胞炎症因子蛋白表达的影响。A为不同剂量TNF-α联合200 μmol·L-1 H2O2对H9c2细胞ICAM蛋白表达的影响,B为不同剂量TNF-α联合200 μmol·L-1 H2O2对H9c2细胞TNF-α蛋白表达的影响,C为不同剂量TNF-α联合200 μmol·L-1 H2O2对H9c2细胞IL-6蛋白表达的影响.。不同字母(a,b,c,d)表示不同组别具有显著性差异(p<0.05)。
为了验证200 μmol·L-1H2O2处理1 h联合80 ng·mL-1TNF-α作用12 h诱导H9c2细胞氧化应激和炎症损伤模型的建立是否成功,分别探索了Control组、单一的氧化损伤组(只加200 μmol·L-1H2O2作用1 h组)、单一的炎症损伤组(只加80 ng·mL-1TNF-α作用12 h组)和联合组(200 μmol·L-1H2O2作用1 h联合80 ng·mL-1TNF-α作用12 h组)的氧化损伤指标(SOD和MDA水平)和炎症损伤指标(炎症因子蛋白水平表达和基因水平表达)方面的差异。若联合组的氧化损伤指标不亚于单一的氧化损伤组且炎症损伤指标不亚于单一的炎症损伤组,则提示模型建立成功。
2.6 TNF-α联合H2O2对H9c2细胞SOD和MDA水平的影响
如图6所示,与Control组相比,只加80 ng·mL-1TNF-α组的SOD和MDA水平没有显著性差异(p>0.05),说明80 ng·mL-1TNF-α虽然能引起细胞内ROS水平增加,但并不引起抗氧化相关酶的变化。但是,加了200 μmol·L-1H2O2(200 μmol·L-1H2O2组和200 μmol·L-1H2O2联合80 ng·mL-1TNF-α组)后,MDA水平显著上升且SOD抗氧化酶活性显著下降(p<0.05),SOD和MDA水平呈现出负相关。


图6 TNF-α联合H2O2对H9c2细胞SOD和MDA水平的影响。A表示TNF-α联合H2O2对H9c2细胞SOD水平的影响,B表示TNF-α联合H2O2对H9c2细胞MDA水平的影响。不同字母(a,b)表示不同组别具有显著性差异(p<0.05)。
2.7 TNF-α联合H2O2对H9c2细胞炎症因子蛋白表达的影响
为了验证模型的成功与否,本研究用Western Blot法和Q-PCR分别探索了不同组别(Control组、只加80 ng·mL-1TNF-α作用12 h组、只加200 μmol·L-1H2O2作用1 h组和200 μmol·L-1H2O2作用1 h联合80 ng·mL-1TNF-α作用12 h组)炎症因子蛋白表达和基因水平的影响。C通过Western Blot法探索炎症因子蛋白表达的变化,从图7可以看出:与Control组相比,只加200 μmol·L-1H2O2组的ICAM、VCAM和IL-6蛋白表达水平没有显著性差异(p>0.05),说明只加200 μmol·L-1H2O2组并不引起炎症因子蛋白表达的变化,200 μmol·L-1H2O2并不能诱导炎症损伤。但是,与Control组相比,只加80 ng·mL-1TNF-α组和200 μmol·L-1H2O2联合80 ng·mL-1TNF-α组的ICAM、VCAM和IL-6蛋白的表达显著上升(p<0.05),说明80 ng·mL-1TNF-α能提高炎症因子蛋白表达。

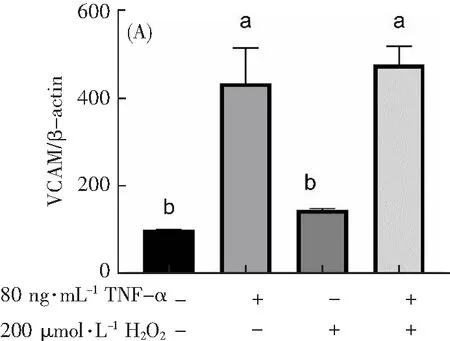
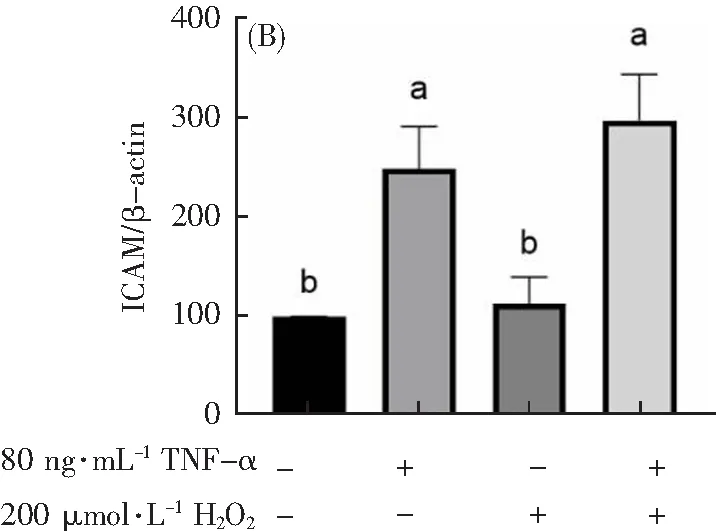
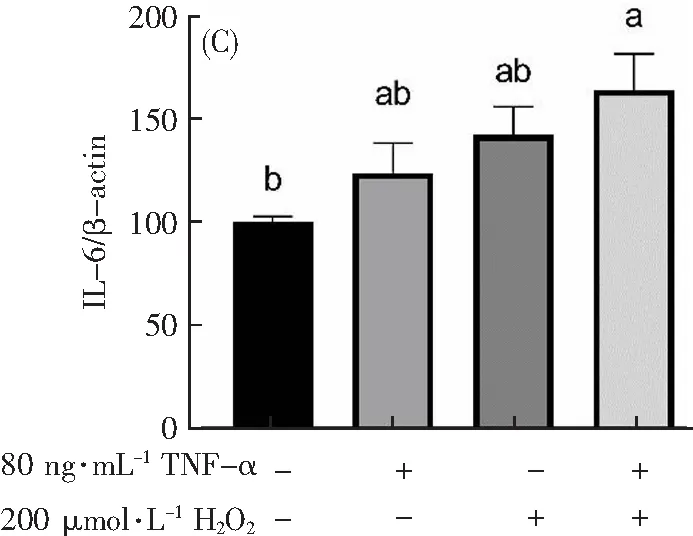
图7 TNF-α联合H2O2对H9c2细胞炎症因子蛋白的影响。A表示TNF-α联合H2O2对H9c2细胞VCAM蛋白表达的影响。B表示TNF-α联合H2O2对H9c2细胞ICAM蛋白表达的影响。C表示TNF-α联合H2O2对H9c2细胞IL-6蛋白表达的影响。不同字母(a,b)表示不同组别具有显著性差异(p<0.05)。
基因可以调节蛋白表达,因此本研究检测了促炎因子VCAM、IL-6和TNF-α的mRNA表达水平。从图8可以看出:与Control组相比,只加200 μmol·L-1H2O2组的VCAM、IL-6和TNF-α的mRNA表达量没有显著性差异(p>0.05),说明只加200 μmol·L-1H2O2组并不引起炎症因子VCAM、IL-6和TNF-α的mRNA的表达。但是,与Control组相比,只加80 ng·mL-1TNF-α组和200 μmol·L-1H2O2联合80 ng·mL-1TNF-α组的VCAM、IL-6和TNF-α的mRNA的表达显著上升(p<0.05),说明80 ng·mL-1TNF-α能提高炎症因子mRNA的表达。
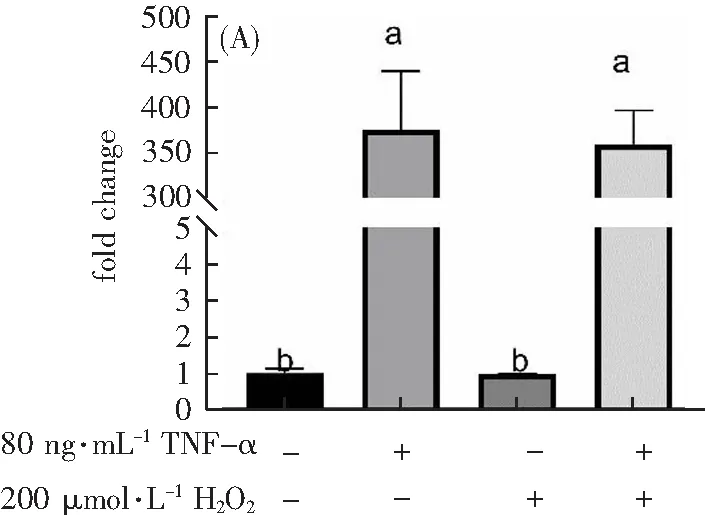
VCAM
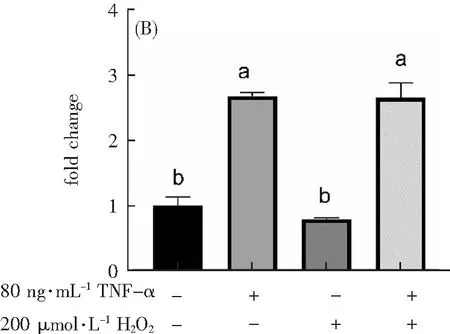
IL-6

TNF-α
3 讨论
心血管疾病进程中,活性氧自由基(reactive oxygen species,ROS)大量累积,使心肌细胞凋亡[10]。心血管疾病发病机制很复杂,很多心血管疾病与氧化应激和慢性炎症密不可分。如动脉粥样硬化和心肌梗死,氧化应激和系统性炎症是其最突出的特征[11,12]。氧化应激增加了炎症反应,持续的炎症产生了大量的活性氧。
本研究采用TNF-α联合H2O2诱导H9c2细胞,同时建立细胞氧化应激和慢性炎症模型。通过CCK-8实验、流式细胞术,发现200 μmol·L-1H2O2刺激H9c2细胞1 h细胞存活率为55%;细胞内活性氧水平增至266%,初步以200 μmol·L-1H2O2刺激H9c2细胞1 h用于构建H9c2细胞氧化损伤模型。通过CCK-8实验、流式细胞术和酶联免疫吸附实验,发现采用80 ng·mL-1TNF-α刺激H9c2细胞12 h,与Control组相比,细胞存活率没有显著性差异(p>0.05),细胞内的活性氧水平增至213%。上清液中IL-1β释放量没有显著性差异(p>0.05),上清液中IL-6释放量显著增加至Control组的1.6倍,初步以80 ng·mL-1TNF-α刺激H9c2细胞12 h用于构建H9c2细胞炎症损伤模型。接着,通过流式细胞术探索不同剂量H2O2联合80 ng·mL-1的TNF-α对H9c2细胞ROS水平的影响,发现200 μmol·L-1H2O2联合80 ng·mL-1TNF-α使H9c2细胞ROS水平增至Control组的8.5倍。本研究通过Western Blot法探索200 μmol·L-1H2O2联合不同剂量TNF-α对H9c2细胞炎症因子的影响,发现与Control组相比,TNF-α相对蛋白表达量没有显著性差异(p>0.05),但炎症因子ICAM相对蛋白表达量增至Control组的2.5倍,炎症因子IL-6相对蛋白表达量增至Control组的2.2倍。所以,80 ng·mL-1TNF-α联合200 μmol·L-1H2O2显著增强H9c2细胞内ROS水平,显著增强上清液中炎症因子IL-6释放量,显著增加ICAM和IL-6炎症因子蛋白的表达(p<0.05)。说明80 ng·mL-1TNF-α联合200 μmol·L-1H2O2既诱导了细胞氧化应激,又诱导了细胞炎症损伤。
为验证此模型的成功与否,本研究探索了不同组别(Control组、只加80 ng·mL-1TNF-α组、只加200 μmol·L-1H2O2组和200 μmol·L-1H2O2联合80 ng·mL-1TNF-α组)对SOD、MDA氧化应激指标的差异,以及对相关炎症因子在蛋白表达和基因调控上的差异。超氧化物歧化酶( SOD)是一种调控氧化应激的酶,催化超氧阴离子和H2O2之间的反应,平衡氧化和抗氧化,保护心肌细胞免受氧化应激[13]。丙二醛 (MDA) 是一种脂质过氧化物,它在体内的大量累积会对人体细胞、组织都有一定的损害。SOD水平反映细胞的抗氧化能力,MDA可以间接反映细胞内氧化应激造成的损伤程度[14]。SOD水平降低和MDA 的增加都心肌细胞氧化损伤加重。与Control组相比,加了200 μmol·L-1H2O2组MDA水平显著上升且SOD水平显著下降(p<0.05),只加80 ng·mL-1TNF-α组SOD 和 MDA水平没有显著性差异(p>0.05)。随后,本研究分别探索了蛋白和基因方面相关炎症因子的表达。结果表明,加了80 ng·mL-1TNF-α组,在蛋白和基因水平上,一些炎症因子的表达均显著提高,尤其是一些黏附因子,如VCAM在mRNA表达上是Control组的350倍左右,并且在蛋白表达上是Control组的4倍左右,ICAM在蛋白表达上是Control组的3倍左右。而这些抗炎因子都是NF-κB信号通路的下游蛋白,结果提示200 μmol·L-1H2O2处理1 h联合80 ng·mL-1TNF-α处理12 h共同诱导大鼠心肌细胞激活NF-κB信号通路下游蛋白和mRNA的表达,而NF-κB信号通路的异常激活与心肌细胞损伤有密切联系[15,16]。核转录因子-κB( Nuclear factor κB,NF-κB) 作为一类具有多向转录调节功能的重要核因子,在肿瘤发生发展、免疫应答和炎症调节中发挥着重要的作用[17,18]。
综上所述,200 μmol·L-1H2O2处理1 h联合80 ng·mL-1TNF-α处理12 h共同诱导大鼠心肌细胞,细胞内ROS显著增高,氧化应激指标MDA水平增高,抗氧化酶SOD降低,并激活NF-κB信号通路下游炎症因子蛋白和mRNA的表达。其作用机理可能与NF-κB信号通路的靶向调节有关,结果可为进一步研究其氧化应激和慢性炎症反应提供理论基础。

