黄颡鱼源维氏气单胞菌的分离、鉴定及特性分析
王润萍 许航荣 潘 杰 钟智威 万 根 阮记明
(江西农业大学动物科学技术学院,江西 南昌 330045)
黄颡鱼(Pelteobagrus fulvidraco)又名黄辣丁、黄姑鱼、黄鳍鱼等,属鲇形目(Siluriformes)黄颡鱼属(Pelteobagrus),是我国具重要经济价值的淡水名特优水产养殖品种[1]。黄颡鱼肉质鲜美、无鱼鳞和肌间刺,营养价值高,高蛋白、低脂肪且富含钙、磷、钾等微量元素,具有降血压、提高免疫力和预防贫血等重要的药用价值[2]。随着近年来黄颡鱼养殖技术逐渐成熟、养殖品种不断优化,黄颡鱼集约化养殖快速发展。但由于养殖密度高、环境负荷重,直接导致细菌引起的传染性疾病迅速增加,且频繁暴发。目前已有报道的黄颡鱼主要细菌性疾病包括红头病[3]、出血病[4]、腹水病[5]等。腹水病,也叫“大肚子”病,是黄颡鱼养殖过程中一种急性传染病,发病速度快、发病范围广、发病率和死亡率高[6-7]。然而,目前报道中引起腹水病的病原菌并不唯一,包括爱德华氏菌[8]、嗜水气单胞菌[9]等,给预防和治疗都带来了困难,造成巨大经济损失,并且严重制约了黄颡鱼养殖业的发展。另外,同种的病原菌在耐药性上存在时间和地域上差异,进一步加深了治疗的难度。因此,对于黄颡鱼腹水病病理特征、病原菌种类及菌株特性进行深入研究具有重要意义。
2021年3—5月,江西南昌县多个黄颡鱼养殖场爆发大规模腹水病,死亡率高,治愈困难。为查清病原,本研究对患病样本进行采集和解剖分析,对病原菌进行分离、鉴定;同时对菌株药敏特性、携带毒力基因的情况等进行初步分析,旨在为更深入地研究腹水病致病机理提供理论依据,同时为该类细菌性疾病的防治提供科学的参考依据。
1 材料与方法
1.1 试验材料与试剂
1.1.1 试验动物 试验用病鱼、健康鱼均从南昌市南昌县某养殖场采集,鱼体平均体长15~18 cm,体重17~20 g。
1.1.2 主要试剂 蛋白胨、酵母粉、0.9%生理盐水、细菌基因组DNA 提取试剂盒[宝生物工程(大连)有限生物公司]、2×Taq PCR Mix(北京索莱宝科技有限公司)、Goldview 染料(北京索莱宝科技有限公司)、药敏片(杭州微生物试剂有限公司)、波恩氏固定液等。肉膏蛋白胨(Luria-Bertani, LB)培养基:胰蛋白胨10 g·L-1、酵母粉5 g·L-1、NaCl 10 g、琼脂20 g·L-1(固体平板),pH值7.2。16S rDNA 通用引物:27F:5′-AGAGTTTGATC ATGGCTCAG-3′;1492R:5′-TACGGTTACCTTGTTAC GACTT-3′。
1.2 试验方法
1.2.1 症状及组织病理观察 将病鱼和健康鱼的体表冲洗干净,无菌条件下分别剖取病鱼、健康鱼的鳃丝、肝、脾、肾、肠等组织块(1 cm×1 cm×1 cm),在波恩氏液中固定24 h,送至武汉赛维尔生物科技有限公司进行苏木精-伊红法染色(Hematoxylin Eosin staining,HE)、切片、拍照和分析。
1.2.2 病原菌的分离和纯化 将病鱼于无菌操作台中进行解剖,取肝脏、肾脏及肠道组织进行匀浆,0.9%生理盐水进行梯度稀释,取上清液于LB 平板涂布,28 ℃条件下培养过夜,挑选培养基上大小、形态及颜色不同的菌落,进行2~3 次分离纯化,获得纯菌株,-80 ℃条件下保藏备用。
1.2.3 16S rDNA 测序分析及进化树构建 将纯化好的菌接种于LB 液体培养基,28 ℃、150 r·min-1条件下振荡培养过夜。离心收集细菌并提取总DNA,以菌体总DNA 为模板,采用通用引物进行16S rDNA 的PCR扩增。PCR 反应体系为50 μL:DNA 模板1 μL,10 μmol·L-1引物各1 μL,2× Taq PCR Mix 25 μL,双蒸水补至50 μL。PCR 条件:95 ℃预变性3 min,95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,共32 个循环,72 ℃延伸5 min。PCR反应产物经1.2%琼脂糖凝胶电泳检测扩增产物,将合格产物送至生工生物工程(上海)股份有限公司进行测序。将测序列结果在NCBI 进行Blast比对,根据同源性序列比对结果确定菌株分类;其次,选取模式菌株16S rDNA 序列,采用MEGA7.0 中邻接法(Neighbor-Joining,NJ)进行系统进化树的构建,置信度检验(Bootstrap)为1 000。
1.2.4 人工回复感染 挑取分离菌株单菌落于脑心浸液培养基(brain heart infusion medium,BHI)中,28 ℃培养约20 h,取1 mL 菌液,6 000×g离心3 min,用1×磷酸盐缓冲液(phosphate buffered saline, PBS)洗2次后,用1 mL PBS 重悬。菌液初始浓度为1×108CFU·mL-1,进行10倍梯度稀释至1×107、1×106、1×105、1×104CFU·mL-1,进行攻毒,一组注射PBS 作为对照组;每组10 尾鱼,每尾鱼注射100 μL,水温(20±1) ℃,连续观察7 d。统计患病情况和死亡率,同时对感染患病鱼进行病原菌分离鉴定。
1.2.5 菌株的药敏试验 采用药敏纸片扩散法(Kirby-Bauer,K-B)[10],将分离获得的菌液涂布在LB平板上,依次将各药敏纸片紧贴于培养基,并做好标记。倒置放于37 ℃培养24 h,分别测量各个抗菌药物的抑菌圈直径,计算平均值。
1.2.6 菌株毒力基因分布 参照Wang 等[11]的方法,提取细菌基因组DNA 作为模板,分别对菌株气溶素(aerA)、细胞毒性肠毒素(act)、鞭毛(fla)、热稳定细胞肠毒素(ast)、甘油磷脂胆固醇酰基转移酶(gcaT)、丝氨酸蛋白酶(ser)、Ⅲ型分泌系统基因(ascV)、脂肪酶(lip)及核酸酶(exu)共9 种毒力基因进行扩增。引物序列及扩增片段大小见表1[12],引物由生工生物工程(上海)股份有限公司合成。

表1 本研究所用引物序列Table 1 The sequences of primers used in this study
2 结果与分析
2.1 病症及组织病理学观察
临床观察发现,鱼体表无明显的伤痕,镜检体表、鳃及其他组织未发现寄生虫感染。腹部膨胀明显(图1-a);肛门发炎,红肿突出(图1-a、b)。解剖后观察未发现寄生虫,腹腔内充满黄色透明、果冻状粘液;胆囊肿大发黑;肠道空肠,肠壁变薄、甚至透明;肝脏发黄;部分病鱼的肠道、胃等内脏有大量出血点(图1-c)。

图1 黄颡鱼腹水病临床症状Fig.1 Clinical symptoms of naturally infected ascites P.fulvidraco
显微观察可见,患病黄颡鱼的鳃小片上皮细胞严重受损,大量坏死、脱落;柱细胞排列扭曲,部分脱落、弥散;鳃小片扭曲、断裂;鳃丝间充满弥散、坏死的细胞(图2-a)。健康黄颡鱼的鳃丝和鳃小片有规律地沿一个方向紧密排列,鳃组织结构完整,鳃丝间隙清晰,鳃小片上皮细胞排列紧密、规律、完整(图2-b)。
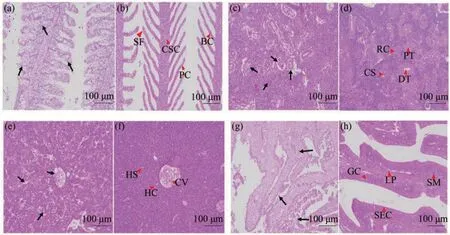
图2 黄颡鱼组织切片观察(×200)Fig.2 Histological section observation of P.fulvidraco (×200)
肾组织中,患病黄颡鱼肾小球萎缩,肾小管扩张、内刷状缘结构消失、上皮细胞坏死、脱落;肾间质有炎性细胞浸润(图2-c)。健康黄颡鱼肾组织结构完整,清晰;肾小球饱满,边界清晰;肾小管内刷状缘结构完整(图2-d)。
肝组织中,患病黄颡鱼肝组织部分区域出现空泡,肝细胞排列紊乱、大量坏死;中央静脉周围细胞出现弥散,内皮脱落;肝板结构断裂;肝血窦扩张(图2-e)。健康黄颡鱼细胞肝板由中央静脉向四周呈辐射状散开且结构纹路规则,血管内红细胞充盈(图2-f)。
肠道组织中,患病黄颡鱼肠绒毛上皮细胞脱落、弥散;杯状细胞消失,固有层、粘膜下层细胞坏死、脱落;肠绒毛脱落、弥散(图2-g)。健康黄颡鱼肠道结构完整、清晰,杯状细胞清晰、规律排列(图2-h)。
2.2 病原菌的分离鉴定及回感
由LB 平板分离纯化获得形态、大小相同的菌株1 株,菌命名为PL1。菌株PL1 在LB 平板,28 ℃培养24 h,菌落呈乳黄色、圆形,表明光滑、湿润,边缘整齐(图3)。

图3 菌株PL1在LB培养基上菌落形态Fig.3 Colony morphologies of the strain PL1 on LB plate
对菌株PL1 的16s rDNA 进行扩增获得长1 342 bp片段,经过测序及NCBI中BLAST比对表明菌株PL1与维氏气单胞菌Aeromonas veronii同源性最高,相似度为99.85%。同时利用软件MEGA7.0(NJ 法)构建系统进化树,结果表明菌株PL1 与维氏气单胞菌聚为一支(图4)。最终确定菌株PL1为维氏气单胞菌A.veronii。
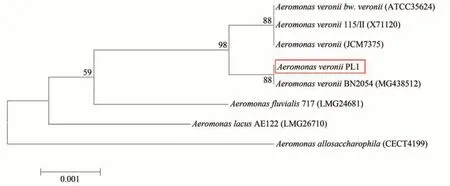
图4 菌株PL1 16S rDNA序列进化树Fig.4 Phylogenetic tree based on 16S rDNA sequence of the strain PL1
通过人工回归感染试验发现,对照组生长良好,无发病症状(图5-a),注射菌株PL1试验组黄颡鱼出现明显病症:泄殖孔发炎突出,腹部膨大(图5-b),解剖有大量腹水(图5-c)。注射菌体浓度为1×106、1×107CFU·L-1组的黄颡鱼,均在感染72 h 后全部死亡,并且从发病鱼的肝、肾中再次分离获得菌株PL1。表明菌株PL1 为本次黄颡鱼腹水病主要病原菌。

图5 人工感染黄颡鱼症状Fig.5 Symptoms of artificially infected P.fulvidraco
2.3 药敏试验
菌株A.veroniiPL1 对30 种药物的药敏试验结果显示(表2),其对多粘菌素、复方新诺明、呋喃唑酮、氯霉素、头孢曲松、头孢哌酮、丁胺卡那、庆大霉素、卡那霉素、新霉素、头孢呋辛、头孢他啶等12 种抗生素敏感,其中对复方新诺明、氯霉素、头孢曲松及头孢哌酮4 种抗生素最为敏感(图6)。对氧氟沙星、红霉素和哌拉西林3 种抗生素中度敏感;对麦迪霉素、诺氟沙星、环丙沙星、万古霉素、青霉素、克林霉素、四环素、多西环素、米诺环素、苯唑西林、氨苄西林、羧苄西林、头孢氨苄、头孢唑林及头孢拉定等15 种抗生素具有耐受性。

图6 K-B平板法药敏试验结果Fig.6 Drug sensitive test results of K-B plate method

表2 维氏气单胞菌PL1药敏试验结果Table 2 Drug sensitive test results of the strain A.veronii PL1
2.4 毒力基因检测
由图7 可知,在检测的9 种毒力基因中,共检测到6 种毒力因子基因:aerA、act、gcaT、Ser、fla、ascV;未检测到ast、lip、exu3种毒力基因。

图7 菌株A.veronii PL1毒力基因PCR扩增结果Fig.7 PCR amplification results of the strain A.veronii PL1
3 讨论
腹水病已成为水产养殖中一种常见的危害性极大的传染性疾病,目前已有大量水生生物患腹水病的报道,如异育银鲫(Carassais auratus gibebio)[13]、大鲵(Andrias davidianus)[14]、牙鲆(Paralichthys olivaceus)[15]、日本鳗鲡(Anguilla japonicus)[16]、半滑舌鳎(Cynoglossus semilaevis)[17]等。根据目前发现病例及文献报道,腹水病主要特征为鱼体腹部膨大,肠道内无食物,腹腔内有积液。而根据有无出血及肛门红肿、溃烂等可以将腹水病分为溶血性腹水病和非溶血性腹水病,其中溶血性腹水病主要由细菌感染引起,非溶血性腹水病由营养代谢异常引发[18]。本研究中,病鱼主要症状表现为腹部膨大,鱼体消瘦,肛门红肿突出,肠道无食物,腹腔大量腹水,腹水离体后呈现凝胶状。可见,本研究中黄颡鱼(P.fulvidraco)腹水病为细菌溶血性腹水病。显微观察发现,患病黄颡鱼各组织均有不同程度损伤:肝脏、肾脏及肠道组织中均存在细胞空泡、细胞坏死、脱落,红细胞浸润等共同特点,进一步证实了鱼体腹水的形成可能与肝、肾以及肠组织的病变密切相关[19]。
本研究从腹水病黄颡鱼肝脏、肾脏中分离获得病原菌,腹水中未发现细菌存在,经鉴定表明病原菌为维氏气单胞菌A.veronii。维氏气单胞菌是一种重要的人、畜及水生生物共患性病原菌,能够引起中华鳖(Trionyx sinensis)软壳病[20]、异育银鲫(C.gibebio)死亡[21]、草鱼(Ctenopharyngodon idellus)脓毒症[22]、尼罗罗非鱼(Oreochromis niloticus)死亡[23]等危害,还可引起人类胃肠炎、软组织感染、败血症和外伤感染等病症,对水产养殖业造成巨大经济损失的同时严重威胁着人类的安全与健康[24-25]。本研究中,菌株A.veroniiPL1对复方新诺明、氯霉素、头孢曲松和头孢哌酮这4种抗生素敏感性最强,但其中氯霉素是水产养殖的禁用药,因此,其余3 种抗生素可在实际生产中用于该病的治疗。另外,该菌株对麦迪霉素、诺氟沙星、环丙沙星等15 种抗菌药物具有耐药性,呈现多重耐药现象,与以往研究相比耐药性呈现出增强趋势[26-27]。推测可能与养殖过程中长期使用抗生素致使耐药性增强相关,因此,在生产实践过程中,必须科学合理有效的使用渔药。同时,有必要对维氏气单胞菌的致病机理进行更深入研究,为开发预防疫苗、快速诊断试剂盒以及一些新型抗菌药物等提供依据。
有关研究表明,A.veronii致病性与毒力基因的存在关系密切[28]。宋明芳等[29]研究表明气单胞菌具有多中毒力基因,能够表达分泌气溶素、肠毒素、胞外蛋白等多种毒力因子。其中,气溶素基因(aerA)是维氏气单胞菌最重要、最丰富的毒力基因之一,其编码的蛋白具有很强的细胞毒性、溶血性和肠毒性,可破坏宿主细胞膜通透性,裂解细胞[30]。前人研究表明,嗜水气单胞菌中的气溶素能够干扰人类肠上皮紧密连接的完整性和细胞损伤修复过程[31]。其次,细菌肠毒素可以引起人、畜、畜禽肠道上皮细胞代谢紊乱,黏膜结构破坏,导致功能失调,引起腹泻等病症。肠毒素包括细胞毒性肠毒素(cytotoxic enterotoxin,Act)、热不稳定性肠毒素(heat-labile cytotonic enterotoxin,Alt)和热稳定性肠毒素(heat-stable cytotonic enterotoxin,Ast)。其中,肠毒素基因能够提高巨噬细胞细胞系中肿瘤坏死因子(tumor necrosis factor,TNF)和白细胞介素 1(interleukin 1,IL-1)以及组织溶解产生的其他炎症细胞因子的水平[32]。gcaT和ascV基因编码的分泌蛋白,在气单胞菌感染的致病性中起重要作用[33]。大多数气单胞菌都能在极性鞭毛作用下运动。细菌运动能力是气单胞菌重要的毒力因子,因此鞭毛基因fla也是病原菌重要的毒力基因之一[33]。本研究中,菌株A.veroniiPL 携带aerA、act、gcaT、ser、fla及ascV多种毒力基因,表明菌株PL1可通过表达毒力因子,导致鱼肠道炎症、充血、消化吸收受阻,引起黄颡鱼腹水病症。综合上述基因分析结果表明,菌株PL 具有较强毒力,人工回归感染也表明该菌株具有较强的致病性,能够引发黄颡鱼腹水病,造成死亡。而关于其致病途径和机理有待进一步研究。
4 结论
本试验从患有典型腹水病黄颡鱼体内分离出1 株优势菌PL1,对其进行了分离鉴定、回归感染以及耐药性、毒力基因分析。通过16S rDNA 序列比对及系统发育树构建结果表明菌株PL1为维氏气单胞菌。回归感染试验结果发现注射菌株PL1的黄颡鱼表现出与自然发病相同的典型腹水病临床症状:腹部膨大、腹腔内积水,表明该菌株为此次黄颡鱼腹水病主要病原菌。毒力基因分析表明,菌株PL1 携带有aerA、act、gcaT、ser、fla、ascV等6 种毒力基因,具有较强毒力。耐药性试验结果表明菌株PL1对复方新诺明、氯霉素和头孢曲松、头孢哌酮敏感性最好,但同时对多达15 种抗生素产生耐药性,呈现出多重耐药性。

