应用二次PCR检测草莓炭疽病菌
唐冬兰 蒋立奔 唐泉 宋芹芹 曹荣祥


摘要:开发了一种基于PCR的草莓炭疽病致病菌暹罗炭疽菌(Colletotrichum sisamense)检测方法。通过分析暹罗炭疽菌及24种真菌的ITS区序列,设计了1条反向特异引物CsiaR,结合引物CgInt可仅从暹罗炭疽菌中扩出约 400 bp 片段。对不同浓度暹罗炭疽菌DNA溶液进行检测,第1轮和第2轮PCR的最低检出限分别为50 pg/μL和 5 fg/μL;对接种不同浓度暹罗炭疽菌分生孢子悬浮液的草莓样本(接种48 h,症状未出现)进行检测,低于1.0×104个孢子/mL的处理无法检出;对田间随机采集的草莓样本检测时,PCR检测阳性的样本(含有症状和无症状)中均可分离到暹罗炭疽菌。总体来说,本方法可用于草莓中暹罗炭疽菌的早期、快速及准确检测,从而为草莓炭疽病的及时有效防控提供依据。
关键词:草莓;炭疽病;暹罗炭疽菌;ITS序列;PCR检测
中图分类号:S436.68+4 文献标志码:A 文章编号:1002-1302(2023)09-0125-06
基金项目:江苏省农业科技自主创新资金[编号:CX(20)3017];亚夫科技服务项目[编号:KF(20)1021];江苏现代农业产业技术体系建设项目(编号:JATS[2021]008)。
作者简介:唐冬兰(1983—),女,江苏淮安人,博士,副研究员,主要从事果树病理学及种质资源研究。TE-mail:dofthmlhm@163.com。
通信作者:曹荣祥,男,江苏扬州人,副研究员,主要从事草莓栽培与生理研究。E-mail:3060601887@qq.com。
草莓作为一种果形美观、风味独特、营养价值丰富的水果,不仅深受消费者青睐,还为莓农带来巨大的经济效益,种植面积逐年提升,但由于品种单一、国内大部分采用设施栽培导致草莓病害防不胜防,给草莓产业带来的损失也是不容忽视的。其中,炭疽病首当其冲,凡有草莓种植的地方,如湖北、浙江、陕西、江苏等,几乎均有该病报道[2-6]。草莓生长的各阶段,地上部各部位包括叶片、匍匐茎、果实、叶柄及茎基部等均可被该病病原菌侵染,其中,以侵染茎基部危害最大,严重时可导致整个植株死亡,防治难度与土传病害无异。
国内目前已知可引起草莓炭疽病的致病菌主要有3种:尖孢炭疽菌(Colletotrichum acutatum)、胶孢炭疽菌[C. gloeosporioides]、草莓炭疽菌(C. fragariae)。其中,胶孢炭疽菌复合种中的暹罗炭疽菌(C. siamense)被鉴定为多地优势种[7-9]。
草莓炭疽病菌的防治目前主要采用化學防治的方法,生产中莓农通常在出现肉眼可见的症状后针对性地用药,或是在症状出现前,随意大量用药,不仅成本高,而且长期大量用药会造成病原菌产生抗药性导致防治难度逐渐加大,同时也对环境造成巨大污染[10]。事实上,在出现症状后再进行防治,病害往往已侵入植株内部,即使用药也很难控制。因此,通过检测技术尽早、准确地掌握植株带菌情况对炭疽病的控制及草莓的安全生产至关重要。
传统的病害检测,通常采用分离培养和形态观察的方式,这种方法步骤多,鉴定环节需要操作者有很丰富的真菌形态分类鉴定经验,一系列的操作至少需要5~7 d,往往已错过最佳防治时期[11]。
近年,分子检测技术逐渐普及,基本原理通常是利用种内保守、种间多态的区域设计特异引物对病原菌的基因组进行特异扩增,其中,ITS区(核糖体内转录间隔区)又因其在基因组中通常表现为多拷贝状态,可以提高扩增效率而更常被使用。国内外已有研究人员开发出了多种病原菌的特异引物,如向日葵黑茎病菌(Phoma macdonaldii)[12]、柑橘黄龙病菌(Candidatus Liberibacter asiaticus)[13]、橄榄黄萎病菌(Verticillium dahliae)[14]等,在草莓上也有尖孢炭疽菌(C. acutatum)、草莓炭疽病菌(C. fragariae)[15]、尖孢镰刀菌(Fusarium oxysproum f. sp. fragariae)[16]、腐皮镰刀菌(F. solani)[17]等病原菌的快速检测技术研究,但对草莓炭疽病常见致病菌暹罗炭疽菌尚无相关报道。本研究将通过多重序列比对,分析暹罗炭疽菌与其他多种草莓植株中及植株周围常见真菌的ITS序列,找出暹罗炭疽菌与其他真菌保守型较低的区域,设计可用于暹罗炭疽菌特异检测的引物,实现草莓组织中暹罗炭疽菌的早期、快速及准确检测,从而为草莓炭疽病的及时有效防控提供依据。
1 材料与方法
1.1 试验时间与地点
本试验于2020年6月至2021年6月在江苏省南京市完成。
1.2 供试菌株
本研究共采用3个暹罗炭疽菌菌株,和24个其他真菌菌株(表1),所有菌株均分离自南京不同草莓园的炭疽病病株及健株的植物组织或生长介质(土壤或基质)。植株组织中的真菌采用组织分离法获得,土壤或基质中的真菌采用稀释平板法获得[18]。所有菌株经单孢纯化后,保存于25%甘油中,存于江苏丘陵地区南京农业科学研究所-80 ℃冰箱备用。所有暹罗炭疽菌菌株均采用活体(注射法和喷雾法)与离体的接种方法进行过致病性鉴定[19],确定可引起草莓炭疽病典型症状。
1.3 菌丝收集和DNA提取
将供试菌株接种到PDA培养基上,放入培养箱28 ℃培养数日,待菌丝长满,收集300 mg新鲜菌丝,装于2 mL离心管中,管中加入3~5颗钢珠,然后放入Tissuelyser-L系列多样品组织研磨仪中(上海静信实业发展有限公司),50 Hz研磨30 s用于DNA提取。总DNA的提取采用商业试剂盒,方法参考说明书。DNA的浓度及质量,采用NanoDrop ND-1000超微量分光光度计(美国,Thermo Fisher科技公司)查验。DNA保存于-20 ℃冰箱中备用。
1.4 ITS片段扩增、测序和引物设计
所有菌株的ITS片段用正向引物ITS5/ITS4进行扩增。由表2可知,扩增体系50 μL,各成分终浓度分别为:1×Es Taq Master Mix(含染料;北京,康为世纪生物科技股份有限公司),50~100 ng DNA,引物各0.25 μmol/L 不足部分用ddH2O补足。用无菌水代替DNA模板作为阴性对照。反应条件如下:96 ℃ 5 min;96 ℃ 30 s,60 ℃ 45 s,72 ℃ 1 min,循環35次;72 ℃ 8 min。反应结束后,取5 μL PCR产物进行电泳检测,使用0.8%质量浓度的琼脂糖凝胶,电泳缓冲液为1×TAE,染料使用Sparkred思科捷生物技术有限公司),并用Tannon-1600全自动数码凝胶图像分析系统(上海天能科技有限公司)拍照。对有扩增片段的PCR产物使用扩增引物进行双向直接测序,测序工作委托擎科生物科技有限公司进行。
将试验中测得的暹罗炭疽菌与其他真菌的ITS序列,采用DNASTAR软件包(DNASTAR,Inc.)中的EditSeq和SeqMan进行多序列比对,分析暹罗炭疽菌与其他菌株ITS序列间同源性较低的区域,采用Primer Premier 5.0软件(Premier Biosoft International)设计了一系列反向引物。
1.5 引物特异性的验证
从草莓植株与生长介质中分离到其他真菌被用于验证针对暹罗炭疽菌的引物的特异性。正向引物为CgInt,反向引物为自行设计。为减少药品用量,PCR反应总体积改为10 μL,各成分终浓度及反应条件同前述,DNA用量由2.5 μL改为0.5 μL。以无菌水代替DNA作为阴性对照。PCR扩增结果通过电泳的方式呈现。
1.6 检测限判定
用无菌水以10倍梯度将暹罗炭疽菌基因组DNA稀释成一系列浓度梯度的溶液,共7个浓度,从10 ng/μL到10 fg/μL,然后进行2轮PCR反应,阴性对照中采用无菌水代替DNA。PCR反应体系及扩增程序与前述引物特异性验证相同。进行第二轮PCR反应时,取0.5 μL前一轮扩增产物代替DNA,用相同体系和程序进行第二轮PCR扩增。
1.7 人工接种样本中暹罗炭疽菌检测
采用从南京仙林分离到的1株暹罗炭疽菌菌株(T3-2)对健康草莓苗进行人工接种。接种前将菌株接种在PDL液体培养基中,振荡培养5~7 d,待产生足够多的分生孢子后,用3~4层纱布将菌丝过滤掉,留下孢子液,12 000 r/m离心2 min,弃上清,采用无菌水重悬浮,再离心,如此反复2~3次,统计最终得到的菌悬液的分生孢子浓度,然后配成5个浓度:5×105、1×105、1×104、1×103、1×102个孢子/mL。每个处理接种6株,重复3次。采用喷雾法接种,每株接种20 mL菌悬液,对照采用等量的无菌水,采用喷雾器接种,保证草莓地上各个部位均喷洒菌液或无菌水,随后将植株放入加水20 mL的自封袋中置于28 ℃、光照—黑暗为 12 h—12 h的人工气候箱中(RXZ-280B,宁波江南仪器厂,中国),密封24 h后打开自封袋[22],并于接种 48 h 后取叶片提取总DNA(多糖多酚植物DNA提取试剂盒,上海浦迪生物科技有限公司),使用CgInt/CsiaR特异引物进行2轮PCR反应检测暹罗炭疽菌。PCR反应同上,总体积10 μL,2轮PCR模板用量稍有不同。第一轮取4.5 μL DNA溶液,反应前只需要检测DNA的D260 nm/D280 nm比值即可,确保DNA质量满足试验需求即可,无需稀释;二次PCR时,仅取0.5 μL前一轮产物为模板。扩增程序同前述。能扩增至约400 bp单一片段的样品视为阳性样本。
1.8 田间样本中暹罗炭疽菌检测
随机选择田间自然发病(具可见炭疽病病斑)与无症状的草莓植株各15株,采集叶片,尽快带回实验室,将每份样品分成2部分,一部分用于提取DNA进行PCR检测,一部分用于分离培养鉴定。用于PCR检测的样品提取总DNA后用引物CgInt/CsiaR对各样品进行2轮PCR扩增。反应体系和扩增程序同前述人工接种样本检测。能扩增至约 400 bp 单一目的片段的视为阳性样本。用于分离培养的样品,经70%乙醇处理数秒,3% NaClO浸泡3 min,无菌水漂洗3~4次后切成3~5 mm的小块,置于含有0.25 g/L氨苄青霉素和0.10 g/L链霉素的PDA平板上,5~7 d后根据菌落特征和分生孢子及菌丝形态进行鉴定。
1.9 阳性样品PCR扩增产物的测序及分析
为确定在田间和人工接种的样本中检测到约400 bp的片段确实来自暹罗炭疽菌,对阳性样品的扩增产物进行测序,采用对PCR产物双向直接测序的方式,测序引物为CgInt/CsiaR,得到的序列拼接后,在NCBI中进行BLAST分析,以验证PCR的特异性。
2 结果与分析
2.1 ITS序列扩增与引物设计
利用引物ITS5/ITS4,获得了草莓中的暹罗炭疽菌及24种草莓植株及根际介质中常见真菌的ITS序列,对这些序列进行多重比对后,发现暹罗炭疽菌ITS序列的355~494 bp碱基范围内的同源性与其他常见真菌较低,利用该区域设计了针对草莓中暹罗炭疽菌的反向特异引物。
2.2 引物的特异性
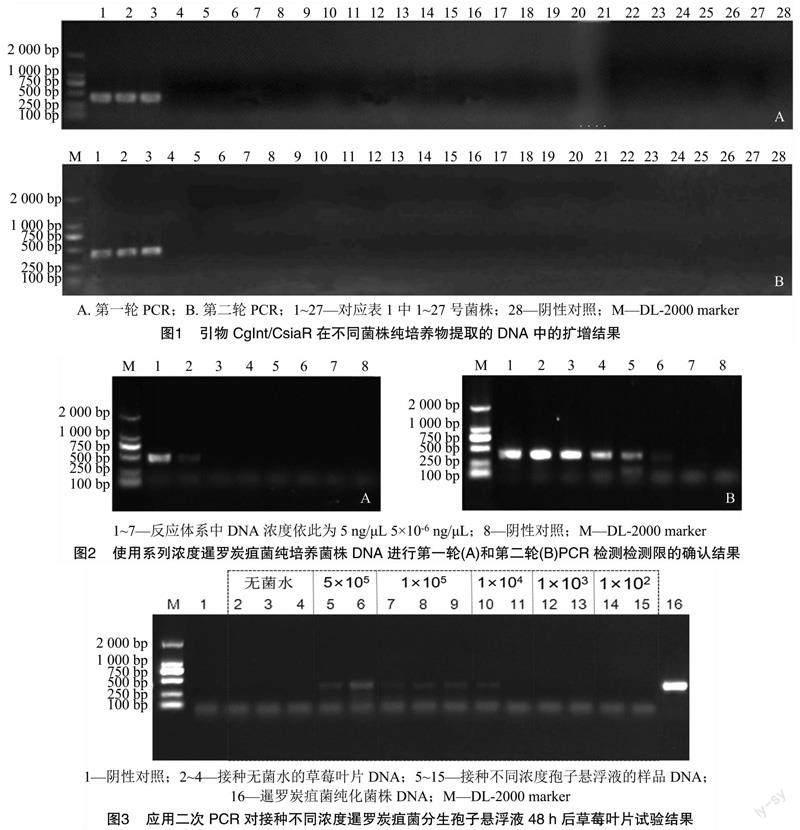
本研究利用3个暹罗炭疽菌菌株及草莓植株与生长介质中分离到的其他24种真菌DNA进行了引物特异性验证。在设计的一些反向引物中,通过条带亮度、引物二聚体形成情况及在非目的菌株中是否有条带等最终选出引物CsiaR,该引物与前人发表的正向引物CgInt相结合的扩增结果最理想。利用该引物组合,仅有当DNA模板为暹罗炭疽菌时,才能扩增出约400 bp的片段。由图1可知,提示该引物组合针对暹罗炭疽菌具有较高的特异性 与其他真菌基因组无稳定的结合位点,无法实现扩增。
2.3 检测限验证
2轮PCR对暹罗炭疽菌纯培养物提取的DNA最低检测限结果见图2。由图2可知,第一轮PCR扩增,最低检测限为反应体系中DNA浓度为 50 pg/μL(图2-A)。进行二次PCR后,检测下限降低至反应体系中DNA浓度仅有5 fg/μL也可观察到条带(图2-B)。
2.4 人工接种样品检测
利用引物组合CgInt/CsiaR对人工接种不同浓度暹罗炭疽菌分生孢子悬浮液48 h后的草莓叶片进行检测,通过二次PCR,得到最低检出限是1×104个孢子/mL,这一浓度下部分样品可检出暹罗炭疽菌,高于该浓度可100%检出;低于该浓度,则无法检出(图3)。
2.5 田间样品检测
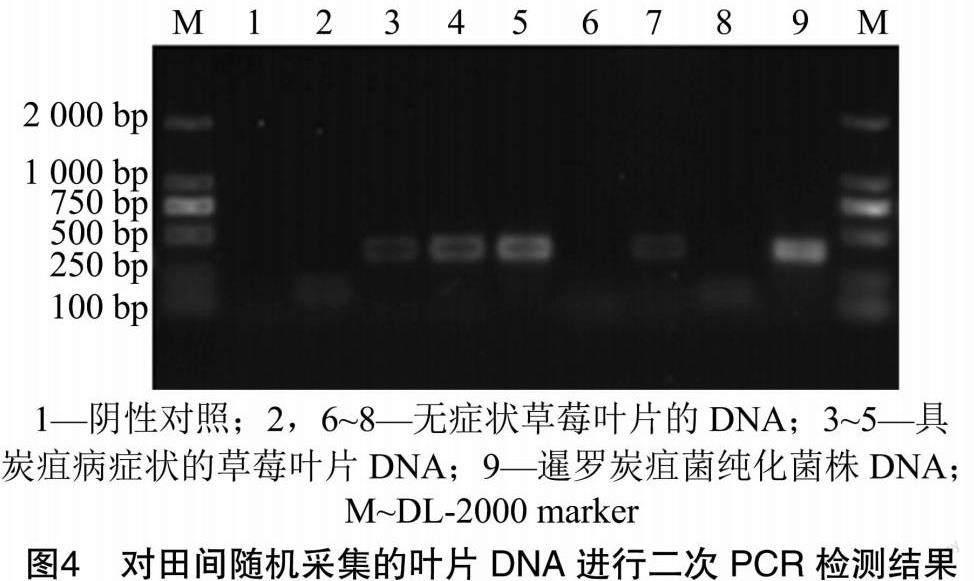
为验证本方法对随机采集的样本的检验效果,从田间随机选择了30份草莓叶片,采用引物CgInt/CsiaR对其检验表明,当用具炭疽病症状的草莓叶片中提取的DNA作为模板时,观察到预期约400 bp的电泳条带,部分无症状的样品中也可观察到同样大小的条带(图4)。样品分离培养的结果表明,所有具症状及部分无症状的草莓叶片组织边缘有暹罗炭疽菌样菌落形成,这些菌落初为灰白色,气生菌丝蓬松、较致密,后颜色逐渐变成灰色,菌落背面灰黑色,5~7 d后形成橘色的分生孢子堆,在显微镜下观察,丝状菌丝具分隔、分枝,分生孢子椭圆形、透明单胞、两端钝圆、有些具明显的油胞。可培养出暹罗炭疽菌样菌落的样品与PCR检测为阳性的样品结果基本一致。
2.6 PCR产物测序
对人工接种和田间自然发病和无症状样品中检测出的阳性PCR产物进行测序,结果(图5)表明,这3种样品中检测到的PCR产物与从暹罗炭疽菌纯培养菌株中检测到的PCR产物拥有相同序列,且与GenBank中的暹罗炭疽菌(登录号LC684901.1)序列同源性达100%。因此,它们同为暹罗炭疽菌。
3 讨论与结论
众所周知,病害防治的基本原则是“预防为主,综合防治”。症状一旦出现,病原菌已侵入植物组织内部且大量繁殖,防治的难度和成本均大幅提高,并且往往收效甚微。在病害发生之前采取保护措施,可以起到最好的防治效果,既可有效防止病害蔓延,又可减少农药的用量。
草莓炭疽病的发生与传播有几个特点:第一,草莓炭疽病菌虽在全年各阶段均可对草莓造成危害,但该病通常在育苗期(6—8月)和定植初期(8月底至9月)发病最重,而在其他季节一般均是零星发生,不会造成重大危害,生产上也不会重点防治。第二,草莓炭疽菌有潜伏侵染的特性。在不适宜该病发生的气候与环境条件下,病原菌可形成无症状侵染,也就是病原菌可在植株上存活,但不会让植株发病,当条件适宜时,携带病菌的无症状组织可成为初感染源导致病害传播。第三,草莓通常采用匍匐茎进行无性繁殖,母苗的质量会直接影响到子苗的质量。综上,根据炭疽病的传播与发病特点,为炭疽病的提前防治提供了可争取的时机。可以在草莓育苗和定植的几个关键时期和环节进行严格监控,如母苗及育苗地带菌情况检测、定植前抽样调查,可起到减少用药和有效防控的效果。
在本研究中,开发了一种基于PCR的检测草莓炭疽病致病菌暹罗炭疽菌的方法。该方法与传统的组织分离法相比,具有快速、准确、易于掌握的优点,甚至可以在症状出现前的侵染早期监测草莓组织中暹罗炭疽菌的携带情况。传统的方法通常要经过表面消毒、培养、镜检甚至是回接等流程,不仅费时、费力,且有很强的专业依赖性,要求操作者熟悉致病菌及常见真菌的培养形态与显微特征,而炭疽菌的分生孢子通常要在培养5~7 d后才有可能形成产孢结构及分生孢子[23],在试验过程中还发现有些菌株在固体培养基上基本不产孢,需要在液体培养基中经过振荡培养才能形成孢子,这无疑增加了鉴定的复杂程度及检测周期。本方法只要掌握DNA提取、PCR扩增、电泳等常规分子操作手段,无需操作者有分类学基础,现在大部分科研机构,只要可进行常规分子检测,均可在较短时间内诊断出批量样品中携带暹罗炭疽菌的情况。
这一技术的核心是引物特异性和检出下限。为了得到针对草莓中暹罗炭疽菌的特异引物,用草莓植株及生长介质中分离到的20余种真菌作为对照,之所以选择这些菌株作为对照,是因为只有出现在草莓植株或生长介质中的真菌才有可能出现在实际检测样品的总DNA中,成为得到正确检测结果的干扰。通过分析它们与暹罗炭疽菌的ITS序列的差异位点,本研究设计了1条反向特异引物CsiaR,結果证明,将该引物与前人发表的针对胶孢炭疽病菌的正向引物CgInt相组合,可从草莓中特异地检测到暹罗炭疽菌,且在草莓基因组DNA、其他对照菌株或无菌水中均不会扩增出预期的约 400 bp 片段。为降低检测下限,采取了2个设计:第一,将从草莓组织中得到的DNA原液不经稀释,直接用于PCR扩增,在第一轮反应体系中除了引物和DNA聚合酶,剩余部分全部用DNA溶液补足,这样可以尽可能提高反应体系中目的菌株的DNA含量;第二,用第一轮PCR产物作为模板,进行二次PCR,实际证明检出下限降低了99.99%,反应体系中DNA浓度仅有5 fg/μL也可观察到条带,利用二次PCR提高目的片段的扩增效率已在其他研究中被多次证实是有效的[24-26]。
虽然本研究在无症状的样品中检测到了目的片段,通过测序也确定属于暹罗炭疽菌,但仍无法确定通过PCR没有扩增到预期的约400 bp DNA片段的样品中是否无暹罗炭疽菌的存在。本研究对人工接种不同浓度暹罗炭疽菌分生孢子悬浮液的草莓苗进行了后续观察,发现浓度为1×104个/mL孢子是发病临界值,在这一浓度,只有部分接种的植株表现较重的症状;当高于这一浓度时,植株可以整体出现炭疽病典型症状,当低于这浓度时,仅产生个别病斑甚至完全不表现症状,而且在生长一段时间后,病斑通常不会扩大,这说明植株本身的免疫系统可抵抗较低浓度的病原菌入侵。本研究实际检测结果是只有接种浓度高于1×104个/mL孢子的样品,及部分接种了1×104个/mL孢子样品中可得到阳性条带。提示这套方法虽然不能在植株携带极少量病菌的情况下得到阳性结果,但检测限与真菌致病浓度是有对应关系的,可用于病害的早期预报。
总的来说,本研究中开发的基于PCR的方法较传统分离培养方法更高效、准确。该方法适用于检测有、无症状草莓组织中的暹罗炭疽菌,以期对病害预测,深入了解病害流行,有助于制定有效的病害控制策略。
参考文献:
[1]张艳婷. 草莓茎基腐病的病原菌鉴定、生物学特性及生物-化学协同控制技术[D]. 杭州:浙江农林大学,2021.
[2]姜莉莉,孙瑞红,宫庆涛,等. 草莓炭疽病病原菌的分离及高效防治药剂筛选[J]. 山东农业科学,2021,53(6):89-93.
[3]赵玳琳,何海永,杨学辉. 温湿度对草莓炭疽菌侵染草莓叶片的影响[J]. 农学学报,2020,10(1):22-26.
[4]王步云,乔 岩,张 涛,等. 北京地区草莓炭疽病病原鉴定及生物防治药剂筛选[J]. 河南农业科学,2019,48(4):88-92.
[5]宋丽丽,张丽勍,高清华,等. 草莓果生刺盘孢菌的生物学特性及致病性测定[J]. 上海农业学报,2019,35(6):88-96.
[6]邬 劼,王晓琳,黄洁雪,等. 7种杀菌剂对草莓胶孢炭疽菌和灰霉病病菌的室内毒力测定[J]. 江苏农业科学,2019,47(20):129-133.
[7]Hu S D,Zhang Y T,Yu H,et al. Colletotrichum spp.diversity between leaf anthracnose and crown rot from the same strawberry plant[J]. Frontiers in Microbiology,2022,13:860694.
[8]Zhang L Q,Song L L,Xu X M,et al. Characterization and fungicide sensitivity of Colletotrichum species causing strawberry anthracnose in Eastern China[J]. Plant Disease,2020,104(7):1960-1968.
[9]Mills P R,Sreenivasaprasad S,Brown A E.Detection and differentiation of Colletotrichum gloeosporioidesisolates using PCR[J]. FEMS Microbiology Letters,1992,98(1/2/3):137-143.
[10]林 婷. 胶孢炭疽菌杀菌剂抗药性的机制、检测技术及治理研究[D]. 杭州:浙江农林大学,2015:1-4.
[11]史芳芳,王 雷. 草莓枯萎病和炭疽病的双重LAMP快速病原鉴定[J]. 农业生物技术学报,2021,29(6):1215-1221.
[12]Qian Y K,Wei S,Zhang N,et al. Rapid detection of 5 fungal diseases in sunflower (Helianthus annuus) using dual priming oligonucleotide system-based multiplex PCR and capillary electrophoresis[J]. SLAS Technology,2022,27(4):253-260.
[13]贾 瑾,徐云龙,周佳乐,等. ‘Cocktail’葡萄柚黄龙病菌检测及鉴定[J]. 园艺学报,2022,49(3):590-596.
[14]Mousavi S A,Keykhasaber M,Fahmideh L,et al. A robust method for identification and in-planta detection of Verticillium dahliae in the infected olive trees,using real-time PCR and nested PCR[J]. Physiological and Molecular Plant Pathology,2020,112:101559.
[15]Forcelini B B,Lee S,Oliveira M S,et al. Development of high-throughput SNP genotyping assays for rapid detection of strawberry Colletotrichum species and the G143A mutation[J]. Phytopathology,2018,108(12):1501-1508.
[16]侯圣凡,刘峻杰,李小峰,等. 基于环介导等温扩增技术的草莓枯萎病检测[J]. 中国农业大学学报,2022,27(3):172-180.
[17]de la Lastra E,Maria J B,Berta D S,et al. A TaqMan real-time polymerase chain reaction assay for accurate detection and quantification of Fusarium solani in strawberry plants and soil[J]. Scientia Horticulturae,2018,237:128-134.
[18]方中達. 植病研究方法[M]. 3版.北京:中国农业出版社,1998.
[19]马文娟,刘月廉,梁拾睿. 广西玉林火龙果炭疽病病原菌的分离与鉴定[J]. 广西植保,2022,35(1):6-8,16.
[20]White T J,Bruns T,Lee S,et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR Protocols.Amsterdam:Elsevier,1990:315-322.
[21]Widodo,Hidayat S H. Identification of Colletotrichum species associated with chili anthracnose in Indonesia by morphological characteristics and species-specific primers[J]. Asian Journal of Plant Pathology,2018,12 (1):7-15.
[22]梁钰平. 草莓炭疽病检测及防治之研究[D]. 台北:台湾大学,2015:4-10.
[23]黄军凯,张国珍. 促进草莓炭疽病菌大量产孢的方法[J]. 植物保护,2014,40(4):107-111.
[24]朱高倩,李双良,马 莉,等. 应用DNA提取改良和二次聚合酶链反应技术检测乌头及其炮制品[J]. 广州中医药大学学报,2021,38(2):385-391.
[25]文亦芾,韩蓉蓉,单贵莲,等. 低磷胁迫柱花草差异表达基因分析研究[J]. 热带作物学报,2020,41(5):971-977.
[26]叶碧欢,陈友吾,胡 杨,等. 两种分子技术检测松木中松材线虫的效果评价[J]. 植物保护学报,2018,45(6):1335-1341.

