LY294002对类脂A诱导的人冠状动脉内皮细胞缝隙连接蛋白43表达的影响
孔海全,李明远,巫相宏△
(1.广西医科大学第一附属医院心血管内科,广西 南宁 530000;2.右江民族医学院附属医院心血管内科,广西 百色 533000)
动脉粥样硬化(AS)是一种慢性炎症性疾病,炎症的促进和缓解机制的平衡决定了最终的临床结果[1]。缝隙连接蛋白43(Cx43)主要分布于内皮细胞及心肌细胞中,Cx43介导的缝隙连接通讯对心血管系统的发育和正常功能具有重要作用[2]。脂多糖发挥作用的主要活性成分是类脂A(KLA),脂多糖可激活并损伤内皮细胞,引起内皮细胞功能障碍,从而导致AS[3]。已有研究证实了脂多糖可促进大鼠血管组织和血管内皮细胞Cx43表达升高[4]。LY294002是一种人工合成的ClassⅠ磷酸肌醇3激酶(PI3K)特异性抑制剂,可通过竞争性拮抗ClassⅠ PI3K中P110催化亚基和腺嘌呤核苷三磷酸(ATP)的结合使PI3K失去活性而阻断PI3K信号通路的活化[5]。已有研究表明,LY294002具有抵抗肿瘤细胞恶性生长同时抑制肿瘤血管生成[6]、减少细胞炎症因子的产生[7]等作用。本研究观察了PI3K通路特异性抑制剂——LY294002对KLA刺激的人冠状动脉内皮细胞(HCAEC)Toll样受体 4(TLR4)、PI3K和Cx43蛋白及mRNA表达的影响,探讨了LY2940002通过抑制TLR4/PI3K信号通路对KLA诱导内皮细胞炎性损伤反应的影响,旨在为预防AS提供新思路和方法。
1 材料与方法
1.1材料 HCAEC细胞株、内皮细胞培养基(ECM)均购自美国Sciencell公司,LY294002购自美国CST公司,TLR4激动剂——KLA购自美国Avanti Polar Lipids公司,CCK8法试剂盒购自中国美仑公司。
1.2方法
1.2.1细胞培养 原代HCAEC为中国 Procell普诺赛公司产品(货号CP H087),通过广西卓一代理商购买。细胞培养基成分为100 μg/mL链霉素、100 U/mL青霉素、10%胎牛血清和100 U/mL内皮细胞生长添加剂。细胞培养环境保持在37 ℃、5%二氧化碳条件下,1~3 d换液1次,待细胞密度至80%以上即可传代,选取同代细胞进行实验。
1.2.2CCK8法检测细胞活力
1.2.2.1检测KLA对HCAEC活力的影响 根据加入KLA的不同质量浓度分为5组,即0、0.01、0.05、0.10、0.20 mg/L组,每个质量浓度设5个复孔。分别在培养孔中加入细胞培养基和相应质量浓度的KLA,置于37 ℃、5%二氧化碳培养箱中24 h,然后终止培养,每孔加入10 μL CCK8溶液,在培养箱中培养4 h,使用酶标仪读取吸光度(A)值。
1.2.2.2检测LY294002对HCAEC活力的影响 采用与1.2.2.1项同样的方法检测0、2.5、5.0、10.0、20.0 μmol/L LY294002对HCAEC活力的影响。为防止不同代数细胞活力的误差,使用同一代数HCAEC进行实验。根据细胞活力确定后续KLA和LY294002的最适实验质量浓度。
1.2.3分组及干预 将HCAEC分为以下4组进行后续Western Blot实验,每项实验均独立重复3次以上。(1)空白对照组(Con组)不进行其他任何处理,使用基础培养基正常培养 HCAEC 24 h。(2)TLR4激动组(KLA组)使用含 KLA的基础培养基培养 HCAEC 24 h。(3)PI3K抑制组(LY组)使用含LY294002的基础培养基培养HCAEC 24 h。(4)KLA+LY组先加入LY294002预处理4 h后加入KLA培养HCAEC 24 h。
1.2.4Western Blot法检测HCAEC TLR4、PI3K、Cx43 蛋白表达 将细胞裂解液加入细胞中并在冰上裂解细胞10 min,离心后收集上清液;采用BCA法测定蛋白表达水平。每孔40 μg蛋白,在聚丙烯酰胺凝胶电泳处理后转膜,封闭,加入一抗孵育过夜,第2天加入二抗,孵育1 h 后进行显影处理,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,使用Odyssey双色红外激光成像系统扫描,以目的蛋白条带灰度值与GAPDH校正后的灰度值比值作为其相对表达水平。
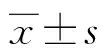
2 结 果
2.1不同质量浓度KLA、LY294002 HCAEC存活率比较 0.01、0.05 mg/L KLA HCAEC存活率[分别为(99.30±2.54)%、(97.06±2.96)%]与0 mg/L[(100.02±1.79)%]比较,差异均无统计学意义(t=0.524、1.918,P=0.614、0.091);0.10、0.20 mg/L KLA HCAEC存活率[分别为(88.04±3.07)%、(67.98±3.57)%]均明显低于0 mg/L,差异均有统计学意义(t=7.529、17.950,P均<0.001)。最终选择 KLA 0.05 mg/L作为对 HCAEC炎性刺激的工作质量浓度。2.5 μmol/L LY294002 HCAEC存活率[(100.16±1.73)%]与0 μmol/L[(100.52±2.17)%]比较,差异均无统计学意义(t=0.284,P=0.784);5.0、10.0、20.0 μmol/L LY294002 HCAEC存活率[分别为(80.85±1.74)%、(70.92±2.09)%、(49.18±1.76)%]均明显低于0 μmol/L,差异均有统计学意义(t=15.820、21.989、41.112,P均<0.001)。最终选择2.5 μmol/L作为后续实验的处理质量浓度。不同质量浓度KLA、LY294002对HCAEC活力的影响见图1。

注:与0 mg/L KLA、0 μmol/L LY294002比较,aP<0.05。
2.2各组HCAEC TLR4、PI3K、Cx43 蛋白表达水平比较 KLA组HCAEC TLR4、PI3K、Cx43蛋白表达水平均明显高于Con组,KLA+LY组HCAEC TLR4、PI3K、Cx43蛋白表达水平明显低于KLA组,LY组HCAEC PI3K蛋白表达水平明显低于Con组,差异均有统计学意义(P<0.05)。LY组HCAEC TLR4、Cx43蛋白表达水平与Con组比较,差异均无统计学意义(P>0.05)。见表1,图2、3。

注:与Con组比较,aP<0.05 ;与 KLA 组比较,bP<0.05。

图3 各组HCAEC TLR4、PI3K、Cx43蛋白表达水平比较

表1 各组HCAEC TLR4、PI3K、Cx43蛋白表达水平比较
3 讨 论
近年来,AS逐渐被认为是脂质驱动的、慢性、低级别的动脉壁炎症性疾病[8],抗炎越来越被认为是进一步降低AS性心血管疾病残余风险的有吸引力的策略。TLR4信号通路可通过多途径参与AS的进程,并参与一系列与AS相关的细胞因子、炎症因子的合成与释放等环节[9]。LI等[10]发现,Corilagin可通过抑制单核/巨噬细胞TLR4信号通路,减少促炎性细胞因子的释放,改善AS斑块的发展。WAHID等[11]发现,TLR4是炎性反应的关键上游调节因子,可驱动子宫激活和控制分娩时机,干预TLR4信号可能对有早产风险或足月后妊娠的妇女有治疗作用。有研究发现,TLR4激动剂可通过Cx43半通道在巨噬细胞中触发ATP的释放,从而影响脓毒症患者的预后[12]。另外有研究表明,TLR4通路激活后Cx43表达明显增加,且呈剂量和时间依赖性[13]。本研究结果显示,使用KLA刺激HCAEC后可激活其TLR4信号通路;而且KLA至少部分通过激活TLR4相关的PI3K通路上调Cx43的表达,与既往研究结果相似。
PI3K信号通路的激活可使细胞产生大量的炎性细胞因子,在机体炎性反应和AS的发展与消退中发挥着重要作用[14]。有研究表明,抑制PI3K、蛋白激酶B (Akt)、肿瘤坏死因子-α mRNA表达对高脂饮食喂养的ApoE基因敲除小鼠具有抗AS的作用[15]。EISENREICH等[16]发现,使用PI3K抑制剂抑制PI3K信号通路的传导可抑制AS的形成,减少斑块面积[17]。既往研究表明,PI3K/Akt信号通路参与了高果糖饲料诱导AS的发生、发展[18]。表明似乎抑制PI3K信号通路对抑制AS具有积极的作用。本研究结果显示,PI3K抑制剂——LY294002能明显抑制KLA诱导的TLR4、PI3K、Cx43的表达,但并不影响正常状态下HCAEC TLR4、Cx43的表达,这一发现可能为将来LY294002的使用范围提供方向。
Cx43的表达调控了内皮细胞的增殖、迁移和血管生成,抑制Cx43可降低细胞增殖和血管生成[19]。有研究发现,AS的冠心病患者Cx43、Cx46的表达均显著上调[20]。有学者发现,小鼠Cx43的普遍减少对AS病变的进展和组成具有有益作用[21]。有研究表明,银杏通过抑制Cx43的表达抑制AS进展[22]。有研究发现,肿瘤坏死因子-α通过下调Cx43诱导平滑肌细胞凋亡,促进AS斑块的稳定。既往研究表明,降低Cx43可通过减少炎性反应和减少平滑肌细胞迁移和增殖限制急性血管损伤后新内膜的形成[23],血管紧张素Ⅱ上调Cx43促进人肺动脉平滑肌细胞的增殖和迁移[24],无翅型MMTV整合位点家族成员3A(Wnt3a)促进血管平滑肌细胞的收缩和分泌表型与Cx43的表达增加有关[25]。由此看来,Cx43在平滑肌细胞中似乎发挥着重要的作用。在AS易感的低密度脂蛋白受体缺陷小鼠中Cx43表达的整体降低可减慢AS斑块形成的进程[25]。既往研究表明,下调Cx43表达可显著降低单核细胞-内皮细胞黏附[26],而单核细胞-内皮黏附是AS发展的关键因素之一。另一方面值得注意的是,表达Cx43的不同细胞类型(平滑肌细胞、内皮细胞等)在AS发生中的确切作用仍有待于证实,但似乎减少血管Cx43表达的策略可能对AS具有保护作用[27]。提示下调Cx43似乎是抑制AS的重要途径之一。本研究结果显示,LY294002可抑制由KLA诱导的HCAEC Cx43高表达,表明LY294002在治疗AS方面也许具有不小的潜力。
总之,使用LY294002可抑制由KLA诱导的HCAEC Cx43高表达,其机制至少部分与抑制TLR4/PI3K信号通路有关,为此 LY294002很可能成为治疗AS的一个重要药物,可能为治疗AS提供新的方案和策略。

