K+和Ca2+通透性离子通道调控血管干细胞作用的研究进展
马颖,李鹏云
西南医科大学心血管医学研究所,医学电生理教育部重点实验室,四川省医学电生理重点实验室,四川省心血管疾病防治协同创新中心,四川泸州 646000
传统观点认为成体血管内的细胞是终末分化的,近年来研究发现血管上存在多种类型的干细胞,包括内皮祖细胞(endothelial progenitor cells,EPCs)、平滑肌祖细胞(smooth muscle progenitor cells,SMPCs)、髓系祖细胞、间充质干细胞(mesenchymal stem cells,MSCs)和周细胞等[1-4]。这些干细胞具有自我更新和多向分化潜能,在受损组织和器官的修复过程中发挥重要作用,在组织工程和再生医学领域有广阔的应用前景。正常生理条件下,干细胞参与调控和维持血管内稳态,当血管受到损伤时,相关损伤信号可动员干细胞到机体受损区域并分化为成熟的血管细胞,参与调控血管的发育、修复和重塑等过程[5-6]。血管壁为血管干细胞提供了微环境,具有调节血管干细胞的发育及其与周围细胞和细胞外基质之间信号传递的能力。
血管干细胞的生物学特性受很多因素影响。近年来,离子通道对干细胞生物学行为的调控引起了人们的广泛关注。离子通道是细胞膜上具有特殊亲水性的一类疏水膜蛋白,可选择性通透不同离子,是血管、神经、肌肉等细胞电生理活动的物质基础。离子通道的正常结构和功能是维持细胞生物活性的基础,其结构异常和功能障碍与许多疾病的发生发展密切相关[7]。血管上的离子通道,如钾通道、钙通道和瞬时受体电位通道等,几乎在所有的血管细胞中都有表达[8-9]。多个离子通道协同维持正常血管功能,血管细胞离子通道功能紊乱是心血管疾病发生发展的重要机制之一[10-11]。目前已经证实,不同类型的干细胞中都存在着多种离子通道[12]。离子通道的表达和生理特性随干细胞的增殖、迁移和分化等过程发生改变,细胞内外机械信号、生物化学刺激等可激活或抑制细胞膜上的离子通道电流,引起细胞膜电位改变进而影响干细胞的生物学活性[13]。目前关于血管干细胞离子通道的研究相对较少,离子通道产生的生物电信号在血管干细胞增殖、分化和迁移过程中的作用机制有待进一步深入研究。细胞内K+和Ca2+之间的动态平衡对血管功能的调控至关重要。介导K+外流和Ca2+内流的离子通道在血管的功能调控中发挥重要的作用。本文将对血管上主要分布的可通透K+和Ca2+的离子通道在调控血管干细胞生物活性中作用的研究进展进行综述,旨在为进一步揭示生理和病理状态下离子通道的电活动对血管干细胞生物学活性的调控机制,为临床心血管疾病的靶向防治提供新的思路。
1 钾通道
关于干细胞钾通道的研究主要集中于钙激活钾通道(Ca2+activated-K+channels,KCa)和内向整流钾通道(inward rectifier K+channels,Kir)等。钾通道由胞内配体(如Ca2+或ATP)调控,是沟通质膜生理特性和胞内代谢活动之间的桥梁。近年来,有研究认为K+可能与多功能信号调控有关。K+作为细胞内的主要离子,钾通道的功能状态可作为评估干细胞生物学活性的一种指标[14]。见图1。
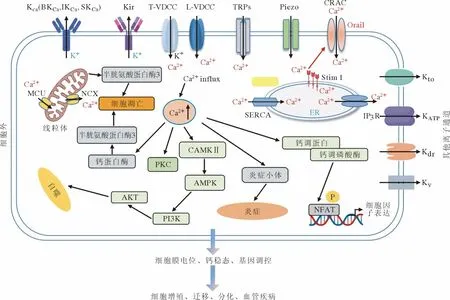
图1 血管上主要分布的钾通道和钙通道参与调控细胞的增殖、迁移和分化
1.1 钙激活钾通道 KCa通道作为钾通道家族中的重要成员,主要参与维持细胞内钙稳态、负反馈调节细胞膜电位、平滑肌收缩等,在血管结构重构与功能调控研究方面具有重要意义。KCa通道依其单通道电导大小,分为大电导钙激活钾通道(big conductance KCa,BKCa)、中电导钙激活钾通道(imtermediate conductance KCa,IKCa)和小电导钙激活钾通道(small conductance KCa,SKCa)。
(1) BKCa通道:BKCa通道广泛分布于各种组织的细胞膜,甚至线粒体内膜。在可兴奋细胞中主要通过调节细胞膜电位和细胞内钙信号,影响血管舒缩和神经兴奋性[15]。近年来,BKCa在干细胞功能调控中的作用日益受到关注。Echeverry等[16]报道5%的血小板裂解液(platelet lysate,PL)可通过激活BKCa通道促进大鼠MSCs 的迁移。另外,在MSCs 细胞周期的G2/M期,细胞膜上BKCa通道的表达显著减少,提示BKCa通道的表达具有一定的周期依赖性,靶向BKCa通道对人子宫内源性MSCs 的增殖具有促进作用[17]。Ayad等[18]首次发现BKCa通道存在于W8B2 阳性的成体心脏干细胞群,BKCa通道阻滞剂Paxilline 可使细胞周期阻滞在G0/G1期,抑制细胞的增殖。以上研究提示BKCa通道激活在促进血管干细胞的迁移和增殖过程中发挥重要作用,在不同类别干细胞功能调控中的具体机制还需要进一步研究。
(2) IKCa通道:IKCa通道(又称KCa3.1,IK)由KCNN4 基因编码,通道的激活具有钙离子敏感度而不依赖电压,在血管组织中广泛表达,参与血管舒缩、炎性增生和组织纤维化等过程[19]。有研究表明,成纤维细胞生长因子和血管内皮生长因子可诱导IKCa表达上调,促进内皮细胞(endothelial cells,ECs)增殖和血管生成[20]。此外,Vigneault等[21]报道骨髓MSCs 从G1期增殖到S期,KCa3.1 通道的表达显著增加,采用RNA 干扰KCa3.1 通道的表达则可抑制细胞的增殖。在小鼠MSCs中,KCa3.1 通道、Kir 通道以及容量调控的氯通道CLCN3 的激活共同促进细胞周期蛋白Cyclin D1 和Cyclin E 的表达[22]。以上研究结果提示IKCa通道激活可促进干细胞周期蛋白的表达,靶向调控IKCa通道影响血管干细胞的增殖。
(3) SKCa通道:SKCa通道同样对膜电位变化不敏感,仅由细胞内Ca2+激活[23]。SKCa(SK)通道家族由3 个成员组成,即SK1(KCa2.1,KCNN1)、SK2(KCa2.2,KCNN2)和SK3(KCa2.3,KCNN3)。SK1~SK3 在神经组织中表达丰富,参与调控神经细胞膜电位以及后除极等,进而影响动作电位的频率和时程。SK3 通道主要表达在未分化的神经干细胞中,SK3 通道的激活可促进神经干细胞丝状伪足出芽和蛋白的转运,进而促进细胞的增殖和迁移[24]。有研究表明,特异性敲除内皮细胞SKCa可引起小鼠血管舒张反应下降,血压升高,提示ECs中SKCa通道有望成为高血压防治的新靶点[25]。此外,SKCa通道激动剂1-乙基-2-苯并咪唑啉酮可促进胚胎干细胞向心肌细胞的分化,诱导Ras-MEKERK 信号级联反应的激活,进而引起心脏起搏细胞增多[26]。而SKCa通道的表达和功能改变是否参与血管干细胞生物学活性的调控则需要进一步的研究。
1.2 Kir 通道 Kir 通道在多种组织中广泛分布。目前发现Kir 通道超家族有7 个亚家族(Kir1.x~Kir7.x),尽管Kir 通道亚家族在功能上存在差异,但其都具有内向整流特性,因而在保持血钾平衡、维持细胞静息电位等方面发挥重要作用[27-28]。此外,一些Kir 通道亚型,如G 蛋白激活的内向整流K+通道(Kir3.x)和ATP 敏感K+通道(Kir6.x)是由细胞外配体和细胞内ATP 触发的,可调节多种细胞活动和信号级联反应[29]。
近来研究发现,EPCs 中存在Kir2.1 通道,将Kir2.1 基因敲除的EPCs 移植到大鼠损伤股动脉段可促进损伤动脉的再内皮化,并抑制新生内膜的形成。用ML133 抑制Kir2.1 或Kir2.1 基因敲除可促进大鼠骨髓来源EPCs 的迁移和黏附以及向ECs 的分化,增加EPCs 中NO 的产生并促进ECs成管[30]。此外,阻断Kir2.1 或敲除Kir2.1 会导致EPCs 适度去极化,细胞内Ca2+和活性氧(reactive oxygen species,ROS)浓度增加,增强EPCs 功能和血管新生,最终促进动脉粥样硬化损伤血管的修复[30]。另有文献报道,Kir 基因敲除可显著抑制SMCs 的增殖和迁移[31]。以上研究表明,内向整流钾通道Kir2.1 通过促进干细胞的增殖、迁移和分化来调控血管的结构和功能。因此,靶向调控干细胞Kir2.1 通道有助于促进疾病状态下损伤血管的修复。
2 钙通道
Ca2+是细胞内重要的第二信使,参与调控细胞的收缩、分泌、代谢、基因表达和细胞凋亡等过程。细胞内Ca2+浓度的增加主要有两个来源,即内质网(endoplasmic reticulum,ER)或肌浆网(sarcoplasmic reticulum,SR)钙库Ca2+释放和胞外Ca2+内流[32]。Ca2+内流通过质膜Ca2+通道(L型钙通道、T型钙通道、瞬时受体电位通道和CRAC通道等)调控细胞的增殖、迁移、分化和细胞黏附等过程。这些钙通道不仅是Ca2+信号的主要贡献者,也是Ca2+信号调控的重要靶点[33]。见图1。
2.1 CRAC 通道 细胞内肌浆网钙库Ca2+释放激活的Ca2+内流(Ca2+release-activated Ca2+,CRAC)通道调控细胞内的Ca2+震荡,与生理和病理状态下细胞的增殖、迁移、分化、凋亡等生物学活性息息相关[34]。CRAC 通道具有极低的电导(在fS 范围内,大多数Ca2+通道的电导在pS 级)和极高的Ca2+选择性(PCa/PNa>1 000)[35]。CRAC 通道主要由STIM(STIM1 和STIM2)和ORAI(ORAI1、ORAI2 和ORAI3)组成[36-37],CRAC 通道开放激活多个下游信号通路,调控细胞因子的产生、基因表达以及细胞的增殖、分化、凋亡。有研究表明,ORAI1 介导的CRAC 通道对血管损伤后新生内膜的形成至关重要。在血管损伤时VSMCs 中ORAI1 表达上调,CRAC 通道介导的胞外Ca2+内流增加激活下游的NFAT 信号通路,促进VSMCs增殖和大鼠颈动脉球囊损伤后新生内膜形成[38]。高脂饮食16 周后,ApoE-/-小鼠血管EPCs 中STIM1和ORAI1 表达下调,自发的或VEGF 诱导的钙库操纵的钙内流(store operated calcium entry,SOCE)减少,EPCs 的增殖和迁移受到抑制,进而导致动脉粥样硬化斑块显著增加[39]。此外,经CRAC 通道的外Ca2+内流可激活NF-κB 转位入核,激活下游信号通路调控MSCs 的活性,而CRAC 通道抑制剂(SKF96365)则可抑制NF-κB 的核转位,进而干扰MSCs 的增殖[40]。以上研究提示CRAC 通道介导的钙信号在细胞周期调控中具有重要意义,靶向调控血管干细胞CRAC 通道将为再生医学研究提供新思路。
2.2 L-型钙通道 L-型钙通道(L-type voltagegated calcium channels,L-VGCCs)广泛分布于不同的组织和细胞中,在维持细胞内钙稳态中起重要作用。L-VGCCs 主要由构成孔道的α1 亚单位、辅助亚单位α2/δ、β 亚单位和γ 亚单位构成。根据α1 亚单位,L-VGCCs 可分为Cav1.1~ Cav1.4 四个亚型,具有独特的药理学和生物物理学特性[41]。L-VGCCs 可被BayK8644 和FPL64176 激活,被尼伐地平(nifedipine)和尼莫地平(nimodipine)阻断。
以往研究证实L-VGCCs 主要参与兴奋性细胞的信号调控,如兴奋收缩耦联、神经递质分泌、基因转录等。近年来越来越多的研究表明,其在非兴奋细胞如MSCs 的增殖和分化过程中也发挥重要作用[42-43]。然而,采用L-VGCCs 抑制剂可促进小鼠MSCs 分化成成骨细胞,但却抑制大鼠MSCs 的分化。研究结果的差异可能与尼伐地平的非特异性阻断有关,另外不同种属组织来源的细胞L-VGCCs 亚型的表达差异也是原因之一[42]。人脂肪衍生的间充质干细胞(human adipose-derived mesenchymal stem cells,hASCs)具有分化成为多种细胞类型的能力。在TGF-β1 诱导分化的hASCs中,血管SMCs 中表达的L-VGCCs(Cav1.2)随着Cavβ1 和Cavβ3 亚型的增 加而显著增加。此外,L-VGCCs 激活可促进骨髓MSCs 增殖和向成骨细胞分化[44],极低频率的电磁场可促进L-VGCCs 介导的钙内流,激活FAK/Rho GTPase 信号通路进而促进MSCs 骨架重排和细胞迁移[44]。以上研究表明,进一步明确L-VGCCs 对不同组织来源干细胞增殖、迁移和分化的影响,将为组织工程学中以L-VGCCs 通道为靶点的研究带来新的应用方向。
2.3 T-型钙通道 T-型钙通道(T-type voltagegated calcium channels,T-VGCCs)是一类激活电位较低、失活速度快、电导相对较小的电压依赖性钙通道[45]。T-VGCCs 家族包括Cav3.1、Cav3.2和Cav3.3 三种亚型[46]。T-VGCCs 在血管ECs 中表达,血管紧张素Ⅱ可通过调控T-VGCCs 介导的钙内流进而促进人脐静脉内皮细胞的迁移,这对于血管生成至关重要[46]。有研究发现Cav3.1 是新生内膜形成过程中VSMCs 增殖所必需的,阻断Cav3.1 有助于预防血管再狭窄,选择性T-VGCCs阻滞剂能够抑制野生型小鼠新生内膜的形成[47]。此外,目前关于T-VGCCs 对干细胞生物活性的研究主要集中在神经干细胞方面[48-49],对T-VGCCs调控血管干细胞的作用和机制的研究相对较少。有限的研究表明阻断CaV3.2 可抑制MSCs 胞内钙增加和细胞迁移。高迁移率族蛋白1 可通过PKA/β-catenin/γ-cystathionase 途径促进T-VGCCs 介导的钙内流,从而促使MSCs 迁移和归巢至损伤部位参与调控新生内膜的形成[50]。由于T-VGCCs在血管等多种组织中广泛表达,以及对生理和病理状态下血管功能调控的重要作用[51-52],研究TVGCCs 在血管干细胞功能调控中的作用和机制具有重要意义。
3 瞬时受体电位通道
瞬时受体电位(transient receptor potential,TRP)通道是在血管中广泛表达的非选择性阳离子通道,体内外化学和物理刺激可激活血管内皮和平滑肌细胞的TRP 通道引起胞内Ca2+增加[53]。根据功能和遗传相似性,TRP 通道可分为TRPC、TRPV、TRPM、TRPA、TRPML 和TRPP[53-54]。TRP通道具有较高的Ca2+选择性。G 蛋白耦联受体和受体酪氨酸激酶途径介导的信号可激活TRP 通道,引起细胞膜去极化和胞内钙浓度增加,进而调控生理和病理状态下细胞的功能[55]。TRPC 和TRPV 亚型功能和(或)表达的失调参与调控血管平滑肌细胞从收缩表型转换为合成表型,在肺动脉高压、动脉粥样硬化和血管再狭窄等疾病的发生发展中发挥重要作用[56]。目前关于血管干细胞TRP 通道的研究以TRPC 通道为主,主要集中于TRPC1 和TRPC3。
3.1 瞬时受体电位通道1 瞬时受体电位通道1(TRPC1)在EPCs 的功能调控中起重要作用。有研究表明,敲除TRPC1 可通过下调Calmodulin/eNOS 信号通路抑制EPCs 的增殖、迁移和成管,从而抑制小鼠体内的血管生成[57]。TRPC1 基因敲除显著抑制EPCs 外钙内流,导致细胞周期阻滞在G1期[58]。新近研究发现,TRPC1/ORAI1/ORAI3/STIM1 介导的Ca2+内流可促进老年MSCs 的增殖以及发育为年轻的干细胞谱系,提示在再生医学的研究中具有重要意义[59]。以上这些研究结果提示干细胞TRPC1 有望成为促进血管损伤后修复的新治疗靶点。
3.2 瞬时受体电位通道3 目前研究表明瞬时受体电位通道3(TRPC3)对神经发育和神经元网络的形成至关重要。Hao等[60]研究表明,特异性敲除TRPC3 可显著抑制小鼠胚胎干细胞向神经细胞的分化。最近有研究发现,鸢尾素可通过与TRPC3结合促进脂肪来源MSCs 分化为米色脂肪细胞,米色脂肪也具有产热功能,这为肥胖等代谢病的防治提供了新的靶点[61]。此外,敲低MSCs 中TRPC3 可显著降低NF-κB 的活化,并抑制MSCs分化来的CAF 细胞(MT-CAFs)的生长、迁移和侵袭,提示激活TRPC3/NF-κB 轴可促进MSCs 的分化,加速结肠癌的进展[62]。以上研究提示TRPC3在干细胞功能调控中起着重要作用,但其是否参与调控血管干细胞的功能活性进而影响血管的功能还需要进一步研究。
4 机械敏感的离子通道
机械门控Piezo 通道是进化保守的大分子跨膜蛋白,是机械敏感度阳离子通道家族中的一员,包括Piezo1 和Piezo2 两个亚型[63-64]。相对于其他机械敏感通道,Piezo 具有离子非选择性,并且在各种机械敏感细胞中广泛表达。细胞微环境的机械刺激可激活Piezo 蛋白介导胞外Ca2+内流,将机械信号转化为生物化学信号,调控细胞的增殖和分化[65]。由于血管壁无时无刻不接受着血流剪切力刺激,因此机械信号可能通过激活Piezo 通道调控干细胞的增殖、迁移和分化等过程,进而影响血管细胞的骨架重排和血管发育[66-67]。应激诱导的Piezo 通道的开放也会激活分解素和金属蛋白酶结构域蛋白10(ADAM10)释放酶,并激活Notch1信号通路进而促进祖/干细胞的分化和增殖[68-69]。依赖于ADAM10 的Notch 信号对早期血管的发育和新生至关重要,Notch1 和Notch4 已被证明可以调控小鼠血管床的发育,Notch 信号失活会抑制小鼠血管的生成[70]。以上研究均揭示Piezo 通道在干细胞的分化和发育中具有重要调控作用。
5 干细胞离子通道与血管疾病
研究表明,离子通道与心血管系统的生理功能和病理生理改变密切相关。动物模型和疾病相关实验研究都表明离子通道在动脉粥样硬化、高血压、血管再狭窄等血管损伤后重塑中具有重要的调控作用[71]。通道功能、通道数量、通道电导和(或)开放概率的变化,以及通道亚单位或通道复合体之间时空效应的变化,都参与调控血管疾病的发生发展。有研究发现高血压患者与正常血压者肠系膜动脉平滑肌细胞中BKCa通道的差异,首次证实VSMCs 中BKCa通道的活性在高血压期间降低,并与通道β1 亚基基因和蛋白表达下调有关[15]。此外,过表达TRPC3 通道可增强VEGF 触发的EPCs 外钙内流,促进细胞增殖和成管[72]。Miao等[58]报道,SOCE 降低可引起EPCs 功能障碍,阻碍动脉粥样硬化过程中损伤内皮细胞的修复。总之,关于血管疾病中干细胞离子通道的研究还比较有限,研究血管细胞间的离子通道信号网络以及离子通道在血管干细胞中的作用将为临床上相关疾病的防治提供新的思路。
6 结语
近年来,血管干细胞的研究取得了重大进展,尤其是在血管修复和重构中对干细胞的激活、归巢和分化机制的研究。离子通道被认为是生物电信号产生的基础,影响各种干细胞的增殖、迁移和分化等生物学功能。然而目前血管干细胞中各种离子通道的作用和机制研究相对不足。虽然在不同类型的干细胞中发现了多种离子通道,但离子通道的异质性表达是否与不同的细胞亚群和(或)细胞周期的不同阶段有关尚不清楚。不同离子通道之间的相互调控机制、上下游信号通路等尚需要进一步的探讨。因此,血管干细胞离子通道的研究将为心血管疾病的防治提供新思路,为再生医学拓展新的研究领域。
目前,以干细胞离子通道为调控靶点的心血管疾病的治疗尚无临床报道。干细胞对血管功能的调控还有很多未解之谜需要进一步深入研究。首先,需要明确血管干细胞的异质性,干细胞亚群在生理和病理状态下的表征和功能特性,以及干细胞的发育和分化在转录组或蛋白质组水平的变化与心血管疾病之间的关系。其次,疾病状态下血管干细胞离子通道的异常表达和功能障碍对体内干细胞生物学活性的影响,以及与血管功能障碍或损伤后修复之间的相关性及其调控机制等也是悬而未决的问题。
致谢感谢国家自然科学基金委的资助(82070502)和四川省科技创新苗子工程项目的资助(2022067);感谢杨艳研究员对文章撰写的指导和建议。
作者贡献马颖:撰写文章初稿,查阅文献和做图;李鹏云:科研项目申请、文章撰写的指导、修改以及投稿和校对。
利益冲突不存在任何利益冲突。

