量子点标记免疫层析试纸条检测谷物中T-2毒素
张滢 彭涛 苗茜 刘笑笑 丁辉

摘 要:利用量子点(QDs)标记T-2抗体(QDs-Ab)作为信号探针,建立了一种量子点免疫层析检测方法(QDICA),用于快速检测谷物中的T-2毒素。结果表明,QDICA的检测限为5 μg·L-1。整体检测时间不超过10 min,方法特异性良好且具有一定的有效性。T-2-QDICA操作简便快速,成本低,满足谷物中T-2残留量的快速检测要求。
关键词:T-2毒素;量子点;免疫层析试纸条;谷物;快速检测
Detection of T-2 Toxin in Cereals with Quantum Dot Labeled Immunochromatographic Test Strip
ZHANG Ying, PENG Tao, MIAO Qian, LIU Xiaoxiao, DING Hui
(Lanzhou Institute for Food and Drug Control, Lanzhou 730050, China)
Abstract: A quantum dot immunochromatographic assays (QDICA) using quantum dot labeled T-2 antibody (QDs-Ab) as signal probe were developed for the determination of T-2 in cereals. The limit of detection for T-2 was 5 μg·L-1. The detection time was 10 min. The assays have good specificity and effectiveness. The QDICA is simple, fast, and low cost, it is suit for rapid detection of T-2 in cereals.
Keywords: T-2 toxin; quantum dot; immunochromatography test strip; cereal; rapid detection
单端孢霉烯族毒素是一大类化学结构相关的真菌毒素,根据其特征官能团的不同可分为A、B、C、D 4种类型。T-2是A类型中毒性最强的,广泛分布在谷物及动物饲料中,性质稳定,不易灭活。T-2会引起急性和慢性毒性,对人和动物的多种组织和器官产生毒害作用,能够引起的毒性效应包括消化系统和肝脏毒性、骨系统损伤、基因与细胞毒性、血液系统毒性、免疫系统毒性、神经毒性和生殖发育毒性等[1]。
随着检测技术的快速发展,目前国内外对T-2的测定方法主要有液相色谱(Liquid Chromatography,LC)、液质联用(Liquid Chromatography-Tandem Mass Spectrometry,LC-MS)、气相色谱(Gas Chromatography,GC)、气质联用(Gas Chromatography-Mass Spectrometry,GC-MS)及免疫法[2]。其中LC-MS不需要在检测过程中对T-2进行复杂的衍生,故成为T-2最常用的分析检测方法,但其费时费力,成本高。最便捷、灵敏度高的检测方法是酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay,ELISA)法,可用于广泛的粮食样品T-2的筛查。基于ELISA衍生出的免疫层析法,成本低且适用于大量样品的现场快速分析[3],对减少T-2的污染和降低暴露风险有积极作用。
QDs是一种新型纳米材料,制备简单,发光效率高,化学稳定性好。QDs凭借其诸多优点及独特的荧光效应,在食品中有毒有害小分子物质的快速检测领域得到广泛应用[4-5]。本研究以量子点和T-2抗体为基础,制备QDs-Ab荧光探针,建立一种T-2-QDICA新方法,以期能够缩短谷物中T-2的检测时间,降低检测成本。
1 材料与方法
1.1 材料与仪器
样品垫、结合垫、吸水纸垫、PVC板、Milipore HF 140s硝酸纤维素膜,上海金标公司;羧基化水溶性量子点,武汉珈源公司;T-2单克隆抗体(T-2-Ab)、T-2包被原(T-2-BSA)、T-2 ELISA试剂盒,山东绿都生物科技有限公司;T-2毒素(T-2)、黄曲霉毒素B1(AFB1)、黃曲霉毒素M1(AFM1)、玉米赤霉烯酮(ZEN)、伏马毒素B1(FB1)、呕吐毒素(DON)、赭曲霉毒素A(OTA),德国Dr.Ehrenstorfer公司;羊抗鼠二抗(IgG)、乙基碳二亚胺(EDC),美国Sigma公司;玉米,当地超市。
1.2 设备与仪器
HM3035喷金仪、ZQ2000自动斩切机,上海金标生物有限公司;ZF1-Ⅱ紫外分析仪,上海嘉鹏科技有限公司。
1.3 实验方法
1.3.1 QDs-Ab复合物的制备
取25 μL QDs(8 μmol·L-1)于2.0 mL离心管中,加入93 μg EDC,再分别加入12 μg、24 μg、30 μg T-2-Ab,混合均匀,210 r·min-1室温下避光充分反应4 h。然后将溶液在4 ℃条件下12 000 r·min-1离心3 min除团聚。然后用规格为100 kDa的超滤离心管将离心后的上清液浓缩,使用尺寸排阻柱对浓缩液纯化,最终得到QDs-Ab复合物。
1.3.2 QDICA的组装
将140s硝酸纤维素膜、吸水纸垫、结合垫和样品垫依次粘贴在PVC板上,将羊抗鼠IgG、T-2-BSA分别包被在NC膜上,作为QDICA的质控线(C线)、检测线(T线),于37 ℃烘箱中放置4~6 h,用自动斩切机斩断成宽为3.7 mm的试纸条,储存在常温、干燥、避光的条件下。
1.3.3 QDICA实验条件优化
样品的上样缓冲液、QDs-Ab复合物的添加量、工作液的加入量、二抗和T-2-BSA的稀释倍数等都直接影响试纸条的准确性以及灵敏度。分别选择QDs-Ab的添加量为0.1 μL、0.3 μL、0.5 μL,工作液添加量为3 μL、5 μL、8 μL、10 μL以及4种不同的上样缓冲液进行试纸条检测,当试纸条C、T线荧光强度一致且适中、荧光条带清晰以及背景干扰程度小时,确定为QDICA最佳工作条件。
1.3.4 QDICA方法检测限确定
将T-2用上样稀释液依次稀释为0 μg·L-1、1.0 μg·L-1、2.5 μg·L-1、5.0 μg·L-1、8.0 μg·L-1、10.0 μg·L-1、25.0 μg·L-1,分别和一定量的QDs-Ab复合物、工作液在试纸条最优工作条件下上样,10 min后通过紫外分析仪观察检测结果。T线荧光条带恰好完全消失时所对应的T-2最小浓度确定为T-2-QDICA的可视化检测限。
1.3.5 QDICA方法特异性评价
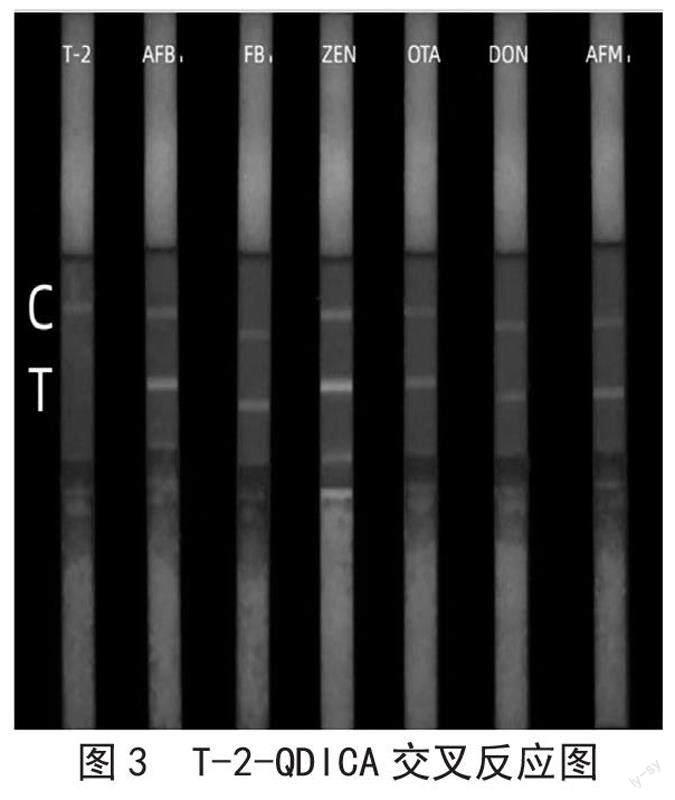
在试纸条最佳工作条件下,分别检测T-2、AFB1、FB1、ZEN、OTA、DON和AFM1,通过观察C、T线显色情况,进行方法特异性评价。
1.3.6 QDICA实际样品的检测及有效性验证
选择阴性谷物样品作为实际样品进行测定。准确称取5 g粉碎均匀的谷物样品,精密加入5 mL 75%的甲醇溶液作为样品提取液充分提取,涡旋20 min后,离心机3 900 r·min-1下离心10 min,留下上清液待用。将阴性样品上清液用上样缓冲液稀释4倍来消除基质影响,最后进行试纸条上样检测。
本实验利用商品化ELISA试剂盒验证QDICA方法的有效性。
2 结果与分析
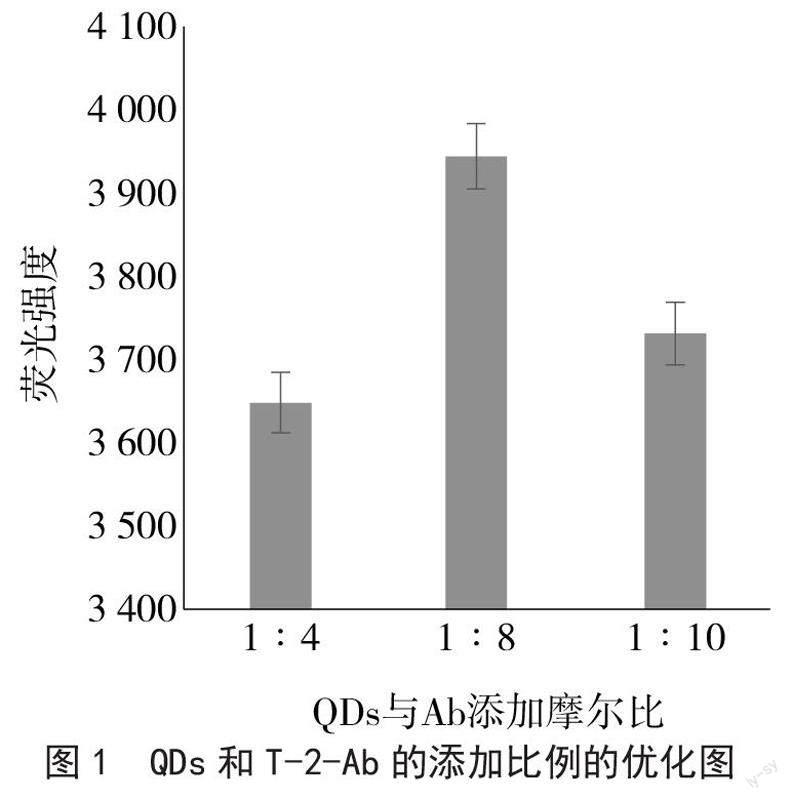
2.1 制备QDs-Ab时QDs和T-2-Ab添加比例的优化
QDs和T-2-Ab的添加比例会影响QDs-Ab复合物的偶联效率,最终影响QDICA方法的灵敏度。本研究选择摩尔比为1∶4、1∶8、1∶10的QDs和T-2-Ab制备QDs-Ab。由图1可知,QDs和T-2-Ab摩尔比为1∶8时,荧光强度最强,所以选择QDs和T-2-Ab摩尔添加比例为1∶8。
2.2 上样緩冲液的优化
试纸条的上样缓冲液会影响免疫反应活性,缓冲液的pH值、溶液中不同离子的浓度均会影响C、T线的荧光强度。本研究选择pH值为5.7和7.4的PB、pH值为7.4的PBS、pH值为8.3的BBS作为上样缓冲液进行试纸条检测。结果发现,缓冲液为pH=5.7的PB时,C、T线处荧光亮度差;缓冲液为pH=7.4的PB时,C、T线处荧光条带均匀清晰,QDICA灵敏度较好;缓冲液为pH=7.4的PBS时,QDICA灵敏度稍差;缓冲液为pH=8.3的BBS时,C线处荧光条带亮度稍弱,可能引起实验结果无效的误判。综上,最终选择pH=7.4的PB作为试纸条上样缓冲液和样品稀释液。
2.3 QDs-Ab复合物和工作液添加量的确定
QDs-Ab复合物的加入量决定着QDICA C、T线处荧光强度,直接影响QDICA方法的灵敏度。工作液的加入主要影响样品溶液在QDICA上的层析速度,进而影响QDs-Ab与T-2-BSA结合效率,间接影响了实验结果的准确性。本文研究QDs-Ab的添加量为0.1 μL、0.3 μL、0.5 μL,工作液添加量为3 μL、5 μL、8 μL、10 μL时,QDICA C、T线处的荧光强度。结果发现,当加入QDs-Ab复合物量较少(0.1 μL)时,C、T线荧光强度较弱,说明没有足够的QDs-Ab复合物与C、T线上二抗和T-2-BSA结合;当加入QDs-Ab复合物量太多(0.5 μL)时,导致C、T线荧光亮度太强而灵敏度降低。随着工作液添加量的增加,变化梯度由一般到明显再到一般。因此,本文最终确定QDs-Ab和工作液的加入量分别为0.3 μL和8.0 μL。
2.4 QDICA检测限的确定
将配制成不同浓度的T-2混合样品溶液滴加在样品垫上,10 min后通过紫外分析仪观察检测结果。
如图2所示,当样品中不含T-2时,C、T线上荧光条带清晰,亮度均匀一致。随着T-2浓度逐渐升高,C线不变,T线的荧光强度逐渐变弱直至消失不见。T-2浓度为5 μg·L-1时,T线上荧光条带恰好完全消失。经过几次重复实验,确定T-2-QDICA方法的可视化检测限为5 μg·L-1。
2.5 T-2-QDICA特异性的评价
如图3所示,5 μg·L-1的T-2就能够使QDICA T线处的荧光条带消失,而其余6种高浓度真菌毒素标准品溶液(浓度均为1 mg·L-1)都不能与T线处包被物结合,从而使T线荧光条带消失。说明QDs-Ab复合物只能和其对应的T-2抗原结合,与其他6种常见的真菌毒素均无交叉,特异性好。
2.6 T-2-QDICA有效性的验证
经过验证发现,实验中QDICA方法与ELISA试剂盒的检测结果一致,证明QDICA方法高效、有效,可简单、快速实现T-2在谷物中的半定量检测。
3 结论
本研究利用QDs作为荧光标记物,基于免疫特异性识别,建立了一种灵敏、快速的荧光免疫层析方法用于检测谷物中T-2的残留量。本方法相较于大型仪器检验方法,检测时间短,操作简单,实际样品中测定结果与ELISA试剂盒测定结果一致,证明本方法有效且具有一定实用性。
参考文献
[1]刘磊,张国巍,丁博,等.T-2毒素研究进展[J].吉林医药学院学报,2013,34(2):115-119.
[2]胡娜,徐玲.真菌毒素检测方法研究进展[J].食品科学,2007(8):563-565.
[3]沙志聪,其木格,贾增艳,等.量子点标记免疫层析试纸条快速检测谷物中赭曲霉毒素A[J].食品工业科技,2019,40(17):191-195.
[4]徐海娥,闫翠娥.水溶性量子点的制备及应用[J].化学进展,2005(5):800-808.
[5]贾继来,魏凌峰,周娇娇,等.CdSe量子点的构建及其在食品安全检测中的应用研究[J].食品科技,2022,47(5):274-281.

