浮床种植对挺水植物中重金属赋存特征的影响
黄思程, 童春富, 朱宜平
(1. 华东师范大学 河口海岸学国家重点实验室, 上海 200241; 2. 崇明生态研究院, 上海 202162;3. 上海城投原水有限公司, 上海 200125)
0 引言
挺水植物具有吸收水体重金属的生态功能[1-2], 利用挺水植物对水体重金属进行吸收、富集, 可以减少或去除水体重金属污染, 从而达到污染治理与生态修复的目的[3-4]. 同时, 采用挺水植物处理水体重金属污染具有低成本、低运行费用等优势[5]. 因此, 国内外学者已针对挺水植物对重金属的吸收与富集[6-8]、去除机制[9-11]、影响因素[6,12-13]等方面开展了广泛研究.
生态浮床, 也可以称为人工浮床、人工浮岛, 是一种利用树枝、竹子或者一些高密度材料为载体,其上种植水生植物, 搭建在水上以有效去除水体污染物的一种装置[14]. 生态浮床可用于水体原位修复,搭建生态浮床是一种高效的空间利用方式[15], 在人均土地资源短缺的发展中国家具有广阔的应用前景[16].生态浮床植物多选用对水体污染耐性高、生物量大、易收割的挺水植物[17]. 国内外有关利用生态浮床去除水中氮、磷的研究发现, 水生植物构建的生态浮床能够在一定程度上提高水体中氮、磷的去除率[18-20],相比之下, 有关生态浮床对重金属的吸收去除的研究还相对较少[17,21]. 此外, 已有研究指出, 不同重金属元素在被挺水植物吸收的过程中存在相互作用[5-6,22], 但是浮床种植是否会影响植物吸收重金属的相互作用却鲜有报道. 因此, 本文拟在已有研究的基础上, 通过在边滩种植和浮床种植两种条件下对挺水植物中重金属赋存特征的对比分析, 探究浮床种植对挺水植物中重金属赋存的影响, 为浮床技术的进一步推广应用提供科学依据.
1 材料与方法
1.1 区域概况
研究区域位于上海市金泽水库. 金泽水库位于上海市青浦区金泽镇西部, 太浦河北岸, 以太浦河为引水水源, 占地面积约2.7 km2[23], 于2017年建成并投入使用. 金泽水库总库容约 9.1 × 106m3, 应急备用库容约5.25 × 106m3[24], 是上海市重要水源地. 该区域属于亚热带季风性气候区, 全年四季分明, 降水充沛, 光照充足, 年平均气温为15.5℃, 年平均降水量约为1177 mm[25]. 近年来, 金泽水库上游的太浦河来水水质总体较好, 多年月均值满足《地表水环境质量标准》 (GB3838—2002) 中Ⅱ类水质标准[24]. 由于金泽水库整体面积不大, 且水体具有很强的流动性, 不同区域的水质差异较小, 库岸区域的土壤质地也基本一致[26].
作为新建水库和重要水源地, 其库岸边滩底质为较清洁的客土, 其上栽种芦苇 (Phragmite australis)、旱 伞 草 (Cyperus alternifolius)、美 人 蕉 (Canna indica)、鸢 尾 (Iris tectorum)、水 葱(Scirpus validus) 等挺水植物. 水库中的浮床主要种植旱伞草 (Cyperus alternifolius)、美人蕉 (Canna indica)、鸢尾 (Iris tectorum) 等四季常绿植物. 边滩和浮床植物于2017年初开始种植, 两者种植密度相近, 例如, 旱伞草种植密度约为112 ~ 120株/m2, 美人蕉、鸢尾种植密度约为40 ~ 52株/m2. 本文选择金泽水库边滩和浮床共有的3种挺水植物—旱伞草、美人蕉、鸢尾开展对比分析. 以往研究发现, Fe、Cu、Zn等重金属元素可能会对金泽水库水质具有潜在影响[27]; 而重金属Cd、Pb、Cr是环境中重要的有毒有害污染物, 易与水体中N、P等有机污染物结合造成水体复合污染[28]. 所以, 对重金属Cu、Zn、Fe、Cr、Cd、Pb的研究是十分必要的.
1.2 站点布设与样品采集
1.2.1 站点布设
现场实验样品的采集于2017年12月进行, 12月属于3种植物的非生长季, 生物量相对稳定. 在金泽水库边滩设置采样站点JC1—JC4; 在水库浮床设置4个采样站点, 均位于同一块浮床中, 分别为F1—F4, 如图1所示. 每个站点、每种植物设置2个50 cm × 50 cm的样方, 齐地割取样方内所有植物地上部分, 将所有样品带回实验室, 进行生物量与重金属含量的测定.

图1 金泽库区采样点位置分布Fig. 1 Location of sampling sites in Jinze Reservoir
1.2.2 样品采集与处理
采集的植物样品先用自来水将表面的泥土等杂物冲洗干净, 再用Milli-Q水冲洗3遍, 沥去水分,于60℃下烘干至恒重, 称重获取植物干重, 即生物量 (g/m2); 将植物剪成小段, 后磨成粉末, 过 100目筛; 每个样品称取0.10 g, 经过硫酸-过氧化氢消解[26], 定容. 然后再采用石墨炉原子吸收法测定重金属Cr、Cd的含量, 采用电感耦合等离子发射光谱仪 (ICP-AES) 测定重金属Cu、Zn、Fe、Pb的含量[6],每个样品重复测定3次.
1.2.3 数据处理与分析
植物样品中重金属赋存量计算公式:
式中:ML代表重金属赋存量 (mg/m2),c代表重金属元素的含量 (mg/kg),M代表样方中植物的生物量 (kg),S代表样方面积 (m2).
采用统计软件包IBM SPSS Statistics 22对数据进行方差齐性检验, 不具备方差齐性的数据需转化后再进行分析. 采用单因素方差分析 (one-way ANOVA) 对不同植物生物量及重金属Cu、Zn、Fe、Cr、Pb、Cd赋存量差异进行显著性检验, 以p< 0.05表示显著差异,p< 0.01表示极显著差异, 再选用最小显著差 (least significant difference, LSD) 进行多重比较[26]. 采用Spearman相关性分析检验同种植物不同重金属元素赋存量的相关关系. 作图在软件Origin 2019中完成.
2 结果与分析
2.1 植物生物量
不同种植条件下, 旱伞草、美人蕉、鸢尾的生物量特征如图2所示. 美人蕉和鸢尾的生物量在浮床种植条件下显著大于边滩种植 (p< 0.05), 而旱伞草生物量在浮床种植条件下则明显小于边滩种植(p< 0.05).
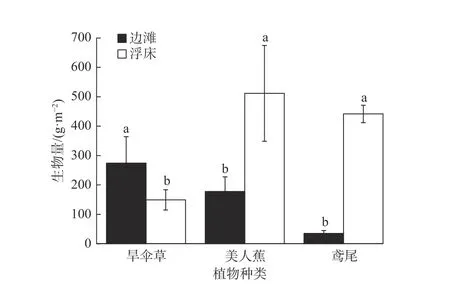
图2 边滩种植和浮床种植条件下的生物量特征 (均值±标准误)Fig. 2 Biomass of different hydrophyte species with bankside planting and floating-bed planting (mean ± SE)
2.2 重金属含量
不同种植条件下, 旱伞草、美人蕉、鸢尾中重金属含量特征如图3所示. 浮床种植的旱伞草、美人蕉、鸢尾中重金属Cu含量均显著高于边滩种植 (p< 0.05) (图3(a)). 旱伞草、鸢尾中Zn含量在浮床种植条件下均显著高于边滩种植 (p< 0.05), 而美人蕉的Zn含量在不同种植方式下无显著差异 (p>0.05) (图3(b)). 美人蕉中Fe含量在浮床种植时显著高于边滩种植 (p< 0.05), 而在不同种植条件下,旱伞草、鸢尾中Fe含量无明显差异 (p> 0.05) (图3(c)). 旱伞草、美人蕉、鸢尾中重金属Cr含量在不同种植方式下均无显著差异 (p> 0.05) (图3(d)). 旱伞草、鸢尾中Cd含量在浮床种植条件下均显著高于边滩种植 (p< 0.05), 而美人蕉中Cd含量在不同种植条件下无显著差异 (p> 0.05) (图3(e)). 美人蕉中Pb含量在浮床种植条件下显著高于边滩种植 (p< 0.05), 而旱伞草、鸢尾中Pb含量在不同种植条件下无显著差异 (p> 0.05) (图3(f)).

图3 边滩种植和浮床种植条件下的重金属含量特征 (均值±标准误)Fig. 3 Heavy metal content for different hydrophyte species with bankside planting and floating-bed planting(mean ± SE)
2.3 重金属赋存量
不同种植条件下, 旱伞草、美人蕉、鸢尾的重金属赋存量特征如图4所示. 浮床种植条件下美人蕉、鸢尾中重金属Cu赋存量均显著高于边滩种植 (p< 0.05), 不同种植方式下旱伞草中Cu赋存量无显著差异 (p> 0.05) (图4(a)). 浮床种植条件下鸢尾中重金属Zn赋存量显著高于边滩种植 (p<0.05), 不同种植条件下美人蕉、旱伞草中重金属Zn赋存量均无显著差异 (p> 0.05) (图4(b)). 浮床种植条件下美人蕉、鸢尾中重金属Fe赋存量均显著高于边滩种植 (p< 0.05), 不同种植条件下旱伞草中重金属Fe赋存量无显著差异 (p> 0.05) (图4(c)). 不同种植条件下旱伞草、美人蕉、鸢尾的重金属Cr赋存量均无显著差异 (p> 0.05) (图4(d)). 浮床种植条件下旱伞草、美人蕉、鸢尾的重金属Cd赋存量均显著高于边滩种植 (p< 0.05) (图4(e)). 浮床种植条件下美人蕉、鸢尾中重金属Pb赋存量均显著高于边滩种植 (p< 0.05), 不同种植条件下旱伞草中重金属Pb赋存量均无显著差异 (p> 0.05)(图4(f)).

图4 边滩种植和浮床种植条件下的重金属赋存量特征 (均值±标准误)Fig. 4 Retention of heavy metals for different hydrophyte species with bankside planting and floating-bed planting(mean ± SE)
几种植物中重金属赋存量的相关关系在不同种植条件下有所差异 (表1—3). 旱伞草中重金属赋存量的相关分析结果如表1所示. 边滩种植条件下, 几乎所有被测重金属元素两两之间呈显著正相关(p< 0.05), Pb-Cu、Pb-Zn、Pb-Fe、Pb-Cr、Fe-Zn、Fe-Cr、Cu-Zn之间呈极显著正相关 (p< 0.01), 而Cr-Cd之间无显著相关关系 (p> 0.05); 浮床种植条件下, Cu-Cd呈极显著负相关 (p< 0.01), Zn-Fe之间呈极显著正相关 (p< 0.01), 其余重金属元素两两之间无显著相关关系 (p> 0.05).

表1 旱伞草边滩 (浮床) 条件下重金属赋存量相关分析Tab. 1 Spearman rank correlation between the retention of heavy metals by Cyperus alternifolius on the bankside(in the floating bed)
美人蕉中重金属赋存量的相关分析结果如表2所示. 边滩种植条件下, Cu、Zn、Fe、Cr两两之间均呈显著正相关 (p< 0.05), Cd、Pb与其他被测重金属元素之间无显著相关关系 (p> 0.05); 浮床种植条件下, Cu与其他被测重金属元素之间均呈极显著正相关 (p< 0.01), Pb与其他被测重金属元素之间均呈显著正相关 (p< 0.05), Cd-Fe、Cd-Cr之间呈现极显著正相关 (p< 0.01), Fe-Cr之间呈现极显著正相关 (p< 0.01), 其余重金属元素两两之间无显著相关关系 (p> 0.05).

表2 美人蕉边滩 (浮床) 条件下重金属赋存量相关分析Tab. 2 Spearman rank correlation between the retention of heavy metals by Canna indica on the bankside(in the floating bed)
鸢尾中重金属赋存量的相关分析结果如表3所示. 边滩种植条件下, Cu-Zn、Cr-Pb之间存在显著正相关 (p< 0.05), 其余被测重金属两两之间没有显著相关关系 (p> 0.05). 浮床种植条件下, Fe与所有被测重金属之间存在显著正相关 (p< 0.05), Pb与除Cr以外的所有被测重金属呈显著正相关 (p<0.05); Cu-Zn之间呈极显著正相关 (p< 0.01), Cu-Cd之间呈显著正相关 (p< 0.05), 除Fe、Pb外, 其余被测重金属元素之间无显著相关关系 (p> 0.05).

表3 鸢尾边滩 (浮床) 条件下重金属赋存量相关分析Tab. 3 Spearman rank correlation between the retention of heavy metals by Iris tectorum on the bankside(in the floating bed)
3 讨论
3.1 不同种植条件下重金属赋存特征的差异及影响因素
以往研究发现, 浮床种植相比边滩种植能显著提高植物生物量. 例如, 蒋跃等[29]将美人蕉等植物从土壤移栽到浮床上后, 发现植物生物量显著升高; 温奋翔等[30]将鸢尾等植物从土壤移栽到生态浮床上4个月后, 发现植物生物量显著增加. 有些研究指出, 浮床种植时植物根基能纵向、横向自由快速生长, 可以一定程度地减少传统种植方式对植物生长的约束, 使植物生物量得以增加[29]. 本文研究表明,浮床种植的美人蕉、鸢尾生物量明显大于边滩种植的生物量, 这与已有研究结果一致. 汤迪娟[31]将旱伞草植株从土壤移栽至生态浮床后, 发现旱伞草生物量的增长较为缓慢且显著低于美人蕉等植株. 李丽等[32]研究表明, 浮床种植的旱伞草相对生长速率为0.074 d–1, 而美人蕉为0.095 d–1. 本文中, 旱伞草的生物量在浮床种植条件下较边滩种植低, 且低于浮床种植的美人蕉生物量, 这与已有研究结果相似.
已有研究指出, 与植物的生长能力相比, 植物自身对重金属的吸收积累能力对重金属赋存量的影响同样重要[33]. 本文研究结果中, 美人蕉、鸢尾在浮床种植时部分重金属含量高于边滩种植, 表明生态浮床能够一定程度提高植物对重金属的吸收能力. 以往研究认为, 根系的淹水条件对植物重金属吸收能力具有重要影响, 浮床植物根系直接与水体接触, 浮床植物根系对重金属元素的吸收作用可能比沉积物中的植物根系更强[34]. 本研究中, 边滩种植的植物生长在水库岸边土壤中, 植物根系间歇性被水淹没; 而浮床植物一直生长在水中, 植物根系持续被水淹没, 这可能是浮床种植提高了植物对重金属吸收能力的重要原因. 另一方面, 从已有研究来看, 水体和沉积物中能够被植物吸收的重金属含量可能存在的差异, 也会对植物重金属含量产生影响[35-37], 未来需要做进一步的监测分析. 植物体内的重金属赋存量与植物生长特征、重金属吸收能力密切相关[38]. 本文中, 浮床种植条件下美人蕉、鸢尾中的重金属赋存量总体上大于边滩种植条件下重金属赋存量, 这表明, 浮床种植能够在一定程度上提高挺水植物对重金属的赋存能力.
从本文研究结果来看, 浮床种植对挺水植物重金属赋存能力的改善主要基于对植物生长状况和植物重金属吸收能力的提升. 以往研究中, 浮床种植提高挺水植物重金属赋存量的两种方式也普遍存在. 例如, 王谦等[12]研究表明, 水生植物对重金属的去除效率与植物生物量密切相关, 适当增大植物生物量时, 重金属去除效率明显提高; 而廖晓勇等[39]则提出, 超富集植物可以从环境中大量吸收重金属,植物修复技术可以通过采用超富集植物吸收重金属来提升重金属去除效率, 说明植物吸收重金属的能力高低是影响重金属去除能力的重要因素. 从现有研究结果来看, 浮床种植条件下, 美人蕉与鸢尾的生物量与重金属赋存量均得到了明显的提升. 因此, 这两种植物可以作为重要的工程物种, 在生态浮床建设中优先考虑.
3.2 不同种植条件对挺水植物重金属相互作用的影响
已有研究指出, 植物吸收重金属过程中不同重金属元素可能存在相互作用[40]. 且有研究认为, 重金属元素的相互作用与重金属元素自身结构及化学性质具有一定的关系. 例如, Cd与Zn的核外电子构型相似, 两者的化学性质及生物行为具有相似性, 所以自然界中Cd一般与Zn共生[41], 植物对两者的吸收可能表现出明显的相关关系. 本文研究结果表明, 浮床种植与边滩种植条件下重金属元素的相互作用普遍存在, 但不同种植条件下重金属的相互作用具有明显差别. 例如, 浮床种植时的美人蕉中Cd-Zn含量之间表现出显著正相关, 但在边滩种植时则无显著相关性; 而旱伞草在浮床种植时的Cd-Zn含量之间无明显相关关系, 但在边滩种植时存在明显的相关性. 这可能与浮床种植改变了植物的生长环境有关[42], 而与核外电子构型的相似关系并不明显. 一些研究指出, 在植物吸收重金属的过程中, 重金属的浓度对重金属元素的相互作用有重要影响[43-44]. 王丽香等[44]发现, 人为施加低浓度Cd可促进花生对Fe、Zn的吸收, 但高浓度Cd会抑制其对Fe、Zn的吸收. 傅桂平等[45]研究发现, 人为加锌量小于25 mg·kg–1时能促进油菜对Cd的吸收, 人为加锌量超过25 mg·kg–1时会抑制其对Cd的吸收.此外, 营养元素浓度也会影响重金属元素的相互作用[46-47]. 本文中, 浮床种植和边滩种植建立在水体与沉积物两种不同的环境介质中, 其对应的氮、磷含量不尽相同. 张慧等[41]研究发现, 磷也可能会对重金属交互作用产生影响, 环境中高浓度的Zn与Cd使植物在吸收过程中产生拮抗作用, 适当地增加磷浓度可以促进植物对Cd的吸收, 从而减轻Zn与Cd的拮抗作用. Huang等[47]发现, 土壤中适当地增加磷浓度会增加东南景天对Zn的吸收, 但会抑制其对Cd的吸收. Wang等[46]发现, 在富营养化的水域, 环境中的营养元素(如氮、磷)在一定程度上改变了植物对重金属的吸收, 从而影响了重金属间的相互作用. 因此, 浮床种植对挺水植物重金属赋存特征的影响存在多种影响因子, 其相互作用机理需在长期监测的基础上, 综合植物生长特征、环境条件等多种影响因素进行系统的综合分析.
4 结论
浮床种植能在一定程度上促进挺水植物的生长, 提高其对重金属的吸收能力, 进而对挺水植物重金属赋存特征产生重要影响. 这种影响可能与不同种植条件下的根系淹水状况及重金属元素的环境浓度等条件有关. 边滩植物对重金属的吸收能力是有限的, 而生态浮床位于水库中央, 可以更全面地对水体污染物进行生物吸收, 为多方面提升水库的供水安全提供了保障. 未来需在长期监测的基础上,综合植物生长特征、环境条件等多种影响因素进行系统的综合分析.

