大黄素纳米载药系统逆转人胆囊癌细胞上皮-间充质转化的可行性研究
达选博,张诚,项雨凯,胡海,何川崎,孔祥余,邱晨,吕贝宁,张红雷,王玉彬,杨玉龙
(同济大学附属东方医院 胆石中心,上海 200120)
大量研究证明中空介孔硅(HMSNs)具有许多吸引人的特性,例如良好的生物相容性、孔体积大、可控释放行为(存在于介孔壳中的通道)和高负载效率(大的空心核),作为药物载体显示出巨大的潜力[1-3]。大黄素(Emodin,EMO)是一种很有前途的天然物质,以其抗氧化、抗炎、抗菌和抗癌功能而闻名[4-5],该化合物是从掌叶大黄、大黄等中草药中分离得到的,但是其低生物利用度,限制了EMO的应用。本研究通过制备负载大黄素的中空介孔硅载药微粒(EMOHMSNs),在体外实验中探讨人胆囊癌细胞(NOZ)对载药微粒的摄取效率以及逆转其上皮-间充质转化(epithelial-mesenchymal transition,EMT)的能力,构建一个更好地传递大黄素的系统。
1 材料和方法
1.1 材料
NOZ来自于上海交通大学附属瑞金医院肝胆外科刘颖斌团队赠与。氨丙基三乙氧基硅烷(APTES,≥98%),十六烷基三甲基溴化铵(CTAB,98%),正硅酸四乙酯(TEOS),乙醇(ethanol,分析纯),浓盐酸(37% HCl),浓氨水(37%~38% NH3·H2O)购自国药集团;BCA试剂盒,异硫氰酸荧光素(FITC,≥90%)购自上海碧云天生物技术研究所;E-钙黏蛋白(E-cadherin)、N钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)鼠抗人单克隆抗体购自美国Santa Cruz公司;转化生长因子β1(TGF-β1)购自美国Selleck公司;EMO购自MCE公司。
1.2 EMO-HMSNs的制备与表征
以实心二氧化硅(sSiO2)纳米颗粒为硬球模板,选择性地刻蚀去除硬球模板,进而得到HMSNs。(1)用Stöber法[6]合成sSiO2纳米颗粒:100 mL乙醇、8 mL水和4 mL浓氨水混合后加入3 mL TEOS,在30 ℃水浴条件下搅拌6 h。(2)形成介孔硅(mSiO2)包被sSiO2的核壳结构(sSiO2@mSiO2)纳米颗粒:混合220 mL水、10 mL乙醇和1 200 mg CTAB,把上一步得到的sSiO2纳米颗粒加入混合液中,搅拌30 min后,加入1.0 mL TEOS,30 ℃水浴条件下过夜。(3)将上述溶液离心,分散到150 mL浓度为0.4 mol/L的Na2CO3溶液中,在50 ℃条件下反应2 h[7],反应结束后离心,在超声的协助下用HCl/Ethanol[8-9]溶液和水分别洗三次,即可得到HMSNs。
加入0.5 mL浓度为2 mg/mL的FITC乙醇溶液,在避光条件下摇床上室温反应24 h制备FITCHMSNs。将EMO溶解在20 mL HMSNs无水乙醇中超声30 min,然后搅拌过夜,离心,水洗除去游离的药物EMO,冻干后使用。
扫描电子显微镜(SEM)观察HMSNs的表观形态和粒径大小;透射电子显微镜(TEM)观察HMSNs的表观形态和孔道结构;动态光散射(DLS)测定HMSNs电势和粒径大小;紫外分光光度计定量EMO-HMSNs载药率、包封率。用紫外分光光度计测定吸光度,以EMO浓度为横坐标,吸光值为纵坐标,绘制出EMO的标准曲线。
1.3 NOZ的培养
DMEM培养基(10%胎牛血清)常规培养,温度37 ℃、5% CO2,饱和湿度。
1.4 CCK8实验检测细胞存活率
以5.0×103/孔的密度接种NOZ细胞于96 孔板,实验组细胞用不同浓度的HMSNs(0、50、150、300、500 μg/mL)处理,24 h后加入CCK8 溶液10 μL/孔,继续孵育1 h后,酶联免疫检测仪上以波长450 nm测各孔吸光度(OA)值,计算细胞存活率。
1.5 细胞摄取实验检测纳米粒子在细胞内的分布
取细胞爬玻片置于24孔细胞培养板内,将对数生长期细胞NOZ细胞系接种于24 孔板中(500 μL,2×105个/mL),置于恒温培养箱中过夜,加入1 mL浓度为20 μg/mL HMSNs-FITC纳米颗粒溶液,分别孵育不同时间(1、6 h)后,用Hoescht 33342 和Dil(细胞膜红色荧光探针)分别染细胞核和细胞膜后,4%多聚甲醛固定,封片,用激光共聚焦显微镜检测纳米粒子在细胞内的分布。
1.6 流式细胞仪检测细胞内纳米颗粒的荧光强度
将对数生长期NOZ细胞以106个/mL密度接种于细胞培养6 孔板中,加入1 mL浓度为20 μg/mL HMSNs-FITC纳米粒溶液,分别孵育不同时间(1、6 h)后,将细胞重悬于500 μL的PBS溶液中上机检测。
1.7 Transwell实验检测细胞的迁移性
将2.0×105个NOZ细胞接种于小室上室面,下室加入完全培养基,待细胞贴壁后将上下室培养液换成TGF-β1,TGF-β1+EMO,TGF-β1+EMOHMSNs的完全培养基分别作用24 h后取出,用棉签轻轻擦掉上室细胞,于4%多聚甲醛中固定,1%结晶紫染色,倒置显微镜下200倍观察细胞,每个样本随机取10个视野取均值。
1.8 Western blotting检测相关蛋白表达水平
NOZ细胞经过TGF-β1,TGF-β1+EMO,TGFβ1+EMO-HMSNs处理24 h后,收集细胞,提取总蛋白。用BCA蛋白浓度测定试剂盒检测E-cadherin、Ncadherin、Vimentin蛋白浓度。蛋白上样量为40 μg,进行聚丙烯酰胺凝胶电泳。孵育一抗、二抗后化学发光成像仪获取图片。
1.9 统计学分析
采用IBM SPSS 22.0软件进行统计学分析,均表示为()。两组间比较用t检验分析,多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 EMO-HMSNs的表征结果
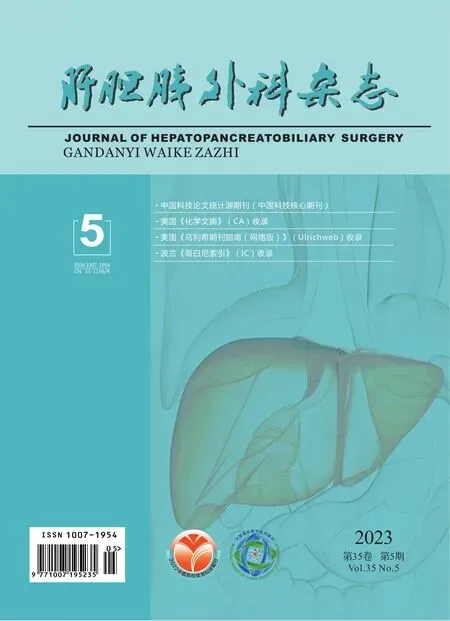
用三步法制备了单分散的HMSNs。SEM结果表明,HMSNs粒径均一,直径约为100 nm(图1A);TEM结果表明HMSNs为球形结构,具有较大空腔(图1B)。DLS表明纳米粒子的粒径约为201 nm、表面电位(zeta电位)27.29 mV,如图1C和D所示。紫外分光光度计定量EMO-HMSNs载药率(48.53±1.25)%,包封率(20.12±0.23)%,稳定性良好。
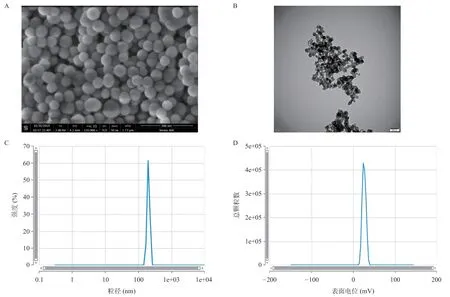
图1 HMSNs形貌表征
2.2 生物安全性评价
利用CCK8试剂盒对HMSNs的细胞毒性进行检测。NOZ细胞系分别与不同浓度的HMSNs共孵育24 h,NOZ细胞在HMSNs 500 μg/mL的高浓度下存活率超过85%,表明HMSN纳米粒子对后续的实验研究不会产生影响,实验结果如图2所示。
图2 与不同浓度的HMSNs共孵育24 h后NOZ细胞的存活率,**P<0.01,***P<0.001
2.3 体外细胞摄取HMSNs
激光共聚焦显微镜观察NOZ细胞摄取HMSNs,结果表明NOZ细胞可以摄取HMSNs,并且随着时间的延长,摄取的HMSNs会增多,6 h后细胞内荧光强度明显强于1 h。如图3A所示。流式检测结果与激光共聚焦显微镜观察结果一致,并对NOZ细胞摄取HMSNs进行量化对比。如图3B所示,NOZ细胞摄取HMSNs随时间延长而增多。
2.4 细胞的迁移性
Transwell实验观察细胞迁移性改变:空白对照组为(5.20±0.55)个,TGF-β1 组为(30.56±2.32)个,TGF-β1+EMO组为(23.27±1.67)个,TGF-β1+EMO-HMSNs组为(11.50±0.65)个。与空白对照组比较,TGF-β1组细胞数目明显增多(P<0.001);与TGF-β1组和TGF-β1+EMO组比较,TGF-β1+EMOHMSNs组细胞数目减少最为显著(P<0.001)。结果表明大黄素载药微粒对胆囊癌NOZ细胞的迁移能力有显著抑制作用。见图4。
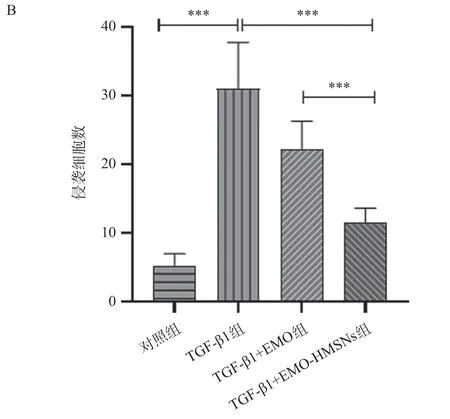
图4 各组对NOZ细胞迁移能力的影响(×200)
2.5 EMT相关蛋白表达水平的影响
各组作用NOZ细胞48 h后,分别对E-cadherin、N-cadherin、Vimentin蛋白的表达水平进行单独比较后结果显示,其E-cadherin蛋白表达水平在TGF-β1+EMO-HMSNs组与Control组、TGF-β1组、TGF-β1+EMO组比较有差异有统计学意义(P<0.05);其Ncadherin蛋白表达水平在TGF-β1+EMO-HMSNs组与TGF-β1组、TGF-β1+EMO组比较,差异有统计学意义(P<0.05);其Vimentin蛋白表达水平在TGF-β1+EMO-HMSNs组与Control组、TGF-β1组、TGF-β1+EMO组比较,差异有统计学意义(P<0.05)。N-cadherin在TGF-β1组与空白对照组比较差异均有统计学意义(P=0.0046)。结果表明TGF-β1通过TGFβ-Smad通路作用于下游相关因子N-cadherin、E-cadherin、Vimentin,使其在蛋白水平呈相应变化,而这种促进蛋白表达水平变化的作用能够被EMO-HMSNs显著抑制。见图5。
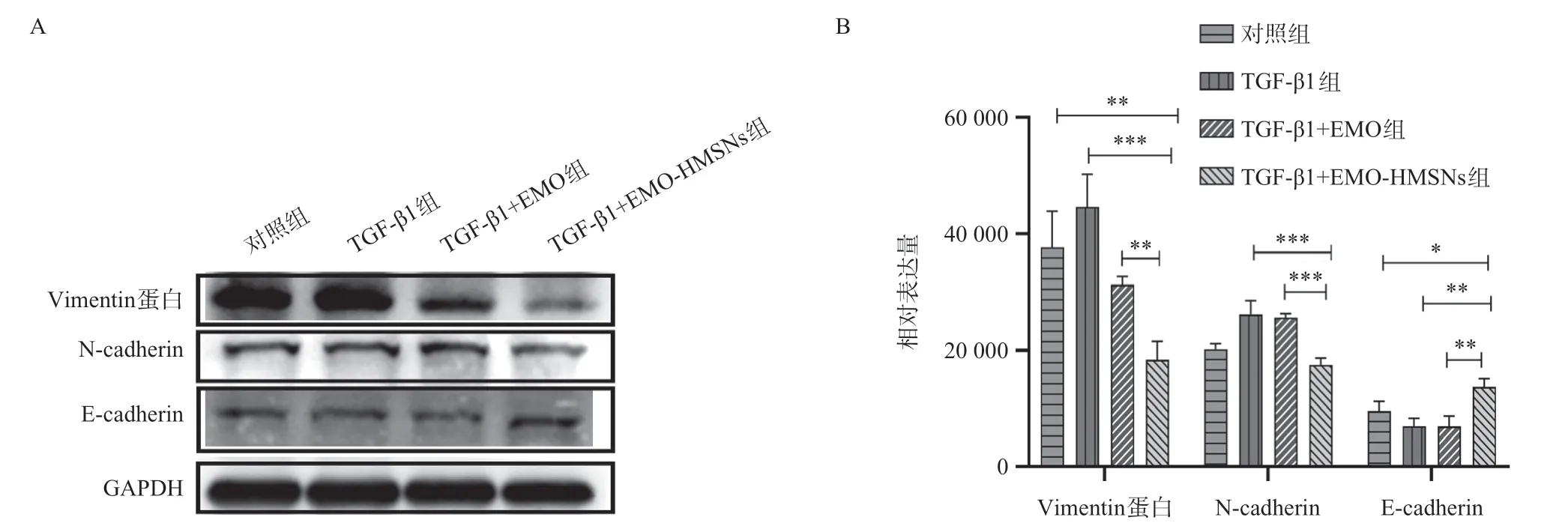
图5 E-cadherin、N-cadherin、Vimentin蛋白的表达水平
3 讨论
EMO作为一种植物化学物质,由于其多靶点活性和缺乏实质性毒性,在癌症治疗中发挥着特殊作用。EMO可通过下调β-catenin和Vimentin的活性,上调E-cadherin的表达水平,从而抑制癌细胞的迁移和侵袭能力[10-12]。此外有研究报道,EMO可能通过阻断Wnt通路预防EMT以及具有抗血管生成和抗转移作用的可能分子机制[13]。但是,EMO的药代动力学参数较差,严重影响其生物利用度和生物活性,限制了其在临床中的应用。
为了克服人体中天然化合物的低生物利用度和EMO疏水性限制。纳米药物载体如纳米粒子、纳米纤维、纳米传递体和纳米乳液已经被研究用于药物递送[14-16]。HMSNs是一种良好的的药物递送载体系统,具备良好的生物可降解性和大孔体积[17]。在本研究中我们成功制备了粒径均一、具有中空结构的HMSNs,其具备良好的生物相容性和胆囊癌被动靶向性,构建了一个更好地递送EMO的系统。
安全有效和细胞摄取是载药纳米递送系统发挥靶向作用和治疗作用的基石。CCK8 实验表明纳米颗粒具有良好的生物安全性。采用激光共聚焦显微镜和流式细胞仪评估了NOZ细胞中HMSNs的摄取,结果显示随着时间延长,细胞内纳米颗粒积累增多。以上结果表明本研究制备的纳米颗粒可以进行下一步的体外细胞实验。
Transwell实验结果及Western blotting研究结果显示,经纳米载药颗粒处理48 h后,EMO被载药微粒成功递送胆囊癌细胞并进入细胞质中,显示出良好的抑制胆囊癌细胞EMT的效用。相较于EMO,EMO-HMSNs由于其纳米级别的微小性质以及中空结构,常规体积下能够负载更多的EMO,能克服EMO疏水性限制,抗肿瘤作用显著高于游离EMO,可作为良好的药物载体。
总之,本研究建立了一种新的纳米递送系统,名为EMO-HMSNs,可有效解决EMO疏水性问题,通过胞吞作用进入细胞质释放药物,显著抑制胆囊癌细胞的迁移能力,但其潜在的肿瘤局部给药体内试验尚有待进一步研究。