肝门部胆管癌根治性切除术后教科书式结局发生的预测因素分析
蒋弟,陈诚,刘智鹏,王子然,刘雲华,刘兴超,樊海宁,白洁,江艳,陈志宇
(1.陆军军医大学第一附属医院/西南医院 全军肝胆外科研究所/肝胆外科,重庆 400038;2.解放军联勤保障部队第九〇三医院 普通外科,浙江 杭州 310007;3.四川省人民医院 肝胆外科,四川 成都 610072;4.青海大学附属医院 肝胆外科,青海 西宁 810012)
肝门部胆管癌(perihilar cholangiocarcinoma,pCCA)是一种起源于肝外胆管近端的高侵袭性胆道肿瘤,约占所有胆道肿瘤的60%[1-2]。外科切除是唯一可能根治pCCA的方法[3]。然而,由于pCCA的外科切除术极为复杂,患者的短期预后极不理想,围手术期病死率和并发症发生率分别为3%~15%和44%~57%[4-6]。有效合理的术前及手术评估可以帮助外科医师做出更好的临床决策[7]。传统意义上,术后并发症、围手术期死亡、围手术期输血、住院时间等指标被用于评价外科手术质量。然而,这些单一指标并不能反映手术治疗及术后管理的全貌[8-10]。教科书式结局(textbook outcome,TO)作为一个综合性的指标,能够以患者为中心更好地评估接受外科手术患者的短期预后。目前,TO已被应用于评估多种消化道道肿瘤的短期预后,例如胃癌、肝癌等[11-16]。然而,国内外尚未有研究对pCCA根治性切除术后患者实现TO进行分析。基于此,本研究采用回顾性分析的方法,收集三个肝胆中心接受pCCA根治性切除术患者的病例资料,分析患者术后实现TO的独立预测因素。
1 资料和方法
1.1 一般资料
本研究回顾性收集陆军军医大学第一附属医院、四川省人民医院以及青海大学附属医院2013年5 月至2019 年5 月收治的316 例接受根治性切除术的pCCA患者的临床和病理资料。其中男210例,女106例;平均年龄(58.1±8.6)岁(38~81岁)。若肿瘤侵犯了临近大血管,例如肝动脉和(或)门静脉,则在根治性切除术中需加入血管重建术。
1.2 病例纳入标准与排除标准
纳入标准:(1)术后病理检查结果确定为pCCA;(2)接受根治性切除术,即完全切除所有肉眼可见的肿瘤,包括肝切除术、肝外胆管切除术、胆肠吻合术和淋巴结清扫术。
排除标准:(1)年龄<18岁;(2)肝切除术中伴随其他手术;(3)缺失重要变量;(4)复发性pCCA;(5)接受姑息性治疗;(6)接受腹腔镜或机器人切除术;(7)术前接受新辅助治疗或术后接受辅助治疗。
1.3 TO的定义
本研究中,TO根据既往报道的与pCCA切除术后患者最理想预后相关的6个指标进行定义:(1)无术后30 d内并发症;(2)无延长的住院时间;(3)无围手术期输血;(4)阴性切缘;(5)无术后30 d内死亡;(6)无术后30 d内再入院。术后并发症包括:肝切除术后肝功能衰竭、胆漏、胸腔积液、腹水、血液感染、肺部感染、手术部位感染、胃排空延迟、肠漏等[17]。无延长的住院时间定义为住院时间≤分析队列的75%。阴性切缘定义为完全切除所有肿瘤,即在肉眼和显微镜下切缘均无残余的肿瘤细胞。根据术后是否实现TO将316例患者分为TO组(n=79)和非TO组(n=237)。
1.4 观察变量及其评价标准
1.4.1 观察变量:(1)两组患者临床资料:人口统计学特征、术前1周的实验室变量、术后病理变量、手术变量等;(2)根据既往研究结果[12,18-19],回顾性收集患者的21 个指标,研究其与pCCA根治性切除术后患者实现TO的潜在关系,包括:性别、年龄、ASA评分、肝胆管结石、术前黄疸、术前引流、术前合并症、吸烟史、饮酒史、谷丙转氨酶、谷草转氨酶、CA199、肝硬化、肿瘤浸润范围、大血管侵犯、微血管侵犯、周围神经侵犯、分化状态、淋巴结转移、肝切除范围、第八版AJCC(American Joint Committee on Cancer)分期。
1.4.2 评价标准:(1)术前黄疸定义为术前胆红素水平高于正常值的两倍(总胆红素>2 mg/dL);(2)术前合并症包括高血压、糖尿病、脑血管疾病、冠心病等慢性疾病;(3)肝切除范围分为大部分肝切除(切除3个及以上Couinaud肝段)和小部分肝切除(切除3个以下Couinaud肝段);(4)大血管侵犯包括门静脉侵犯、肝动脉侵犯和门静脉癌栓;(5)病理变量,包括肝硬化、肿瘤浸润范围、大血管侵犯、微血管侵犯、周围神经侵犯、分化状态和淋巴结转移,均依据术后病理检查结果证实。
1.5 统计学分析
应用IBM SPSS 26.0统计软件进行数据分析。符合正态分布的计量资料以()表示,不符合正态分布的计量资料以中位数(四分位数)表示,两组间比较分别采用Student’st检验和Mann-WhitneyU检验。分类变量用频率或比例表示,两组间比较采用χ2检验或Fisher确切概率法检验。比较TO组和非TO组的基线资料,将基线资料比较中P<0.10的变量,再排除强共线性变量后,其余变量纳入Logistic回归模型,分析与pCCA患者接受根治性切除术后实现TO的独立预测因素。Logistic回归分析结果以风险比和95%可信区间展示。P<0.05为差异具有统计学意义。
2 结果
2.1 TO分布
本研究共纳入316例患者。在分析队列中,pCCA患者根治性切除术后实现TO率为25.0%(79/316)。分析队列中,患者实现TO的分布情况如下:108 例(34.2%)患者术后30 d无并发症发生,305例(96.5%)患者术后30 d内未发生死亡,300例(94.9%)患者术后30 d内无再入院,190例(60.1%)患者围手术期未输血,282例(89.2%)患者手术切缘为阴性。
2.2 两组患者的基线资料对比
TO组患者的术前黄疸、肿瘤浸润范围、大血管侵犯、淋巴结转移比例均低于非TO组(P<0.05)。TO组患者的肿瘤分期更早(P=0.08)。详见表1。
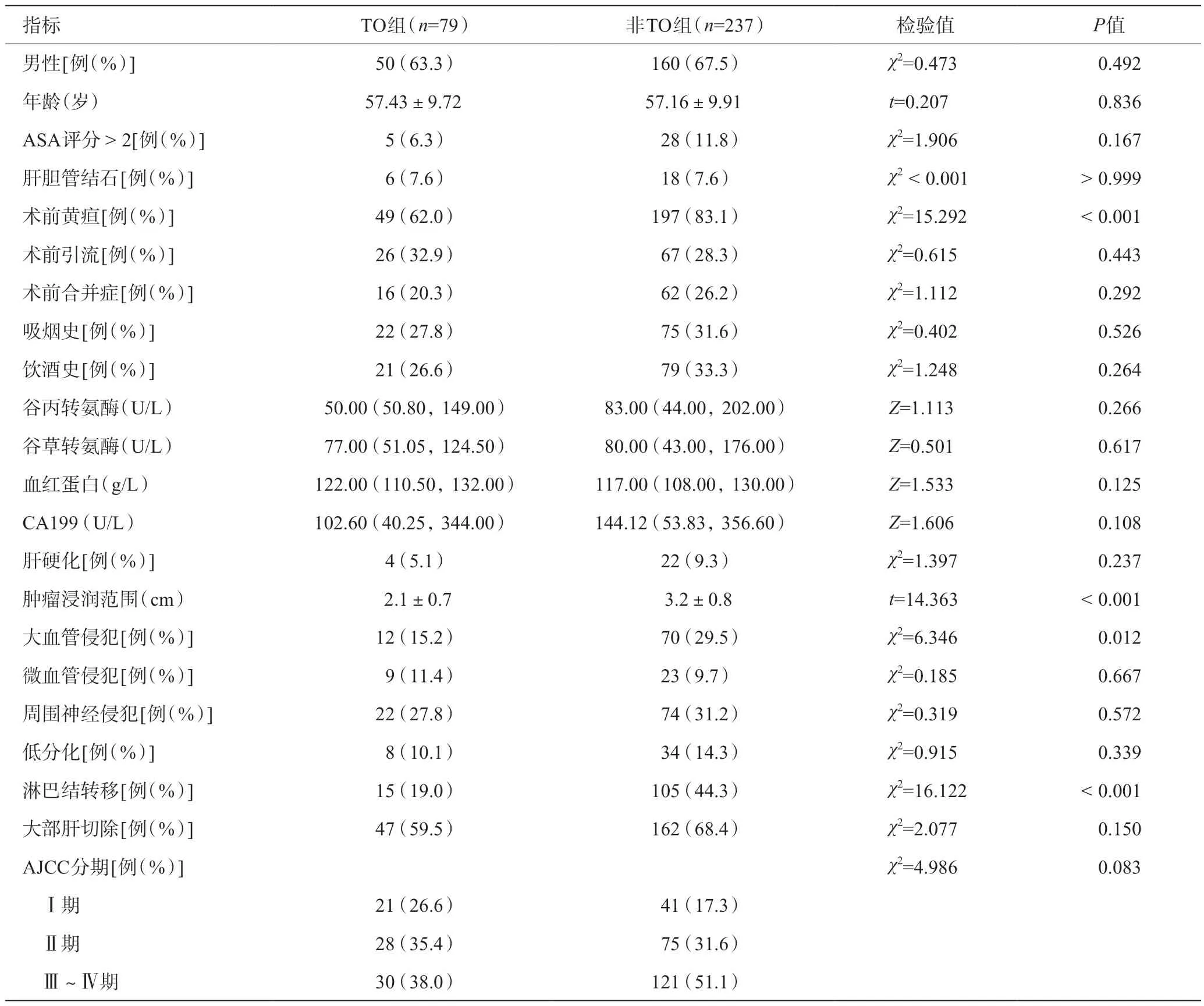
表1 316例pCCA患者的基线资料
2.3 pCCA患者根治性切除术后实现TO的独立预测因素分析
Logistic回归分析结果显示,无术前黄疸、肿瘤浸润范围≤3 cm、无大血管侵犯、无淋巴结转移是影响pCCA患者根治性切除术后实现TO的独立预测因素(P<0.05)。详见表2。

表2 影响TO实现的独立预测因素
3 讨论
近些年,TO的概念在外科学研究中得到了推广与普及,并被广泛应用于评价不同肿瘤外科切除术的手术质量,例如胃癌、肝癌、结肠癌、肝内胆管癌等[18,20]。单一手术结局指标被用来衡量手术和术后管理的质量,包括围手术期并发症发生、围手术期死亡、切缘状态、再入院率、住院时间等[8-10]。但是,这些指标不能反映整个手术治疗和术后管理的多维面。TO综合了6个与短期预后相关的单一手术结局指标,能够对手术和术后管理质量进行整体评价。因此,TO以患者为中心,提供了一个代表患者术后最理想短期预后的综合评价[21]。有时,患者在某项指标上表现良好,但是在另一项指标上表现不佳,这可能会误导医师做出错误的临床决策。TO使用“全或无”的方法,除非患者达到TO包含的所有指标,否则不能达到TO[7,22]。因此,在肿瘤患者的外科治疗中使用TO作为一种衡量短期预后的指标至关重要。
本研究中TO定义为无术后30 d内并发症、无延长的住院时间、无围手术期输血、阴性切缘、无术后30 d内死亡、无术后30 d内再入院。既往研究对于术后死亡率的定义差异很大,一些采用术后30 d内的病死率[18-19],另一些则采用术后90 d内的病死率[20,23]。有研究认为,采用术后30 d内的病死率会导致对根治性切除术后患者的“真实”病死率低估[24]。本研究认为,术后病死率的定义在时间上应与术后并发症发生率和再入院率保持一致。本研究通过分析,“术后30 d内并发症”是导致未实现TO的主要因素,其次是“围手术期输血”和“延长的住院时间”,这与以往的研究是一致的[12,25-26]。
本研究多因素分析表明,无术前黄疸、肿瘤浸润范围≤3 cm、无大血管侵犯、无淋巴结转移是pCCA患者根治性切除术后实现TO的独立预测因素。具体来说,术前黄疸通常提示肝功能恶化,增加术中出血和术后肝功能衰竭的可能。肿瘤越大,提示肝门周围局部浸润的风险也就越大。由于肝门部周围的解剖结构复杂,骨骼化困难,因此需要切除更多的瘤周组织以实现R0切除。对于合并大血管侵犯的患者,需要进行保留侧的血管重建,这无疑会增加手术的风险。淋巴结转移是pCCA最常见的转移方式之一,提示肿瘤已处于晚期,从肿瘤转移的角度出发,认为已经发生淋巴结转移的肿瘤更具有侵袭性。对于外科而言,上述影响因素中唯一可控的是术前黄疸,可通过术前胆道引流降低总胆红素水平得到改善。但目前关于胆道引流的时机、引流持续多久并没有统一标准。未来的研究中,可根据梗阻性黄疸的持续时间、胆红素水平、肿瘤大小和患者的一般情况,综合性分析术前胆道引流的最佳时机和持续时间。
在本项多中心研究中,316例pCCA患者接受了根治性切除术,但是只有79例(25.0%)术后实现了TO。但据一项国际多中心研究显示,接受肝胆胰腺外科手术的病例中有43.9%(5 919/13 467)的患者能够实现TO[27],远高于本研究。造成这种差异的可能原因如下:(1)pCCA发病率相对较低,对pCCA的治疗经验相对较少;(2)pCCA的根治性切除在技术上更为复杂,包括肝脏切除、胆管切除、胆管-空场吻合、区域淋巴结清扫、血管重建等;(3)目前的影像学技术无法对pCCA的可切除性进行充分评估,增加手术结果的不确定性。
本研究存在如下局限。第一,这是一项回顾性研究,数据存在选择偏倚;第二,其他反映营养和炎症的指标,如身体质量指数、中性粒细胞/淋巴细胞、血小板/淋巴细胞未被纳入;第三,这是一项多中心研究,由于地区医疗水平和经济水平不同,可能影响到手术质量和术后护理质量。总之,TO是一个以患者为中心的综合评估指标,本研究显示,仅有四分之一的pCCA根治性切除术患者能够实现TO。无术前黄疸、肿瘤浸润范围≤3 cm、无大血管侵犯、无淋巴结转移是pCCA患者根治性切除术后实现TO的独立预测因素。