补肾活血汤对大鼠腰椎间盘退行性变模型Fas/FasL信号通路的影响
王镇远 冯帅华 李泽湘 罗阳骞 李明洋 蒋佳豪 吴官保
〔摘要〕 目的 探索补肾活血汤对大鼠腰椎间盘退行性变模型脂肪酸合成酶(fatty acid synthase, Fas)/脂肪酸合成酶配体(fatty acid synthase ligand, FasL)信号通路的影响。方法 50只大鼠随机分成空白组、假手术组、补肾活血汤组、腰痹通组、模型组,每组10只。空白组、假手术组、模型组每日10 mL/kg生理盐水灌胃;补肾活血汤组每日28.98 g/kg补肾活血汤灌胃;腰痹通组每日0.34 g/kg腰痹通灌胃,各组均干预4周。干预结束后,取腰椎间盘组织,番红固绿、Masson染色观察病理学变化,免疫组织化学法计算积分光密度(integral optical density, IOD)值,Western bolt检测Fas、FasL蛋白表达水平,RT-PCR检测Fas、FasL mRNA表达水平。结果 空白组、假手术組细胞形态基本正常,细胞核清晰可见;模型组纤维环碎裂明显,纤维环与髓核间中断,结构不清晰,且染色较深;补肾活血汤组纤维环轻度破裂,髓核细胞及空泡数量略有减少,髓核中基质轻度凝结。与空白组比较,模型组Fas、FasL IOD值均明显升高(P<0.01),Fas、FasL蛋白和mRNA表达水平均明显降低(P<0.01)。假手术组与空白组间Fas、FasL IOD值、蛋白和mRNA表达水平比较,差异均无统计学意义(P>0.05)。与模型组比较,补肾活血汤组、腰痹通组Fas、FasL IOD值均明显降低(P<0.01),Fas、FasL蛋白和mRNA表达水平均明显升高(P<0.01)。与腰痹通组比较,补肾活血汤组Fas、FasL IOD值均明显降低(P<0.01),Fas、FasL蛋白和mRNA表达水平均明显升高(P<0.01)。结论 补肾活血汤能够有效治疗因腰椎退行性变对髓核及纤维环造成的损伤,促进相关蛋白的表达,可能与其调控Fas/FasL信号通路相关。
〔关键词〕 补肾活血汤;腰椎退行性变;Fas/FasL信号通路;大鼠;椎间盘;腰痛
〔中图分类号〕R274.9 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.010
Effects of Bushen Huoxue Decoction on Fas/FasL signaling pathway of
lumbar intervertebral disc degeneration rat model
WANG Zhenyuan1, FENG Shuaihua2, LI Zexiang1, LUO Yangqian1, LI Mingyang1, JIANG Jiahao1, WU Guanbao2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Provincial Hospital of Integrated
Chinese and Western Medicine, Changsha, Hunan 410006, China
〔Abstract〕 Objective To study the effects of Bushen Huoxue Decoction (BSHXD) on Fas/FasL signaling pathway of lumbar intervertebral disc degeneration rat model. Methods Fifty rats were randomized into blank group, sham-operated group, BSHXD group, Yaobitong group and model group, with 10 rats in each group. Blank group, sham-operated group and model group were given 10 mL/kg saline by gavage daily; BSHXD group received 28.98 g/kg BSHXD daily by gavage; Yaobitong group was administered with 0.34 g/kg Yaobitong capsule daily by gavage, all groups were intervened for 4 weeks. At the end of the intervention, safranine fast green and Masson staining were used to observe the pathological changes of the lumbar disc tissues, the integral optical density (IOD) values were calculated by immunohistochemistry, Fas and FasL protein expression levels were detected by Western blot and Fas and FasL mRNA expression levels were identified by RT-PCR. Results The cell morphology of specimens in blank and sham-operated groups was normal, and the nuclei were clearly visible; the fibrous rings of model group were obviously fragmented, with interruptions between fibrous rings and nuclei, the structures were not clear, and the staining was quite dark; BSHXD group showed mild rupture of the fibrous rings, a slight decrease in the number of nucleus cells and vacuoles, and mild condensation of the matrix in the nuclei. Compared with blank group, Fas and FasL IOD values were significantly higher (P<0.01) and Fas, FasL protein and mRNA were significantly lower (P<0.01) in model group. The differences in Fas, FasL IOD values, protein and mRNA expression levels between sham-operated group and blank group were not statistically significant (P>0.05). Compared with model group, Fas and FasL IOD values were significantly lower (P<0.01), Fas, Fasl protein and mRNA expression levels were significantly higher (P<0.05). Compared with Yaobitong group, Fas and FasL IOD values were significantly lower (P<0.01), and the expression levels of Fas, FasL proteins and mRNA were significantly higher (P<0.01) in BSHXD group. Conclusion BSHXD can treat the damage to the nucleus pulposus and the fibrous ring caused by degenerative lesions of the lumbar spine, and promote the expression of related proteins. It may be related to the regulation of the Fas/FasL signaling pathway.
〔Keywords〕 Bushen Huoxue Decoction; lumbar degenerative lesion; Fas/FasL signaling pathway; rat; intervertebral disc; lumbago
腰痛是脊柱疾患中常见的一类症状,严重影响患者生活,也是全球致残的主要慢性疾病之一[1]。腰椎间盘退行性变是临床中导致下腰痛的主要原因之一[2]。随着疾病的进展,将会导致椎间盘老化、骨化、椎管狭窄等问题,最后会引起腰椎不同程度失稳和功能下降[3]。
研究表明,脂肪酸合成酶(fatty acid synthase, Fas)与脂肪酸合成酶配体(fatty acid synthase ligand, FasL)的交联通过复杂的信号通路,可引起细胞凋亡[4]。椎间盘有免疫特权,其中,最重要的是髓核细胞[5]。作为有免疫特权的重要死亡受体,FasL在诸多细胞或器官中均有表达,比如髓核细胞、T淋巴细胞、免疫器官、眼睛中[5-7]。因此,假设Fas-FasL死亡复合物可能在维持椎间盘的免疫特权方面起作用。
本课题组根据十余年的临床与试验研究,证实了补肾活血汤可有效改善椎间盘细胞状态[8-9],但其具体机制尚不清楚,探索并找到一种既经济又有效的治疗方法就显得重要及必要,且如何运用中医药预防和减轻椎间盘退行性变是一个研究方向。故应用以上机制证明腰痛症状,由此深入了解调节椎间盘细胞调亡机制,对防治此类疾病有着重大的现实意义。
1 材料和方法
1.1 实验动物
52只SPF级12个月龄健康雌性SD大鼠,体质量(300±40) g,由湖南省中西结合医院动物实验室提供,许可证号:SCXK(湘)2019-0004。适应性喂养2周后进行随机分组。本研究经湖南省中西结合医院伦理委员会批准同意,动物伦理批号:2021-0067。
1.2 主要试剂
兔Fas抗体、小鼠β-actin抗体、辣根过氧化物酶标记山羊抗大鼠IgG、辣根过氧化物酶标记山羊抗兔IgG均购自美国Proteintech公司(批号分别为13098-1-AP、66009-1-Ig、SA00001-1、SA00001-2);兔FasL抗体(英国Abcam公司,批号:ab231011);PAGE胶促凝剂、PBS磷酸盐粉剂、柠檬酸钠粉剂均购自长沙艾碧维生物科技有限公司(货号分别为AWB0068a、AWI0134b、AWI0207b);mRNA逆转录试剂盒、微RNA逆转录试剂盒、UltraSYBR Mixture、Trizol均购自北京康为世纪生物科技有限公司(批号分别为CW2569、CW2141、CW2601、15596026);Masson染色试剂盒、番红固绿染色试剂盒均购自上海未峰生物技术有限公司(货号分别为AWI0253b、AWI0240a);兔二步法检测试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司(批号分别为2127A0705、216180923)。
1.3 主要仪器
切片刀(德国莱卡公司,型号:M199);切片机(浙江金华益迪医疗设备有限公司,型号:YD-315);包埋机(常州中威电子仪器有限公司,型号:BMJ-A);生物显微镜(麦克奥迪实业集团有限公司,型号:BA210T);台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);转膜仪、电泳仪均购自北京六一生物科技有限公司(型号分别为DYCZ-40D、DYY-2C);生物样品均质仪(中国杭州奥盛仪器有限公司,型号:BioPrep-24);化学发光成像系统(上海勤翔科学仪器有限公司,型号:ChemiScope6100);光学显微镜(北京普瑞赛司仪器有限公司,型号:BA410T)。
1.4 实验药物
补肾活血汤出自《伤科大成·应用诸方》,在研究团队临床运用过程中,根据患者情况、中药质量改变等,调整用药及用量如下:熟地黄15 g,杜仲10 g,枸杞子10 g,补骨脂15 g,菟丝子10 g,当归10 g,没药10 g,酒萸肉10 g,肉苁蓉10 g,独活10 g,红花6 g[8]。上述药物均由湖南省中西医结合医院药剂科提供。将中药材以清水浸泡30 min后,水煎煮2次,每次煎得药液200 mL,合并药液,冷却后置于4 ℃冰箱内冷藏备用。在前期研究中已发现,高浓度补肾活血汤对大鼠椎间盘退行性变的治疗效果更好,確定本研究生药含量为1.66 g/mL[8]。根据人与动物体表面积折算[10],人用剂量332 g/d,计算出大鼠等效剂量为28.98 g/(kg·d),200 g大鼠每日服用3.5 mL。
腰痹通胶囊(江苏康缘药业股份有限公司,批号:18081309885,规格:0.42 g/粒),碾磨成粉,用纯水配制成0.1 g/mL。根据人与动物体表面积折算[10],人用剂量3.78 g/d,计算出大鼠等效剂量为0.34 g/(kg·d),200 g大鼠每日服用0.7 mL。
1.5 实验方法
1.5.1 实验分组及造模 52只大鼠,按照体质量进行编号,按随机数字表分为3组:空白组(10只)、假手术组(10只)、手术组(32只)。其中,手术组造模成功后随机抽取2只检验造模是否成功,之后随机分成补肾活血汤组、腰痹通组、模型组,每组10只。
造模方法采用纤维环穿刺法[11-12]:实验大鼠在同样环境适应性饲养2周后,除空白组外,其余组以2%戊巴比妥钠2 mL/kg腹腔注射麻醉。待麻醉生效后,将大鼠仰卧位固定,术区剃毛。在无菌条件下从右侧后腹膜入路,切口从12肋下致髂嵴上缘4~5 cm,依次切开组织,显露第2~6腰椎间盘节段。假手术组分离出椎间盘后,无须任何处理;其余手术组选择16G穿刺针沿椎体右前侧纤维环向椎间盘中心穿刺,深度限制在3~5 mm,留置5 s,术后逐层缝合创口。术后连续3 d肌内注射青霉素以防感染,每只大鼠4万U/d。
造模后随机选取2只大鼠,取椎间盘组织,行HE染色,髓核脊索细胞变少,纤维软骨被组织替代,纤维环出现裂隙排列不整齐,表示造模成功[13]。
1.5.2 动物给药 造模成功1周后,开始予以不同治疗,根据人与动物体表面积换算公式计算出大鼠用药剂量[10]。空白组、假手术组、模型组每日生理盐水10 mL/kg灌胃,补肾活血汤组每日28.98 g/kg补肾活血汤灌胃,腰痹通组每日0.34 g/kg腰痹通灌胃。
所有大鼠5 d测量1次体质量,并按体质量变化调整给药量,整个灌胃过程持续4周。
1.5.3 动物处理及指标检测 饲养4周后行脊椎脱臼法处死所有大鼠,解剖出第3~6腰椎间盘,清除所有多余组织,将干净的椎间盘组织置于-80 ℃冰箱内保存备用。
(1)Masson染色。将椎间盘组织烘干、脱水、固定、切片,滴加适量核染液以覆盖整个组织,染色10~60 s,彻底冲洗后用PBS(pH 7.2~7.6)溶剂浸泡5~10 min,使细胞核返蓝;甩干后滴加适量浆染液以覆盖整个组织,染色2~5 min,冲洗;分色液分色30 s左右,弃去分色液;滴加适量复染液以覆盖整个组织,染色3~8 min,用无水乙醇冲洗干净;吹干后将玻片置于二甲苯10 min,中性树胶封片、显微镜观察。
(2)番红固绿染色。将椎间盘组织烘干、脱水后,先将切片置于二甲苯中10 min,然后依次在100%、95%、85%、75%乙醇浸洗,每级放置5 min,蒸馏水冲洗;固绿染液染色约5 min,蒸馏水冲洗,1%醋酸清洗;番红染约30 s,蒸馏水冲洗;吹干后将玻片置于二甲苯10 min,中性树胶封片、显微镜观察。
(3)免疫组织化学(immunohistochemistry, IHC)分析。将椎间盘组织烘干、脱水后,先将切片置于二甲苯中10 min,然后依次在100%、95%、85%、75%乙醇浸洗,每级放置5 min,蒸馏水冲洗;将切片浸入0.01 mol枸橼酸盐缓冲液(pH 6.0)加热,冷却后用0.01 mol PBS(pH 7.2~7.6)洗涤3 min,共3次;加入1%高碘酸,PBS冲洗;滴加适当稀释的一抗(Fas、FasL)及50~100 μL辣根过氧化物酶标记山羊抗大鼠IgG,孵化后冲洗;经DAB显色,苏木素复染后乙醇脱水;吹干后将玻片置于二甲苯10 min,中性树胶封片、显微镜观察。阳性染色为黄色或棕黄色,深的可至褐色染色。显微镜下拍照后使用Image-Pro Plus 6.0软件计算积分光密度(integral optical density, IOD)值。
(4)Western blot检测椎间盘组织Fas、FasL蛋白表达水平。取椎间盘组织,PBS洗涤后用RIPA裂解液进行匀浆,BCA法测定蛋白浓度;提取上样量,按照要求配制分离胶与浓缩胶后完成电泳。接着将蛋白条带与NC膜及滤纸一同放入转膜缓冲液完成转膜,随机在PBST中清洗;用1倍PBST配制5%脱脂奶粉,室温封闭90 min;加入Fas抗体(1∶2000)、FasL抗体(1 μg/mL)、β-actin抗体(1∶5000),4 ℃孵育过夜。PBST清洗3次后,加入相应辣根过氧化物酶标记山羊抗大鼠IgG抗体(1∶5000)和辣根过氧化物酶标记山羊抗兔IgG抗体(1∶6000),室温孵育90 min,PBST清洗,ECL显色曝光并拍照记录。
(5)RT-PCR检测鼠椎间盘组织Fas、FasL mRNA表达水平。取椎间盘组织,利用Trizol提取组织总RNA,取约0.25 mg组织,加入液氮充分研磨,加1 mL Trizol混匀,混匀后室裂解5 min;加入200 μL三氯甲烷,剧烈振荡15 s,室温静置3 min;离心后取上层液相,转移到新的离心管中;加入等体积的异丙醇,混匀静置10 min;离心去上清,加入1 mL 75%乙醇(无菌DEPC处理水配制)洗涤沉淀;离心去上清,干燥后加入20~30 μL无菌无酶水溶解沉淀;紫外分光光度计测定浓度,测其吸光度值,并计算其浓度跟纯度。以组织总mRNA为模板,逆转录互补DNA。利用SYBR法完成PCR检测。引物序列详见表1。
1.6 统计学方法
采用SPSS 22.0软件處理。计量资料用“x±s”表示,所有数据都进行正态性和方差齐性检验。多组间比较用单因素方差分析;组间两两比较,方差齐时采用方差分析,方差不齐时用秩和检验;两变量间的关系用直线相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠椎间盘组织病理学变化
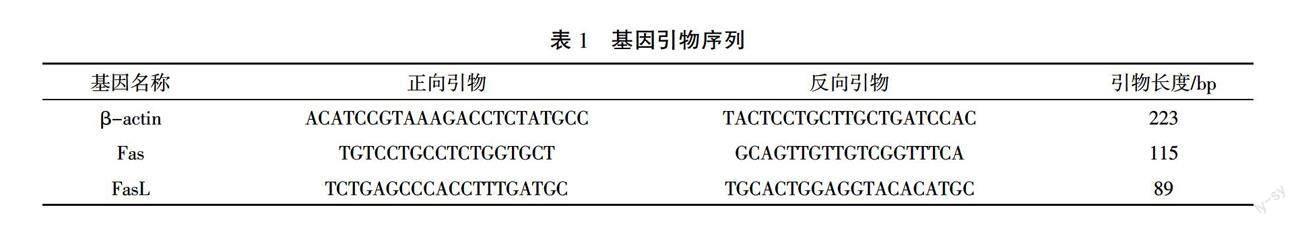
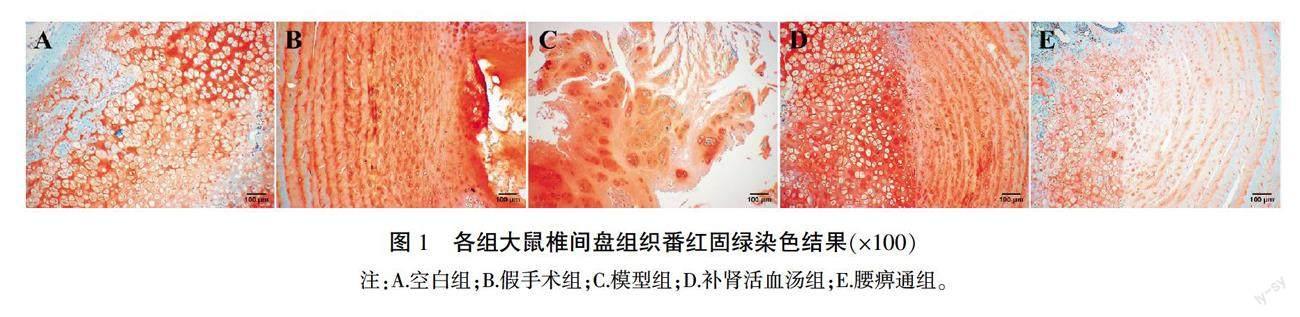
番红固绿染色结果显示,空白组、假手术组标本细胞形态正常,细胞凋亡较少,其中,细胞核清晰可见,细胞外结构完整、基质充盈,胶原蛋白排列规整。模型组纤维环明显碎裂或扭曲,纤维环与髓核间中断,髓核中细胞数量严重减少,细胞结构不清晰,细胞核固缩,部分标本呈现骨化、钙化趋势。经过治疗,补肾活血汤组和腰痹通组椎间盘细胞整体结构较模型组好转,椎间盘纤维环轻度破裂,胶原蛋白排列欠规整,髓核与纤维环之间未见明显断裂,髓核细胞及空泡数量略有减少,髓核中基质轻度凝结,且补肾活血汤组优于腰痹通组。详见图1。
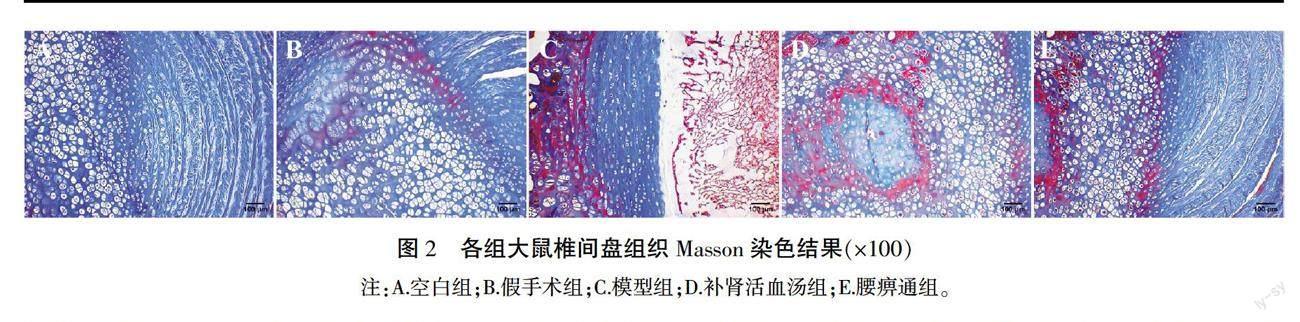
Masson染色结果显示,正常椎间盘结构完整,胶原蛋白排列有序。纤维环呈现为蓝色,髓核细胞呈现为红色或红褐色,细胞质亦为红色,纤维环与髓核界限清晰。模型组髓核严重纤维化,细胞核碎裂明显,纤维环与髓核之间断层明显,纤维环严重破裂,染色较深。经过治疗,补肾活血汤组和腰痹通组中胶原蛋白含量显著增加,纤维环与髓核之间裂隙缩小,髓核中细胞形态较前改善,且补肾活血汤组优于腰痹通组。详见图2。
2.2 各组大鼠椎间盘组织IHC分析
IHC染色结果显示,空白组、假手术组未见明显退行性变,在其髓核细胞胞浆未见黄色/棕黄色颗粒;手术组Fas、FasL表达阳性,其中,模型组髓核细胞胞浆内聚集大量棕黄色颗粒,Fas、FasL强阳性表达;补肾活血汤组在细胞胞浆中见有少量黄色颗粒,Fas、FasL弱阳性表达;腰痹通组在细胞胞浆中可见棕黄色颗粒,Fas、FasL阳性表达。详见图3—4。
与空白组比较,模型组Fas、FasL IOD值均明显升高(P<0.01)。假手术组与空白组间Fas、FasL IOD值比较,差异均无统计学意义(P>0.05)。与模型组比较,补肾活血汤组、腰痹通组Fas、FasL IOD值均明显降低(P<0.01)。与腰痹通组比较,补肾活血汤组Fas、FasL IOD值均明显降低(P<0.01)。详见表2。
2.3 各组大鼠椎间盘组织Fas、FasL蛋白表达情况
与空白组比较,模型组Fas、FasL蛋白表达水平均明显降低(P<0.01)。假手术组与空白组间Fas、FasL蛋白表达水平比较,差异均无统计学意义(P>0.05)。与模型组比较,补肾活血汤组、腰痹通组Fas、FasL蛋白表达水平均明显升高(P<0.01)。与腰痹通组比较,补肾活血汤组Fas、FasL蛋白表达水平均明显升高(P<0.01)。详见表3、图5。
2.4 各组大鼠椎间盘组织Fas、FasL mRNA表达情况
与空白组比较,模型组Fas、FasL mRNA表达水平均明显降低(P<0.01)。假手术组与空白组间Fas、FasL mRNA表达水平比较,差异均无统计学意义(P>0.05)。与模型组比较,补肾活血汤组、腰痹通组Fas、FasL mRNA表达水平均明显升高(P<0.01)。与腰痹通组比较,补肾活血汤组Fas、FasL mRNA表达水平均明显升高(P<0.01)。详见表4。
3 讨论
腰椎间盘退行性变可引起患者出现多种临床症状,其中,以腰痛为最主要症状,严重影响患者的生活质量和生活水平[14]。因其症状重、难根治、易复发的特性,又易引起情绪焦虑情况。当前对于腰椎间盘退行性变的治疗方案相對局限,若采取手术治疗容易引起相邻椎体退行性变等其他并发症,且我国此病发生率不断攀升,采取合理、有效、经济的治疗方式势在必行。中医药治疗腰椎间盘退行性变有着独到的见解。诸多研究从临床研究、基础研究等各方面着手了解中医药治疗腰椎间盘退行性变的作用机制,如减轻椎间盘炎症因子的释放[15]、调节自身免疫[16]、抑制细胞凋亡[17]等。
中医学里并无腰椎间盘退行性变相关记载,椎间盘在中医里属“筋”的范畴。补肾活血汤兼具祛风除湿、补益肝肾、通络止痛、补益气血的功效,作为治疗腰椎间盘退行性变的基础方之一,临证加减。方中独活通络止痛、祛风除湿,熟地黄益肾填精,山茱萸、菟丝子补肾收涩,杜仲、补骨脂、枸杞子补益肝肾、强筋骨,肉苁蓉补肾阳、益精血,当归补益气血,没药、红花活血止痛。诸药合用,唯先补肾,标本兼顾。
补肾活血汤以补肾为主,辅以活血。研究发现,杜仲提取物杜仲多糖不仅能够有效调控腰椎间盘炎症因子和细胞因子的释放,还能延缓其退行性变[18]。红花则能有效促进局部血液循环,减轻氧化应激带来的细胞损伤[19]。本课题组前期研究发现,补肾活血汤能有效改善局部微循环,促进骨质代谢,抑制炎症的发生发展,起到消除神经根炎症的作用,有效防治腰椎退行性变[8,20]。
研究指出,FasL可通过抑制凋亡信号的传递以调节髓核细胞炎症和衰老[21],随着椎间盘退行性变,FasL表达下降,从而降低FasL对椎间盘的保护作用[22]。同时有研究指出,FasL的表达水平也因个体基因决定,其凋亡诱导配体在不同人体髓核中表达水平也会有所不同[23]。本研究发现,退行性变的椎间盘细胞中Fas、FasL蛋白表达水平明显降低,番红固绿染色及Masson染色观察椎间盘病理学变化,可见椎间盘与纤维环界限模糊、纤维环排列紊乱且存在缝隙,髓核细胞聚集、皱缩、减少。IHC结果显示退行性变的椎间盘细胞内含有大量棕色颗粒。经过中药复方治疗,大鼠髓核与纤维环之间未见明显断裂,髓核细胞及空泡数量减少,基质趋于稳定,染色浅且均匀,显著提升椎间盘细胞中Fas、FasL蛋白表达水平,修复受损椎间盘组织,增加了椎间盘细胞活力水平,从而延缓细胞凋亡。上述结果表明Fas/FasL信号通路与腰椎间盘退行性变中椎间盘细胞衰老有关,而补肾活血汤的应用能有效保护椎间盘细胞,延缓椎间盘退行性变炎症反应和细胞的衰老与凋亡。
参考文献
[1] GBD Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1789-1858.
[2] GUO H Y, GUO M K, WAN Z Y, et al. Emerging evidence on noncoding-RNA regulatory machinery in intervertebral disc degeneration: A narrative review[J]. Arthritis Research & Therapy, 2020, 22(1): 270.
[3] BAHAR M E, HWANG J S, AHMED M, et al. Targeting autophagy for developing new therapeutic strategy in intervertebral disc degeneration[J]. Antioxidants, 2022, 11(8): 1571.
[4] MAO M G, XU J, LIU R T, et al. Fas/FasL of Pacific cod mediated apoptosis[J]. Developmental and Comparative Immunology, 2021, 119: 104022.
[5] YE F B, LYU F J, WANG H, et al. The involvement of immune system in intervertebral disc herniation and degeneration[J]. JOR Spine, 2022, 5(1): e1196.
[6] MUSTAFA N, MITXELENA J, INFANTE A, et al. E2f2 attenuates apoptosis of activated T lymphocytes and protects from immune-mediated injury through repression of fas and FasL[J]. International Journal of Molecular Sciences, 2021, 23(1): 311.
[7] FLORES-MENDOZA G, RODRíGUEZ-RODRíGUEZ N, RUBIO R M, et al. Fas/FasL signaling regulates CD8 expression during exposure to self-antigens[J]. Frontiers in Immunology, 2021, 12: 635862.
[8] 谢 芳,吴官保,姚红艳,等.补肾活血汤干预衰老大鼠退变椎间盘模型中经典WNT信号通路β-catenin蛋白含量的研究[J].湖南中医药大学学报,2018,38(3):275-279.
[9] 冯帅华,杨 届,胡桔花,等.补肾活血汤治疗肾虚血瘀型腰椎间盘突出症36例临床观察[J].湖南中医杂志,2019,35(12):47-48.
[10] 魏 伟,吴希美,李元建.药理实验方法学[M].4版.北京:人民卫生出版社,2010:71-72.
[11] 白荣飞,张 震,林一峰,等.三种方法建立大鼠腰椎间盘退变模型[J].中国组织工程研究,2018,22(16):2514-2519.
[12] 颜 昊,贾永伟,翟伟峰.椎间盘退变动物模型的研究进展[J].中国实验动物学报,2021,29(3):387-392.
[13] MELGOZA I P, CHENNA S S, TESSIER S, et al. Development of a standardized histopathology scoring system using machine learning algorithms for intervertebral disc degeneration in the mouse model-An ORS spine section initiative[J]. JOR Spine, 2021, 4(2): e1164.
[14] 宋嬋婵,冉 兵,宗 毅,等.椎间盘退变机制及修复生物工程支架研究进展[J].中国疼痛医学杂志,2022,28(9):657-663.
[15] 贾松涛,郑丽娅,武佐元,等.调督理筋针法联合独活寄生汤治疗寒湿痹阻型腰椎间盘突出症的疗效及对血清PGE2、IL-6和TNF-α水平影响[J].中华中医药学刊,2021,39(12):167-171.
[16] BANIMOSTAFAVI E S, FAKHAR M, ABEDIANKENARI S, et al. Determining serum levels of IL-10 and IL-17 in patients with low back pain caused by lumbar disc degeneration[J]. Infectious Disorders Drug Targets, 2021, 21(5): e270421185135.
[17] PENG C, RAO W, ZHANG L, et al. Mitofusin 2 ameliorates hypoxia-induced apoptosis via mitochondrial function and signaling pathways[J]. The International Journal of Biochemistry & Cell Biology, 2015, 69: 29-40.
[18] 张天龙,赵继荣,陈祁青,等.杜仲及其有效成分防治腰椎间盘突出症的研究进展[J].时珍国医国药,2020,31(12):2985-2988.
[19] 吴若丹,白云鹤,倪杨明.红花注射液联合塞来昔布治疗腰椎间盘突出症临床研究[J].药物评价研究,2020,43(9):1831-1835.
[20] FENG S H, XIE F, YAO H Y, et al. The mechanism of Bushen Huoxue Decoction in treating intervertebral disc degeneration based on network pharmacology[J]. Annals of Palliative Medicine, 2021, 10(4): 3783-3792.
[21] LI Z Q, SUN C F, CHEN M S, et al. Lumican silencing alleviates tumor necrosis factor-α-induced nucleus pulposus cell inflammation and senescence by inhibiting apoptosis signal regulating kinase 1/p38 signaling pathway via inactivating Fas ligand expression[J]. Bioengineered, 2021, 12(1): 6891-6901.
[22] 胡一村,张晓勃,张芮浩,等. Fas凋亡途径在椎间盘退变中的作用研究进展[J].解放军医学杂志,2021,46(3):300-305.
[23] HU S Y, FU Y C, YAN B, et al. Analysis of key genes and pathways associated with the pathogenesis of intervertebral disc degeneration[J]. Journal of Orthopaedic Surgery and Research, 2020, 15(1): 371.
〔收稿日期〕2022-09-20
〔基金项目〕湖南省自然科学基金项目(2022JJ30025);长沙市自然科学基金项目(kq2202475);湖南省引导基金课题(2021SK51008)。
〔第一作者〕王镇远,男,硕士研究生,研究方向:中医药防治脊柱与骨关节疾病。
〔通信作者〕*吴官保,男,博士,主任医师,硕士研究生导师,E-mail:yhywgb@126.com。

