益肝明目汤对糖尿病视网膜水肿模型大鼠NLRP3/Caspase-1信号通路的影响
廉艺童 刘志敏 聂辅娇 胡卓瑜 付美林 胡齐 江婕妤 陈向东
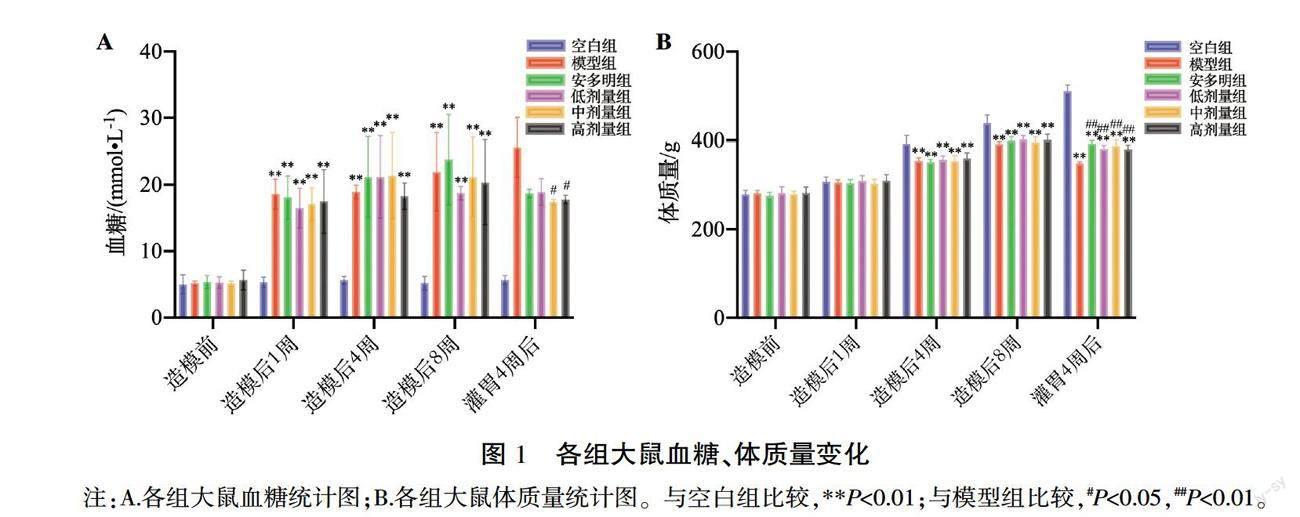
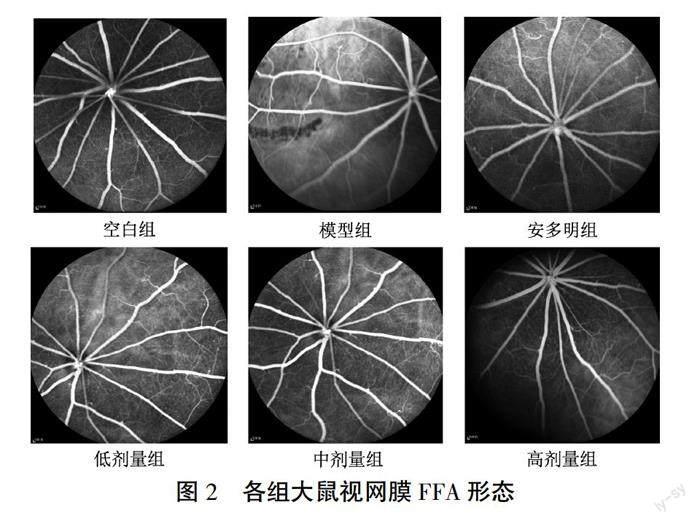

〔摘要〕 目的 观察益肝明目汤对糖尿病视网膜水肿模型大鼠NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)/半胱氨酸天冬氨酸特异性蛋白酶-1(cysteine aspartate-specific proteinase-1, Caspase-1)信号通路的影响,从细胞焦亡的角度探讨其治疗糖尿病视网膜水肿的作用机制。方法 将36只SD大鼠随机分为空白组(6只)和造模组(30只)。采用一次性腹腔注射40 mg/kg链脲佐菌素(streptozocin, STZ)溶液联合高糖高脂饲料喂养建立糖尿病视网膜水肿大鼠模型。将成模大鼠随机分为模型组,安多明组,低、中、高剂量组,每组6只,分别予以蒸馏水、羟苯磺酸钙胶囊(0.09 g/kg)、益肝明目汤(2.8、5.6、11.2 g/kg)进行灌胃,每日2次,连续4周。观察大鼠一般生物学特征,监测不同时期血糖、体质量变化;采用眼底荧光血管造影(fundus fluorescence angiography, FFA)和光学相关断层扫描技术(optical correlation tomography, OCT)观测各阶段视网膜血管渗漏及视网膜厚度的变化;HE染色检测视网膜组织病理变化;免疫组化法检测视网膜组织NLRP3与衔接蛋白(apoptosis-associated speck-like protein, ASC)表达水平;Western blot检测视网膜组织Caspase-1与NLRP3表达水平;ELISA检测血清炎症因子白细胞介素-1β(interleukin-1β, IL-1β)和白细胞介素-18(interleukin-18, IL-18)含量。结果 与空白组比较,模型组大鼠一般生物学特征出现较明显的改变;血糖显著升高(P<0.01);体质量显著降低(P<0.01);视网膜厚度增加(P<0.01);FFA可见视网膜血管走行迂曲,散在微血管瘤及少许点状强荧光;病理形态见各层细胞排列紊乱、稀疏,内丛状层、内外核层松散,结构紊乱,视网膜厚度增加;视网膜组织中NLRP3、ASC、Caspase-1蛋白表达及炎症因子IL-1β、IL-18含量显著升高(P<0.01)。与模型组比较,中剂量组、高剂量组大鼠血糖均降低(P<0.05);安多明组、低剂量组、中剂量组、高剂量组大鼠体质量均升高(P<0.01);各给药组大鼠视网膜厚度呈不同程度减少(P<0.01);FFA见微血管瘤及点状强荧光减少;病理形态见视网膜各层结构基本完整,排列规整,厚度减少;视网膜组织中NLRP3、ASC、Caspase-1蛋白表达及炎症因子IL-1β、IL-18含量显著降低(P<0.01,P<0.05)。结论 以疏肝健脾、活血利水为治法的益肝明目汤可能通过干预NLRP3/Caspase-1介导的细胞焦亡,进而减轻炎症因子的释放,减轻视网膜水肿,从而改善视网膜功能。
〔关键词〕 益肝明目汤;糖尿病视網膜病变;视网膜水肿;细胞焦亡;NLRP3/Caspase-1信号通路
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.009
Effects of Yigan Mingmu Decoction on the NLRP3/Caspase-1 signaling
pathway in rats model with diabetic retinal edema
LIAN Yitong1,2, LIU Zhimin1, NIE Fujiao1, HU Zhuoyu1,2, FU Meilin1, HU Qi1,2, JIANG Jieyu1,2, CHEN Xiangdong1*
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China;
2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To investigate the effects of Yigan Mingmu Decoction on the NOD-like receptor thermal protein domain associated protein 3 (NLRP3)/cysteine aspartate-specific proteinase-1 (Caspase-1) signaling pathway in rats with diabetic retinal edema, and to explore the mechanism of action in the treatment of diabetic retinal edema from the perspective of pyroptosis. Methods A total of 36 SD rats were randomly divided into blank group (n=6) and model group (n=30). The one-time intraperitoneal injection of 40 mg/kg streptozocin (STZ) solution combined with high-sugar and high-fat feed was applied to establish the rat model of diabetic retinal edema. Then the above models were divided into model groups, andomine group, low-dose, medium-dose and high-dose Yigan Mingmu Decoction groups, with 6 rats in each group. All the rats were treated with distilled water, calcium hydroxybenzenesulfonate granules (0.09 g/kg), and Yigan Mingmu Decoction (2.8, 5.6, 11.2 g/kg) respectively, twice a day in 4 consecutive weeks. The general biological characteristics of rats were observed; the changes in blood sugar and body weight in different periods were monitored; the retinal vascular leakage and retinal thickness changes at various stages were found using fundus fluorescence angiography (FFA) and optical correlation tomography (OCT); the renal tissue pathological morphology was detected by HE staining; the expression of NLRP3 and apoptosis-associated speck-like protein (ASC) in retinal tissue was detected by immunohistochemistry; the expression of Caspase-1 and NLRP3 in retinal tissues was detected by Western blot; the content of serum inflammatory factors interleukin-1β (IL-1β) and interleukin-18 (IL-18) was detected by ELISA. Results Compared with blank group, the general biological characteristics of rats in model group were significantly changed, blood glucose increased significantly (P<0.01), body weight decreased significantly (P<0.01), and retinal thickness increased (P<0.01). FFA showed that the retinal blood vessels were tortuous, scattered with microangiomas and a few punctate strong fluorescence points. Pathological morphology showed disordered and sparse arrangement of cells in each layer, loose inner plexiform layer, inner and outer nuclear layers, disordered structure, and increased retinal thickness. The protein expression of NLRP3, ASC, Caspase-1 and the inflammatory factors of IL-1β, IL-18 significantly increased (P<0.01). Compared with model group, blood glucose in medium-dose group and high-dose group decreased (P<0.05). The body weight of andomine group, low-dose group, medium-dose group and high-dose group was higher than that of model group; the retinal thickness of the rats in each administration group was reduced to varying degrees, and FFA showed that the microvascular tumors and punctate strong fluorescence were reduced. Pathological morphology showed that the structure of each layer of retina was basically intact, regular arranged, and the thickness was reduced. The protein expression of NrLRP3, ASC, and Caspase-1 and the inflammatory factors of IL-1β, IL-18 in retinal tissue were significantly lower (P<0.01, P<0.05). Conclusion Yigan Mingmu Decoction soothes the liver and fortifies the spleen, activate blood and drain water retention. It may intervene the NLRP3/Caspase-1 mediated pyroptosis, release less inflammatory factors, and relieve the retinal edema and thus improve retinal function.
〔Keywords〕 Yigan Mingmu Decoction; diabetic retinopathy; retinal edema; pyrolysis; NLRP3/Caspase-1 signaling pathway
糖尿病黄斑水腫(diabetic macular edema, DME)是糖尿病视网膜病变(diabetic retinopathy, DR)最为常见的并发症,可发生在DR的任一时期,是糖尿病患者视力损害的重要原因之一,其主要病理特点是黄斑区积液、弥漫性毛细血管渗漏、毛细血管扩张、黄斑区渗漏等[1],严重影响患者的生活质量。DME发病机制复杂,炎症反应贯穿疾病全程,研究表明,高血糖可通过细胞焦亡或自噬等生物过程引起炎性反应,从而导致血管和视网膜组织损伤[2],最终导致DME发生。细胞焦亡典型通路以NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)炎症小体活化、半胱氨酸天冬氨酸特异性蛋白酶-1(cysteine aspartate-specific proteinase-1, Caspase-1)激活、白细胞介素-1β(interleukin-1β, IL-1β)和白细胞介素-18(interleukin-18, IL-18)的释放为特征[3],其过度活化会加重炎症反应,炎症因子浸润会导致DR进一步加剧,进而加重视网膜水肿,影响视网膜功能[4-6]。目前,玻璃体内注射抗血管内皮生长因子(vascular endothelial growth factor, VEGF)为临床一线治疗方法,在抑制视网膜新生血管生长,减轻黄斑水肿等方面取得较好临床效果[7],但因药效时间短,注射费用昂贵,需反复多次注射,会引起白内障、顽固性眼压高、葡萄膜炎、视网膜脱离等局部并发症,也可能因全身吸收引起不良反应,尚有许多无效病例[8]。因此,探究安全有效的DME中医药治疗方法具有重要的意义。本团队前期研究发现,益肝明目汤在改善DME患者视力、增加水肿吸收、提高远期疗效等方面具有明显优势[9-10]。为进一步验证其疗效机制,本实验以细胞焦亡经典通路NLRP3/Caspase-1为切入点,探讨益肝明目汤对糖尿病视网膜水肿模型大鼠的作用机制,以期为临床应用提供依据。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠36只,鼠龄8周,体质量200~220 g,由湖南斯莱克景达实验动物有限公司提供,动物生产许可证号:SCXK(湘)2019-0004,动物使用许可证号:SYXK(湘)2020-0008。饲养于湖南省中医药研究院中药研究所,温度24~26 ℃,湿度50%~70%,通风良好,昼夜交替。依照实验动物中心管理办法,分笼、标准饲料喂养,适应性饲养1周后进入实验阶段。实验经湖南省中医药研究院实验伦理委员会批准(2020-0062)。
1.2 药物
益肝明目汤中药超微颗粒剂组方:柴胡10 g(批号:2015020C),当归10 g(批号:2106029C),白芍10 g(批号:2105009S),川芎10 g(批号:2102028C),丹参15 g(批号:2017003C),茯苓15 g(批号:2102007C),车前子10 g(批号:2102110C),密蒙花10 g(批号:2102005C),蒺藜10 g(批号:2107005C),泽泻10 g(批号:2104010C),茺蔚子10 g(批号:2103009C),决明子15 g(批号:2105020C),中药超微配方颗粒均购自湖南春光九汇现代中药有限公司,将中药超微颗粒剂溶于蒸馏水。羟苯磺酸钙胶囊(安多明)(贵州天安药业股份有限公司,规格0.25 g/粒,批号:14201658642)。
1.3 主要试剂
链脲佐菌素(streptozocin,STZ)(美国Sigma公司,批号:08E221108);苏木素、PBS、伊红(长沙维世尔生物科技有限公司,批号:02A221224、01A221001、05F221211);柠檬酸、柠檬酸钠(上海展云化工有限公司,批号:01B221210、03A221023);复方托吡卡胺滴眼液(沈阳兴齐眼药股份有限公司,批号:14200221221);荧光素钠(广州白云山明兴制药有限公司,批号:XY19118);NLRP3抗体、ASC抗体、β-actin抗体、HRP goat anti-mouse IgG、HRP goat anti-rabbit IgG(中国武汉三鹰生物技术有限公司,批号:00091876、20000132、10004156、20000242、20000243);Caspase-1抗体[艾博抗(上海)贸易有限公司,批号:GR2126147-6];IL-18试剂盒、IL-1β试剂盒(上海酶联生物科技有限公司,批号:200116、200503)。
1.4 主要仪器
眼底血管荧光造影仪、光学相干断层扫描仪(德国海德堡公司,型号:Spec-CAM-07973-S1600、Spec-CAM-05529-S2000);台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);全自动酶标洗板机、多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:PW-812、MB-530);电热恒温培养箱(北京市永光明医疗仪器有限公司,型号:DHP-500);电泳仪、电泳槽、转膜仪(中国北京六一生物科技有限公司,型号:DYY-6C、DYCZ-24DN、DYCZ-40D)。
1.5 造模、分组及给药
36只SD大鼠适应性喂养1周,空腹12~14 h后称重编号,随机分为空白组(6只)、造模组(30只)。空白组大鼠给予普通饲料喂养。造模组大鼠给予高糖高脂饲料喂养,2周后禁食12~15 h,自由饮水,配制0.1 mmol/L新鲜柠檬酸缓冲液(pH 4.2),制备1% STZ溶液,按照40 mg/kg一次性腹腔注射[11],在30 min内完成注射,防止STZ溶液失效,注射完成后恢复饮食。72 h后随机血糖水平达到16.7 mmol/L及以上的大鼠,认为糖尿病大鼠模型建立成功,不达标或短期内血糖降低的大鼠,可同法腹腔注射小剂量(30 mg/kg)造模,至血糖达标[12]。将造模成功的30只大鼠随机分为模型组、安多明组、低剂量组、中剂量组、高剂量组,按“人-动物体表面积等效剂量比值表”折算[13],以临床等效剂量为中剂量,即低剂量组、中剂量组、高剂量组每日分别以浓度为2.8、5.6、11.2 g/kg的益肝明目汤灌胃,安多明组按说明书配制等效剂量0.09 g/kg灌胃,空白组和模型组均予蒸馏水16 mL/(kg·d)灌胃。各组每日灌胃2次,干预4周。实验过程中出现死亡的大鼠予以剔除并根据要求进行补充。
1.6 一般生物学特征
观察SD大鼠在不同时期的体格、毛发、进食、饮水、大小便等行为学特征及空白组与造模组大鼠的生物学差异,观察并评价其晶状体混浊程度是否随病情进展发生代谢性白内障。
1.7 血糖、体质量水平
分别在造模前,造模后第1、4、8周(灌胃前),灌胃4周后测量记录所有大鼠的血糖及体质量。
1.8 OCT视网膜厚度
分别在造模前,造模后第4、8周(灌胃前),灌胃4周后使用OCT测量大鼠视网膜厚度,腹腔注射10%水合氯醛30 mg/kg进行麻醉,双眼滴用复方托吡卡胺滴眼液扩瞳,固定鼠眼,双眼行OCT检查并手动测量距离视盘上方、下方、颞侧、鼻侧2个视盘直径的视网膜厚度,即视网膜内界膜至视网膜色素上皮高反射层[14]。
1.9 眼底荧光造影检查
分别在造模后第4、8周及灌胃4周后行眼底荧光血管造影(fundus fluorescence angiography, FFA)检查,检查时大鼠腹腔内注射质量分数20%的荧光素钠(0.012 mL/g),并快速观察及拍摄视网膜血管情况,观察血管充盈状态及有无荧光渗漏、灌注区等。
1.10 HE染色
麻醉成功后离断视神经,摘除大鼠眼球,置入眼球固定液中,进行石蜡包埋、切片、脱蜡、HE染色、中性树胶封片、显微镜观察。
1.11 ELISA检测
腹主动脉取血,室温自然凝固15 min,3000 r/min离心20 min(离心半径15 cm),取上清液,按照ELISA试剂盒步骤检测大鼠视网膜组织IL-1β、IL-18含量。
1.12 免疫组化检测
视网膜组织石蜡包埋,切片常规脱蜡脱水,热修复抗原、漂洗、封闭;孵育一抗:滴加适当稀释的一抗(NLRP3、ASC),4 ℃过夜。PBS漂洗;孵育二抗:滴加50~100 μL HRP goat anti-rabbit IgG于37 ℃孵育30 min,PBS冲洗5 min×3次;DAB显色,苏木素复染,PBS返蓝;各级乙醇(60%~100%)脱水,每级5 min。二甲苯透明,中性树胶封片、显微镜拍片采像,并使用图片分析软件IPP(Image-Pro-Plus)进行数据分析,分别计算NLRP3、ASC阳性表达的平均光密度值(IOD)。
1.13 Western blot检测
取视网膜组织用冰预冷,PBS洗涤组织,加入100 μL RIPA裂解液于生物样品均质仪中反复研磨组织,直至组织块溶解;离心,取上清液,BCA法测定蛋白浓度,各组取80 μL蛋白上清,凝胶电泳,转膜,5%脱脂牛奶室温封闭1.5 h;加入NLRP3(1∶300)、Caspase-1(1∶1000)、β-actin(1∶5000)一抗,4 ℃孵育过夜;PBST洗3次,每次10 min;加入HRP goat anti-mouse IgG(1∶5000)、HRP goat anti-rabbit IgG(1∶6000)二抗,室温孵育1.5 h,PBST洗3次,每次10 min,ECL显色曝光,采用Image J软件对蛋白条带进行灰度分析,以目的蛋白与β-actin灰度值的比值表示蛋白相对表达量。
1.14 统计学方法
采用SPSS 25.0系统软件处理。实验数据以“x±s”表示,多组间比较采用方差分析(LSD法及Dunnet 法),不满足正态性时,则用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 益肝明目汤对模型大鼠一般情况的影响
空白组精神状态及活动度良好,反应灵敏,毛发光泽,晶状体无浑浊,饮水量及摄食量适中,二便正常,体质量进行性增加,笼内垫料干燥;模型组大鼠精神状态不佳,体形消瘦,反应迟钝,情緒暴躁,毛发萎黄易脱,部分晶状体浑浊,饮水、摄食量、尿量明显增加,多尿,笼内垫料潮湿,部分伴有烂苹果味,给药组精神不佳、毛发枯黄、多饮、多尿、多食等情况均有所改善。
2.2 益肝明目汤对模型大鼠血糖、体质量的影响
造模前,各组大鼠血糖、体质量差异均无统计学意义(P>0.05);造模后,模型组、安多明组、低剂量组、中剂量组、高剂量组大鼠血糖均显著升高,并趋于稳定,与空白组对比差异具有统计学意义(P<0.01);灌胃4周后,与模型组对比,中剂量组、高剂量组大鼠血糖均降低(P<0.05)。造模前、造模后1周,各组大鼠体质量差异无统计学意义(P>0.05);造模后4、8周及灌胃4周后空白组大鼠体质量持续增加,高于其余各组(P<0.01);灌胃4周后,与模型组对比,安多明组、低剂量组、中剂量组、高剂量组大鼠体质量均升高(P<0.01)。详见图1。
2.3 益肝明目汤对模型大鼠视网膜形态变化的影响
灌胃4周后,空白组大鼠眼底清晰,视网膜血管走行规律,粗细均匀,以视盘为中心呈放射状;模型组大鼠眼底较空白组模糊,可见视网膜血管走行迂曲,见散在微血管瘤及少许点状强荧光;安多明组、中剂量组大鼠眼底可见微血管瘤及点状荧光数量减少;低剂量组、高剂量组仍可见散在点状荧光。详见图2。
2.4 益肝明目汤对模型大鼠视网膜厚度的影响
造模前、造模后4周,各组大鼠视网膜厚度差异无统计学意义(P>0.05);造模后8周,与空白组对比,模型组、安多明组、低剂量组、中剂量组、高剂量组大鼠视网膜厚度均有不同程度的增加(P<0.01);灌胃后4周,与模型组对比,安多明组、低剂量组、中剂量组、高剂量组大鼠视网膜厚度均有不同程度的减少(P<0.01)。详见图3。
2.5 益肝明目汤对模型大鼠视网膜组织病理形态的影响
空白组大鼠视网膜组织各层结构完整,界限清晰,排列整齐;模型组大鼠视网膜可见各层细胞排列紊乱稀疏,视网膜色素上皮层变薄,内丛状层、内外核层松散,结构紊乱,视网膜厚度增加;与模型组比较,安多明组、低剂量组、中剂量组、高剂量组大鼠视网膜各层结构基本完整,排列规整,厚度减少。详见图4。
2.6 益肝明目汤对模型大鼠血清中炎症因子IL-1β、IL-18含量的影响
与空白组比较,模型组大鼠血清中IL-1β、IL-18含量显著升高(P<0.01);与模型组比较,安多明组、低剂量组、中剂量组、高剂量组大鼠视网膜组织IL-1β、IL-18含量均有不同程度的降低(P<0.01)。详见图5。
2.7 益肝明目汤对模型大鼠视网膜组织NLRP3、ASC蛋白表达的影响
与空白组比较,模型组大鼠视网膜组织NLRP3、ASC表达显著升高(P<0.01);与模型组比较,安多明组、低剂量、中剂量及高剂量组大鼠视网膜组织NLRP3、ASC表达明显降低(P<0.01)。详见图6—7。
2.8 益肝明目汤对模型大鼠视网膜组织NLRP3、Caspase-1蛋白表达的影响
与空白组比较,模型组大鼠视网膜组织NLRP3、Caspase-1表达显著升高(P<0.01);与模型组比较,安多明组、低剂量组、中剂量组、高剂量组大鼠视网膜组织NLRP3、Caspase-1表达明显降低(P<0.05,P<0.01)。详见图8。
3 讨论
根据DME临床症状将其归属于中医学“消渴目病”“视瞻昏渺”“视直如曲”等范畴。《素问·阴阳应象大论》云“脾在色为黄”,故五轮学说中黄斑归属于脾;消渴日久,耗伤气血阴液,肝失所养,肝开窍于目,肝血不足,目失濡养而不能视,引发目疾;《素问·气交变大论》曰“岁木太过,风气流行,脾土受邪”,肝病日久,疏泄失常,肝气郁结,肝木乘脾土,脾失健运,水湿内停不化,上犯目窍,导致黄斑区水肿、渗出,故DME与肝、脾两脏密切相关。陈向东教授基于“血水同治”理论,在四物汤的基础上,创立以疏肝健脾、活血利水为治法的中药汤剂益肝明目汤,该方由柴胡、当归、白芍、川芎、丹参、密蒙花、茯苓、泽泻、车前子、蒺藜、茺蔚子、决明子组成。柴胡疏肝解郁、疏畅气机为君;密蒙花养肝明目,蒺藜平肝明目、疏肝解郁,车前子明目、利水渗湿,决明子清肝明目,四药共助君药以达益肝明目之效;当归、白芍养血柔肝、健脾调肝为臣;茺蔚子、川芎活血行气,丹参活血祛瘀,茯苓、泽泻利水渗湿,共为佐药;方中川芎为血中之气药,协诸药上行直达病所。诸药合用,共奏疏肝健脾、活血利水之功。临床研究发现,益肝明目汤能有效减轻视网膜水肿,改善患者视力,具有远期疗效稳定的优势[9-10]。现代药理研究表明,柴胡-白芍合用可协同抗炎[15-16],且柴胡皂苷能减轻DR大鼠视网膜微血管炎症及通透性[17];当归具有刺激胰岛素分泌、降糖、抗炎的作用[18],可抑制VEGF及新生血管的生成[19];丹参提取物具有抗炎、抗氧化作用[20],可抑制人视网膜血管内皮细胞凋亡及新生血管的形成[21];密蒙花能抗VEGF、抑制视网膜神经节细胞凋亡及新生血管生成[22];川芎、泽泻能抗炎[23-24];茯苓、车前子、决明子可降糖、抗炎[25-27];蒺藜具有保护视网膜、视神经的作用[28];茺蔚子可抗炎、抗氧化、保护神经[29]。本研究FFA结果显示,模型组大鼠眼底模糊,视网膜血管走行迂曲,有散在微血管瘤及少许点状强荧光;HE染色见模型组大鼠视网膜各层细胞排列紊乱稀疏,视网膜色素上皮层变薄,内丛状层、内核层、外核层松散,结构紊乱,视网膜厚度增加。经药物干预后各组大鼠血糖、体质量、视网膜水肿、视网膜各层组织结构均有所改善,提示益肝明目汤能降低DME大鼠血糖、稳定体质量、减轻视网膜病理损伤及水肿,与临床研究结果相似[9-10]。
细胞焦亡又称细胞炎性坏死,其特征为炎性 Caspase激活导致细胞膜成孔、透化,细胞肿胀,直至胞膜破裂,最终导致细胞内容物释放,继而引起强烈的炎症反应[30]。DME的发生、发展伴随着高血糖及慢性炎症,在高血糖及炎症刺激下,NOD样蛋白受体被激活,如NLRP1、NLRP3等,通过ASC,与募集而来的Caspase-1前体结合形成NLRP3炎性复合物,进而活化Caspsae-1[31-32],有活性的Caspase-1 可对执行蛋白GSDMD的N端和C端结构域进行切割,活化的N-结构域可促进细胞膜形成亲水性孔道,导致细胞膨胀裂解,释放出IL-1β和IL-18,进而吸引更多的炎性细胞,加重炎症反应,导致组织水肿[33-34]。研究证实,糖尿病大鼠视网膜中NLRP3、ASC、Caspase-1蛋白及其下游成熟分子IL-1β、IL-18的表达增加[35-37],DR患者的玻璃体及手术切除的增殖膜中NLRP3、Caspase-1、IL-18也呈高表达[38],且水平高低与DR进展程度呈正相关[39],证实了NLRP3炎症小体激活诱发的炎症反应在DR及DME發展进程中的重要作用。本研究发现,模型组大鼠视网膜组织NLRP3、ASC、Caspase-1蛋白及血清炎症因子IL-1β、IL-18表达水平均显著升高,表明糖尿病视网膜水肿大鼠视网膜组织存在细胞焦亡;与模型组比较,各干预组均能在不同程度上抑制NLRP3、ASC、Caspase-1蛋白表达,减少血清炎症因子IL-1β、IL-18释放,表明益肝明目汤可通过抑制NLRP3、ASC、Caspase-1蛋白表达,减少NLRP3炎症小体的形成,进而减少炎症因子IL-1β、IL-18的释放,减轻视网膜损伤。
综上所述,益肝明目汤可能通过抑制NLRP3炎症小体的激活,抑制NLRP3、ASC、Caspase-1蛋白表达及炎症因子IL-1β、IL-18释放,改善视网膜组织炎症状态,减轻视网膜病理损伤,减轻视网膜水肿,从而改善视网膜功能,延缓DME进展。
参考文献
[1] AMOAKU W M, GHANCHI F, BAILEY C, et al. Diabetic retinopathy and diabetic macular oedema pathways and management: UK Consensus Working Group[J]. Eye, 2020, 34(1): 1-51.
[2] CECILIA O M, JOS?魪 ALBERTO C G, JOS?魪 N P, et al. Oxidative stress as the main target in diabetic retinopathy pathophysiology[J]. Journal of Diabetes Research, 2019, 2019: 8562408.
[3] CAO Z H, HUANG D, TANG C F, et al. Pyroptosis in diabetes and diabetic nephropathy[J]. International Journal of Clinical Chemistry, 2022, 531: 188-196.
[4] YU Z W, ZHANG J, LI X, et al. A new research hot spot: The role of NLRP3 inflammasome activation, a key step in pyroptosis, in diabetes and diabetic complications[J]. Life Sciences, 2020, 240: 117138.
[5] TANG L, XU G T, ZHANG J F. Inflammation in diabetic retinopathy: Possible roles in pathogenesis and potential implications for therapy[J]. Neural Regeneration Research, 2023, 18(5): 976-982.
[6] MA H Y, LI J Q. The ginger extract could improve diabetic retinopathy by inhibiting the expression of e/iNOS and G6PDH, apoptosis, inflammation, and angiogenesis[J]. Journal of Food Biochemistry, 2022, 46(5): e14084.
[7] LI A S, VEERAPPAN M, MITTAL V, et al. Anti-VEGF agents in the management of diabetic macular edema[J]. Expert Review of Ophthalmology, 2020, 15(5): 285-296.
[8] 王園园,赵齐园,相 旭,等.玻璃体腔注射不同药物在糖尿病性黄斑水肿中的研究现状[J].当代医学,2022,28(18):187-190.
[9] 陈向东,覃艮艳,张又玮,等.益肝明目汤治疗糖尿病黄斑水肿的疗效分析[J].湖南中医药大学学报,2016,36(6):71-73.
[10] 陈向东,张又玮,覃艮艳,等.自拟益肝明目汤治疗黄斑囊样水肿验案举隅[J].湖南中医杂志,2017,33(2):79-80.
[11] 陈向东,孙淑铭,聂辅娇,等.链脲佐菌素诱导Brown Norway大鼠糖尿病视网膜病变模型的建立[J].中医药导报,2018,24(18):15-19.
[12] 符超君,凌艳君,颜家朝,等.双丹明目胶囊对糖尿病视网膜病变大鼠视网膜Ras-Raf-1-MEK-ERK通路的调控作用[J].湖南中医药大学学报,2018,38(7):728-731.
[13] 陈 奇.中药药理研究方法学[M].2版.北京:人民卫生出版社,2006:1261-1263.
[14] PI S H, WANG B J, JIA Y L, et al. Characterization of retinal structural and vascular pathologies in Royal College of Surgeons rat using visible-light OCT[J]. Investigative Ophthalmology & Visual Science, 2021, 62(8): 297.
[15] 杨山景,封安杰,孙 越,等.白芍总苷的药理作用及机制研究进展[J].中国现代应用药学,2021,38(13):1627-1633.
[16] 李月阳,雷根平,董 盛,等.柴胡的现代药理作用研究进展[J].海南医学院学报,2022,28(22):1748-1754.
[17] 司长峰,卜 荔,徐 楠,等.柴胡皂苷D对糖尿病视网膜病变大鼠的治疗作用[J].眼科新进展,2021,41(10):925-929.
[18] 任伟钰,郑宜鋆,张月梅,等.当归多糖药理作用的研究进展[J].时珍国医国药,2020,31(10):2484-2487.
[19] 刘 琳,柴志勇,刁云辉,等.当归多糖对氧化型低密度脂蛋白诱导的血管内皮细胞损伤的保护作用研究[J].中国临床药理学杂志,2020,36(7):818-821.
[20] 赵全如,谢晓燕.丹参的化学成分及药理作用研究进展[J].广东化工,2021,48(1):57-59.
[21] 权联姣,秦婧婧,权元鼎.丹参提取物抑制高糖诱导的人视网膜血管内皮细胞凋亡的机制研究[J].临床内科杂志,2020,37(5):371-374.
[22] ZHU J J, SUN H, KANG X L, et al. Acidic polysaccharides from Buddleja officinalis inhibit angiogenesis via the Nrf2/ARE pathway to attenuate diabetic retinopathy[J]. Food & Function, 2022, 13(17): 9021-9031.
[23] 夏青松,孔靖玮,李德顺,等.不同配比当归-川芎药对的抗炎、镇痛作用实验研究[J].湖北中医药大学学报,2015,17(6):1-4.
[24] 顾云龙,李兆健.泽泻功用的本草考证及现代研究进展[J].中医药导报,2021,27(11):137-141.
[25] 马艳春,范楚晨,冯天甜,等.茯苓的化学成分和药理作用研究进展[J].中医药学报,2021,49(12):108-111.
[26] HUONG D T V, GIANG P M, HOANG D H, et al. Chemical composition and pharmacological activities of Plantago major L. in Vietnam[J]. Asian Journal of Chemistry, 2021, 33(2): 314-318.
[27] DHATWALIA J, KUMARI A, VERMA R, et al. Phytochemistry, pharmacology, and nutraceutical profile of Carissa species: An updated review[J]. Molecules, 2021, 26(22): 7010.
[28] 郝菲菲,张东蕾,何 伟.中药蒺藜在眼科疾病治疗中的应用[J].实用中医内科杂志,2020,34(6):113-117.
[29] 舒朋华,罗跃辉,刘婉蓉,等.茺蔚子化学成分与药理作用的研究进展[J].中华中医药学刊,2022,40(7):39-43.
[30] 王启芝,刘 敏,刘 雨,等.细胞焦亡分子机制及其相关疾病中医药研究进展[J].中国中医药信息杂志,2020,27(12):140-144.
[31] CHEN M N, RONG R, XIA X B. Spotlight on pyroptosis: Role in pathogenesis and therapeutic potential of ocular diseases[J]. Journal of Neuroinflammation, 2022, 19(1): 183.
[32] RIAZ M, REHMAN A U, SHAH S A, et al. Predicting multi-interfacial binding mechanisms of NLRP3 and ASC pyrin domains in inflammasome activation[J]. ACS Chemical Neuroscience, 2021, 12(4): 603-612.
[33] GU J L, GENG K, GUO M, et al. Targeting pyroptosis: New insights into the treatment of diabetic microvascular complications[J]. Evidence-Based Complementary and Alternative Medicine, 2022, 2022: 5277673.
[34] AIZAWA E, KARASAWA T, WATANABE S, et al. GSDME-dependent incomplete pyroptosis permits selective IL-1α release under caspase-1 inhibition[J]. iScience, 2020, 23(5): 101-120.
[35] GE K K, WANG Y T, LI P, et al. Down-expression of the NLRP3 inflammasome delays the progression of diabetic retinopathy[J]. Microvascular Research, 2022, 139: 104265.
[36] KUO C Y, MARAN J J, JAMIESON E G, et al. Characterization of NLRP3 inflammasome activation in the onset of diabetic retinopathy[J]. International Journal of Molecular Sciences, 2022, 23(22): 14471.
[37] KONG H, ZHAO H R, CHEN T R, et al. Targeted P2X7/NLRP3 signaling pathway against inflammation, apoptosis, and pyroptosis of retinal endothelial cells in diabetic retinopathy[J]. Cell Death & Disease, 2022, 13(4): 336.
[38] GUO Y, SUN Z C, WANG L, et al. Increased expression of TSPO-VDAC complex is correlated with NLRP3 inflammasome activation in diabetic retinopathy[J]. Molecular Medicine Reports, 2022, 26(6): 353.
[39] CHEN H, ZHANG X Z, LIAO N Y, et al. Enhanced expression of NLRP3 inflammasome-related inflammation in diabetic retinopathy[J]. Investigative Ophthalmology & Visual Science, 2018, 59(2): 978-985.
〔收稿日期〕2022-11-15
〔基金项目〕湖南省中医药科研计划课题项目(201917);湖南省中医药科研计划项目(C2022003,E2022044);湖南省自然科学基金面上项目(2021JJ30520);長沙市自然科学基金项目(kq2014226);湖南省教育厅科学研究项目(19A362);湖南中医药大学中医学一流学科开放基金项目(2018ZYX60);湖南中医药大学研究生创新课题项目(2021CX76)。
〔第一作者〕廉艺童,男,硕士研究生,研究方向:眼底病的防治与研究。
〔通信作者〕*陈向东,男,博士,教授,博士研究生导师,E-mail:564259166@qq.com。

