高效阴离子离子色谱-脉冲安培法测定食品中透明质酸钠含量
朱鸿达,张松艳,陈自猷
(泉州海关综合技术服务中心,福建 泉州 362000)
0 引言
透明质酸(hyaluronic acid, HA),又名玻璃酸、玻尿酸,是一种以d-葡萄糖醛酸和n-乙酰氨基葡萄糖胺为双糖单位交替连接而成的直链线性阴离子粘多糖。HA 最早是由美国科学家从牛眼玻璃体中分离得到,因其具有良好的润滑性、保湿性和黏弹性,并具有极佳的生物相容性[1-4]。我国于2008 年批准透明质酸钠为新资源食品,使用范围为保健食品原料。2021 年1 月7 日,国家卫健委正式批准透明质酸钠(即透明质酸、玻尿酸)为新食品原料,可在普通食品中添加使用,目前为止我国还没有针对食品中透明质酸钠检测方法和标准[5-6]。由于透明质酸本身溶解性较差,在使用时常将其转化为钠盐,即透明质酸钠(sodium hyaluronate, SH)。SH 是一种白色粉末状固体,有时也呈纤维状,具有较好的保湿性,能溶于水,不溶于乙醚、丙酮和乙醇等有机溶剂,无臭味,是一种链状的天然高分子多糖类物质,目前已被广泛应用于多个领域[7-10],因此建立其准确定量分析方法具有重要意义。
目前,测定透明质酸钠含量的方法有:硫酸-咔唑法、CTAB 浊度法、凝胶色谱法、elson-morgan 法、免疫法、共振瑞利散射法等[11-16]。硫酸-咔唑法是用强酸将透明质酸钠降解成葡糖醛酸,葡糖醛酸与咔唑反应形成有机络合物并显示特有的紫色,其吸光度和糖醛酸的浓度成正比,通过葡萄糖醛酸的含量来确定透明质酸钠的含量。CTAB 浊度法测定发酵液中透明质酸钠的含量是利用HA 可同(CTAB)等阳离子表面活性剂发生络合反应,产生混浊现象,并在一定浓度范围内遵循朗伯-比尔定律,但该方法的缺点是不适合实时检测。利用凝胶色谱法测定透明质酸钠含量,该方法操作复杂,分析速度慢,价格昂贵,对人员操作水平要求高。此外,调查发现,目前常用的SH 含量测定方法主要是通过降解后显色,结合可见-紫外分光光度计,根据吸光度测定其中葡萄糖醛酸或者氨基葡萄糖的含量,进而推算SH 的含量。这种方法操作比较复杂,条件苛刻,显色剂的引入干扰测定的准确度[17-19]。本文用硼砂作催化剂对透明质酸钠用硫酸进行酸解,将葡萄糖醛酸分离出来。利用高效阴离子离子色谱-脉冲安培法测定葡萄糖醛酸的含量,通过折算系数,确定透明质酸钠的含量。
1 试验部分
1.1 仪器与试剂
ICS5000+ 离子色谱仪(美国DIONEX):配脉冲安培检测器;XS205DU 电子分析天平(梅特勒-托利多仪器上海有限公司);Vortex-6 旋涡混合器(苏州江东精密仪器有限公司);MONET-HH-4 电热恒温水浴锅(上海沐奈实业有限公司);FS1000Y-3 高速粉碎机(昆明雷迈机械设备有限公司);氢氧化钠(上海国药集团);醋酸钠(沪试);硼酸(沪试);硫酸(沪试);葡萄糖醛酸标准品(LMAI Bio):纯度≥98%。
1.2 试验方法
色谱条件:糖分析柱:Dionex CarboPac PA20 Analytical (3 mm×150 mm,6.5 μm), 保 护 柱:CarboPac PA20 Guard (3 mm×30 mm,6.5 μm);淋洗 液:A:NaOH (0.15 mol/L)-NaOAc(0.10 mol/L)+2%乙腈等度洗脱,体积流量:1.0 mL/min;进样体积:25 μL;检测器:脉冲安培检测器,金电极。
1.3 溶液的配置
标准储备液:精确称取20 mg 葡萄糖醛酸标准品,置于100 mL 容量瓶种,加水溶解并定容至刻度,摇匀备用。
标准工作液:根据需要移取适量标准储备液,用水稀释定容,配制浓度分别为1 mg/L、5 mg/L、10 mg/L/、20 mg/L 和50 mg/L 的标准工作液,该溶液临用前现配。
0.025 mol/L 硼砂硫酸液:称取4.77 g 硼砂溶于500 mL 浓硫酸(优级纯)中,保存于密封的玻璃瓶。
1.4 样品处理
准确称取粉碎后的样品1.0 g(精确至0.001 g)至25 mL 离心管中,加入超纯水充分溶解并定容至刻度。准确移取上述溶液1 mL 至5 mL 离心管中,置冰浴中冷却在不断振摇下缓缓滴加入3 mL,0.025 mol/L硼砂硫酸液,用涡旋混合器充分混匀。将其置于沸水加热10 min(每隔5min 振摇一次),冷却至室温。将上述酸解液转移至100 mL 容量瓶中,用纯水定容。经滤纸过滤,滤液备用,同时做空白样。
2 检测分析
2.1 色谱分离
对巧克力、牛奶等样品进行酸解后,借鉴中性单糖的离子色谱分析方法,考虑到羧基对酸性单糖在阴离子分析柱上的洗脱,采用NaOH-NaOAc 体系淋洗液进行等度洗脱,在流动相中添加适量有机溶解(2%乙腈),可以抑制菌类的生长,还可以减少有机杂质在色谱柱上的保留,从而延长色谱柱的使用寿命[5]。实验结果表明:此方法快速有效,在10 min 内可较好实现葡萄糖醛酸和中性单糖及其他酸性糖的分离。
2.2 结果计算与表述
由线性方程计算葡萄糖醛酸的含量,透明质酸钠含量按式(1)计算:
式中:X为样品中透明质酸钠的含量(mg/kg);C为从标准工作曲线上查得的对应葡萄糖醛酸的质量浓度(mg/L) ;2.067 5 为透明质酸钠重复双糖单元质量(401.3)与葡萄糖醛酸相对分子质量的比值(194.1);V为试样溶液定容体积(mL);m为试样溶液所代表的质量(g)。
2.3 精密度与准确度
按照试验方法,对巧克力、饮料样品进行低、中、高3 个浓度的加标回收试验,每个浓度水平测定5 次,计算回收率和RSD。试验结果表明,该方法回收率在86.0%~120.0%,RSD 在1.5%~4.0% 之间,证明该方法精密度和准确度较高。

表1 精密度和加标回收试验(n=5)
2.4 标准曲线、检出限与定量限
对一空白样品连续平行测定11 次,检出限按公式LOD=3×σ/S(其中σ为空白标准偏差,S为校正曲线斜率)计算,并以3 倍检出限,作为定量限[7-9]。结果为:当线性范围为1~50 mg/L,线性回归方程:Y=0.022 1X-0.000 7,R2=0.999 6。检出限为3.2 μg/kg,定量限为10 μg/kg。
3 色谱条件优化
3.1 淋洗液的选择
对巧克力、饮料等样品进行酸解后,色谱柱采用CarboPac PA20 Guard(3 mm×30 mm,6.5 μm)。采用3 种不同体系淋洗液进行等度洗脱(淋洗液1:含0.15 mol/L 的NaOH 和0.10 mol/L 的NaOAc 的 水溶液;淋洗液2:含0.15 mol/L 的NaOH 的水溶液;淋洗液3:含0.4 mol/L NaH2PO4的水溶液),在流动相中添加适量有机溶解(2% 乙腈)。在其他色谱条件完全相同情况下,3 种不同体系淋洗液实验结果表明:采用淋洗液1 洗脱具有比其他淋洗液更好的分离效果,分离度如表2 所示。
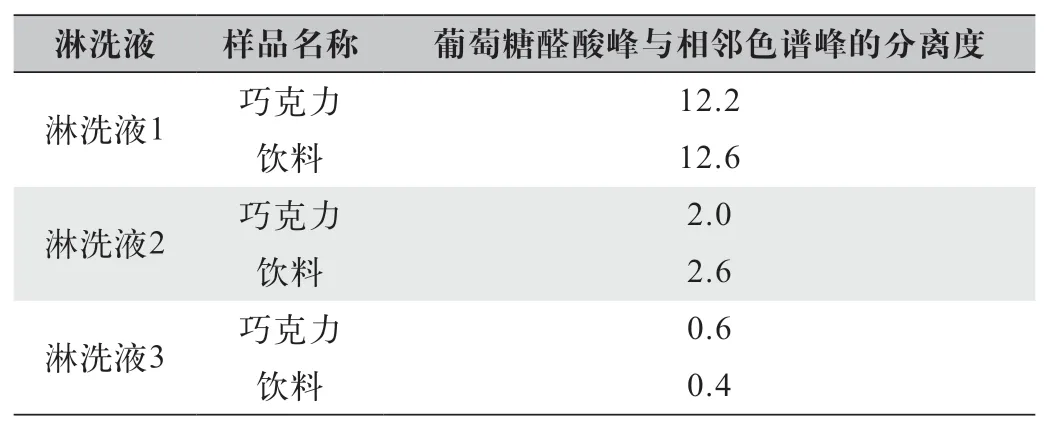
表2 各样品的葡萄糖醛酸峰与相邻色谱峰的分离度
3.2 色谱柱选择
色谱柱分别采用色谱柱1:CarboPac PA1 Analytical Column (4 mm×250 mm))和 色 谱 柱2:Dionex CarboPac PA10,色谱柱3:Dionex CarboPac PA20 Analytical (3 mm×150 mm,6.5 μm)。其余实验条件相同。实验结果:色谱柱1、色谱柱2 和色谱柱3 均具有较好的分离度,但色谱柱3 分离效果最佳。各色谱柱的分离度如表3 所示。
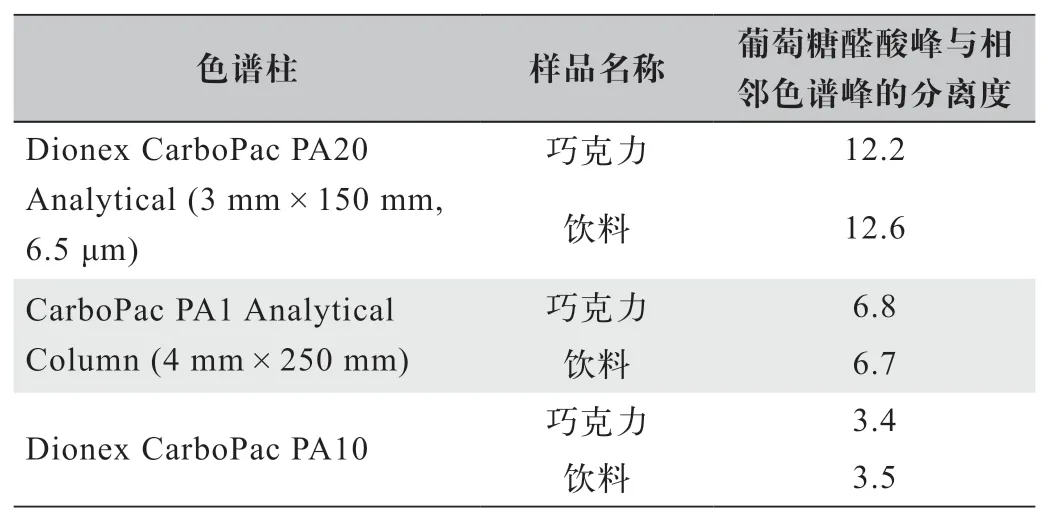
表3 3 种色谱柱的葡萄糖醛酸峰与相邻色谱峰的分离度
4 结果与讨论
(1)本文建立一种基于高效阴离子色谱-脉冲安培法对食品中透明质酸钠含量的快速测定新方法,此方法快速有效,可在10 min 内完成检测。采用糖分析柱:Dionex CarboPac PA20 Analytical (3 mm×150 mm,6.5 μm),淋 洗 液:A:NaOH(0.15 mol/L)-NaOAc(0.10 mol/L)+2% 乙腈等度洗脱,在质量浓度为1~50 mg/L 内具有良好的线性关系,R2=0.999 6,检出限为3.2 μg/kg,定量限为10 μg/kg。采用此方法对巧克力、饮料样品进行加标回收试验,回收率均在86.0%~120%,RSD 在1.5%~3.9%之间,证明该方法精密度和准确度较高,能满足食品中透明质酸检测分析要求。
(2)在流动相中添加适量有机溶解(如2%乙腈),不仅可以抑制菌类的生长,减少有机杂质在色谱柱上的保留,从而延长色谱柱的使用寿命。对某些分析,流动相中加入适量的有机溶剂还可以达到一定的效果。某些离子在添加有机溶剂后保留时间有很大的变化,这样可以将原本无机盐体系无法分析的离子加以分离。

