镉胁迫对伴矿景天细胞壁多糖果胶组分及其果胶甲酯酶的影响
毕莉艳,李元,李博,李明锐,王吉秀,秦丽
(云南农业大学资源与环境学院,昆明 650201)
工业三废的大量排放、大气沉降、污水灌溉、农药和肥料不合理使用等造成我国农田土壤镉(Cd)点位超标率达7.0%,严重影响土壤安全利用和农业生产[1−3]。Cd 是毒性最强的重金属之一,在某些植物中过量积累,干扰植物对必需矿质元素的吸收、运输和利用,造成根系损伤[4]。超累积植物能吸收利用并积累Cd,将其输送并贮存在地上部分。
细胞壁在超累积植物Cd 积累中具有重要作用,细胞壁是阻止重金属进入细胞的第一道屏障。植物细胞壁与Cd2+的结合作用能够减少重金属向细胞内转移,降低其对植物代谢的影响[5]。细胞壁与重金属的结合能力取决于其中羧基(--COOH)、羟基(--OH)和巯基(--SH)等官能团的数量。果胶(主要由半乳糖醛酸组成的酸性多糖)在细胞壁中对Al3+、Cu2+、Cd2+以及其他金属离子的结合和富集起着关键性作用[6]。果胶主要在植物组织的高尔基体中合成,其在发生去甲酯化反应后,分子中含有大量的羧基,为细胞壁提供所需的负电荷,其中果胶甲酯酶(PME)参与了果胶分子的去甲酯化过程[7],在PME 作用下被去甲基化的羧基能够与细胞壁中70%~90%的阳离子结合,含羧基的果胶酸能够与重金属离子牢固结合,降低细胞质中游离态重金属离子浓度[8−9]。
重金属在细胞壁中的积累量与细胞壁果胶含量及其甲基化程度和PME 活性有关。研究表明,果胶酯化程度越高,PME活性越低,果胶对Cd的累积量越少[7]。植物通过改变细胞壁的组成和性质,如果胶的结构、甲基化程度和PME 活性来响应Cd 胁迫[10]。然而,Cd 如何影响超富集植物细胞壁的组成和PME 活性的变化尚不清楚。
本研究以伴矿景天为材料,研究不同浓度Cd 处理对伴矿景天地上部和根部细胞壁果胶含量、PME活性和果胶半乳糖醛酸含量的影响,确定果胶在植物细胞壁Cd2+结合中的作用,并进一步解析伴矿景天地上部和根部Cd 含量与细胞壁果胶多糖变化的关系,以揭示细胞壁果胶多糖组分在伴矿景天Cd累积过程中的作用机制,旨在为Cd 污染土壤的植物修复技术提供科学思路[11]。
1 材料与方法
1.1 供试材料
在伴矿景天幼苗时期,从云南兰坪铅锌矿区采集伴矿景天幼苗,迁移至实验室进行盆栽培养。在迁栽时,挑选长势良好、大小均匀的幼苗开展盆栽试验,每盆种植3株。供试土壤采自云南农业大学后山。土壤类型为山地红壤,将所取土壤与适量底肥混合均匀,备用。该土壤的理化性质如表1所示。

表1 供试土壤理化性质Table 1 Physical and chemical properties of the test soil
1.2 试验设计
盆栽试验在云南农业大学东校区实验棚进行。每盆装土3 kg,进行土壤Cd 处理,将不同浓度的CdCl2(CdCl2∙2.5 H2O 分析纯)溶液喷洒到盆栽试验土中,使土壤与溶液混合均匀,稳定1 周。挑选长势良好、大小均匀的幼苗开展盆栽试验。试验设置6 个不同的Cd 处理浓度:0、25、50、75、100 mg∙kg−1和200 mg∙kg−1,每个处理设5 个重复,共30 盆。在植物种植期间,每两日浇一次水,根据植物的生长和需水状况,适当为其提供充足的水分。120 d 后收获,首先将伴矿景天带回实验室,先用自来水清洗干净,再放入去离子水中浸泡15 min,然后取出晾干,将其分成地上部和根部,分别称量其鲜质量,部分用于提取细胞壁,其余的伴矿景天样品在105 ℃时杀青30 min,然后放入烘箱于75 ℃烘至恒质量。将烘干后的样品取出并用研钵研磨至粉末状,密封保存,装袋备用,用抖土法收集植物根际土样,并带回实验室分析。
1.3 指标测定
1.3.1 Cd含量的测定
植物Cd含量的测定采用HNO3消解−火焰原子吸收分光光度法[12]。
1.3.2 细胞壁的提取
细胞壁的提取参考Zhong等[13]的方法进行。将收获后的伴矿景天用液氮进行冷冻处理,放置在−80 ℃冰箱中保存。将冷冻保存的伴矿景天的根系和地上部分取出,放入研钵加液氮进行研磨,转移至离心管中,加入75%的冰乙醇浸没混匀,浸提3次,每次冰乙醇的用量为10 mL∙g−1。混合物静置20 min 后于4 ℃下5 000×g离心10 min,去上清液后沉淀物再依次用鲜质量与体积比为1∶7(g∙mL−1)的冰丙酮、甲醇/氯仿(1∶1)混合液和甲醇溶液洗涤。每次洗涤后悬浮静置10 min,于4 ℃下5 000×g离心10 min,将得到的沉淀物进行冷冻干燥处理,即可得到细胞壁,放置4 ℃冰箱中备用。
1.3.3 细胞壁果胶甲酯酶提取和活性测定
PME 的提取参照Bordenave 等[14]的方法。样品加提取缓冲液(0.1 mol∙L−1柠檬酸,0.2 mol∙L−1Na2HPO4,1 mol∙L−1NaCI,pH 值为5.0)在研钵中充分研磨并置于离心管中充分振荡,匀浆被转移到离心管放于冰上1 h,振荡3次,间隔20 min 后,于4 ℃15 000×g离心10 min,收集上清液待测。
PME 活性的测定参考Richard 等[15]的方法进行。取上述样品液200µL 加入到10 mL PME 分析缓冲液[0.5%(m/V)柑橘果胶,0.2 mol∙L−1NaCl,0.015%(m/V)甲基红,pH 值为6.8]中,37 ℃温水浴1.5 h,果胶pH 值降低发生脱脂,颜色由黄色变成红色。分别将0、100、150、200、250、290µL 的0.01 mol∙L−1HCl 加入到10 mL PME 分析缓冲液中,绘制标准曲线。由样品在525 nm 波长处测得的吸光值得到相应的H+浓度,由此可以算出果胶甲酯酶活性。
1.3.4 伴矿景天细胞壁果胶的提取和含量的测定
细胞壁果胶的提取参考Zhang 等[16]的方法进行。将20 mL 0.5%草酸铵缓冲液(内含0.1%NaHB4)加入至0.000 5 g 细胞壁样品中,沸水中煮沸1 h,10 000×g离心5 min,取上清液,重复一次,将两次的上清液混合,测量体积,上清液即为总果胶。
A:细胞壁在70 ℃烘干,用研钵研碎,称取0.01 g的细胞壁样品于50 mL离心管中,加入10 mL 0.5 mol∙L−1咪唑溶液(pH 7.0)常温振荡24 h,5 000×g离心后取上清液。再用提取液离心洗涤2~3 次后合并上清液,测量体积,可计算出鳌合态果胶含量[17]。
B:将A步取上清液所留沉淀用超纯水离心冲洗2次,然后加入10 mL 50 mmol∙L−1Na2CO3(内含20 mmol∙L−1CDTA)提取碱性果胶,方法同螯合态果胶提取。
1.3.5 伴矿景天细胞壁果胶半乳糖醛酸测定
果胶中糖醛酸含量参考Willats 等[18]、宾文等[19]的方法测定。称取0.1 g 干燥的半乳糖醛酸,在100 mL容量瓶中加水定容,混匀,制成1 mg∙mL−1标准溶液。比色管中倒入0、0.05、0.15、0.30、0.45、0.60 mL 和0.75 mL 标准溶液,用水稀释至10 mL,取上述标准溶液各1 mL 冰浴10 min,加入硫酸−硼酸盐溶液振荡30 s,样品煮沸5 min,冷却后加入0.1 mL 0.15%间二苯酚显色,充分振荡。静置20 min 后在525 nm 测量吸光度,绘制标准曲线。取果胶样品进行上述操作,依据标准曲线计算其细胞壁果胶半乳糖醛酸含量。
1.4 数据计算与处理
富集系数=植物体内Cd含量/土壤Cd含量
转运系数=植物地上部Cd含量/地下部Cd含量
有效转运系数=(植物地上部Cd 含量×植物地上部生物量)/(地下部Cd含量×植物地下部生物量)
数据采用Excel 计算平均值和标准差,用Origin制图,并利用SPSS 17.0 进行差异显著性检验和相关性分析。
2 结果与分析
2.1 伴矿景天细胞壁果胶含量的变化
2.1.1 伴矿景天细胞壁中鳌合态果胶含量
如图1 所示,伴矿景天地上部的螯合态果胶含量在不同Cd 处理浓度下均大于根部。随着Cd 处理浓度的升高,伴矿景天植物地上部和地下部的螯合态果胶含量总体表现出先增加后减少的趋势,在Cd 处理浓度为0~100 mg∙kg−1范围内呈现增长趋势,地上部和地下部的螯合态果胶含量在100 mg∙kg−1Cd处理浓度时同时达到最高,与对照相比分别显著增加了32.7%和34.6%,且各Cd 浓度处理与对照均差异显著(P<0.05);在100~200 mg∙kg−1Cd 处理浓度范围内呈现递减趋势。总的来说,不同Cd处理浓度下,伴矿景天地上部和根部细胞壁螯合态果胶含量均显著高于对照。
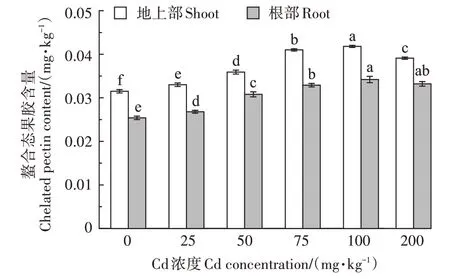
图1 不同浓度Cd处理对伴矿景天细胞壁螯合态果胶含量的影响Figure 1 Effects of different concentrations of Cd on the content of chelated pectin in the cell wall of S.plumbizincicola
2.1.2 伴矿景天细胞壁碱性果胶含量
如图2 所示,除25 mg∙kg−1Cd 处理浓度外,伴矿景天地上部和根部细胞壁碱性果胶含量均显著高于对照。与对照相比,4个Cd处理浓度下地上部碱性果胶含量分别增加了27.9%、30.4%、30.9%、25.0%;根部碱性果胶含量分别增加了15.0%、16.7%、17.6%、13.0%。随着Cd浓度的上升,伴矿景天地上部和根部的碱性果胶含量总体呈现先增加后减少的趋势,在Cd 处理浓度为0~100 mg∙kg−1范围内呈现增长趋势,并在100 mg∙kg−1Cd处理浓度时地上部和根部的碱性果胶含量均达到最大值,分别为0.026 mg∙kg−1和0.028 mg∙kg−1;在100~200 mg∙kg−1Cd 处理浓度范围内呈现递减趋势。总的来说,伴矿景天地上部细胞壁碱性果胶含量在不同Cd处理浓度下均小于根部。
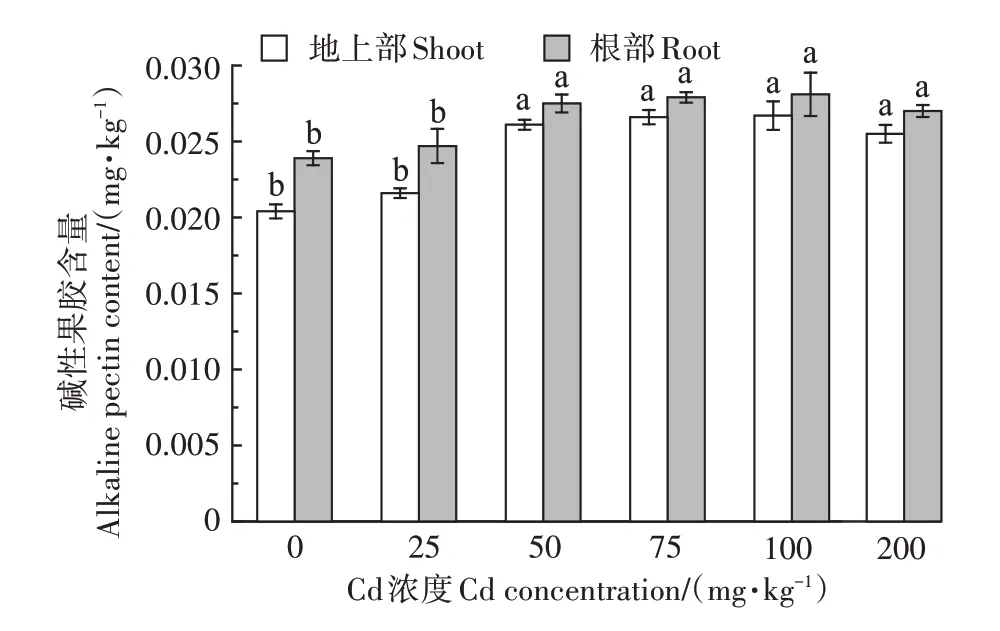
图2 不同浓度Cd处理对伴矿景天细胞壁碱性果胶含量的影响Figure 2 Effects of different concentrations of Cd on alkaline pectin content in the cell wall of S.plumbizincicola
2.2 伴矿景天细胞壁果胶甲酯酶活性的变化
伴矿景天细胞壁果胶甲酯酶活性的变化如图3所示,从地上部果胶甲酯酶活性来看,在Cd处理浓度为25 mg∙kg−1和75 mg∙kg−1时,PME 活性与对照相比分别显著增加了40.4%和27.6%。在Cd 处理浓度为25 mg∙kg−1时,PME 活性最大;在200 mg∙kg−1Cd 浓度下,PME 活性最小。由图3 可以看出,除了Cd 处理浓度为50 mg∙kg−1外,其他Cd处理伴矿景天细胞壁PME活性与对照差异显著(P<0.05);从根部果胶PME 活性来看,随着Cd 处理浓度的增加,PME 活性逐渐降低,与对照相比,分别减少了11.6%、11.0%、17.6%、22.3%和59.2%,且在Cd 处理浓度为75、100 mg∙kg−1和200 mg∙kg−1时,PME 活性与对照组间差异显著(P<0.05)。
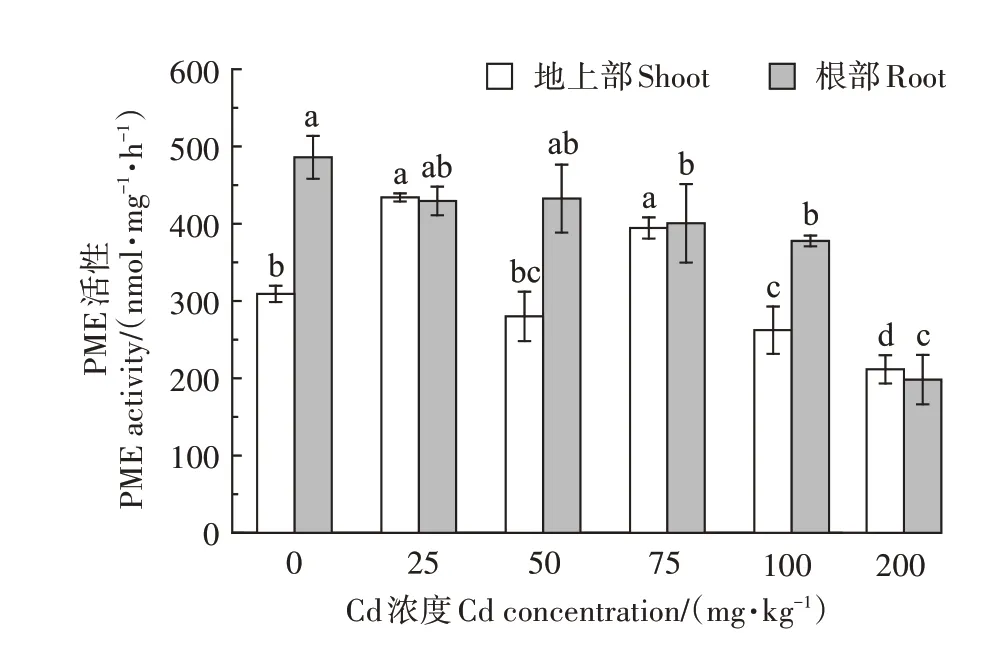
图3 不同Cd浓度处理下伴矿景天细胞壁PME活性的变化Figure 3 Changes in cell wall PME activity of S.plumbizincicola under different concentrations of Cd stress
2.3 伴矿景天细胞壁果胶半乳糖醛酸含量变化
由图4 可知,相同Cd 浓度下伴矿景天地上部半乳糖醛酸含量比根部低。随着Cd 处理浓度的增加,地上部细胞壁果胶半乳糖醛酸含量先增加后降低,且细胞壁果胶半乳糖醛酸含量在Cd 浓度25 mg∙kg−1时达到最大值,与对照相比增加了39.2%;根部细胞壁果胶半乳糖醛酸含量呈现相同趋势,同样在Cd 浓度25 mg∙kg−1时达到最大值,与对照相比增加了1.1%。这可能是由于植物在受到高浓度Cd 胁迫时,植株内的Cd结合所需要的半乳糖醛酸更多。
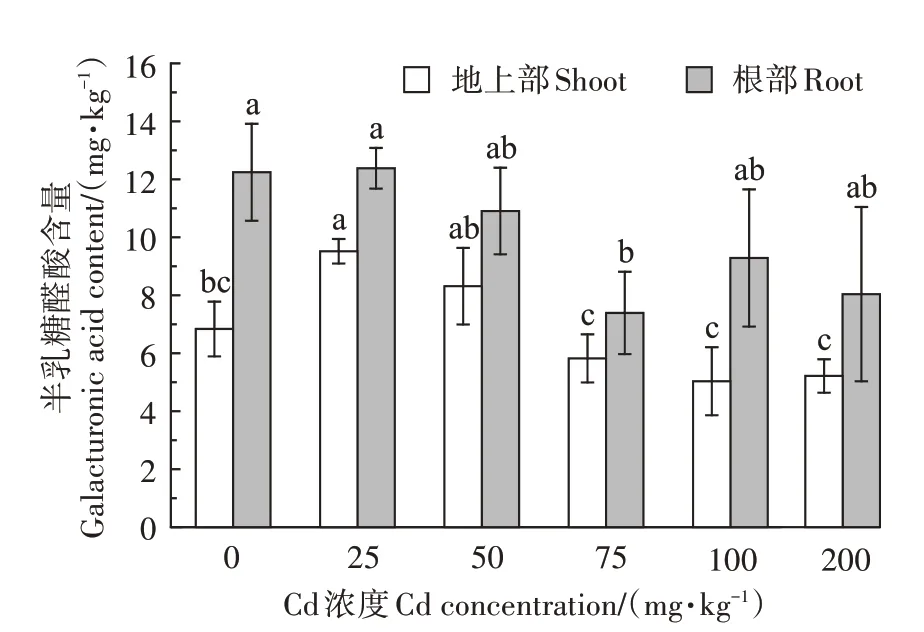
图4 不同Cd浓度处理下伴矿景天体内半乳糖醛酸含量Figure 4 Contents of galacturonic acid in S.plumbizincicola under different Cd concentrations
2.4 伴矿景天Cd累积特征
从图5 可知,随着Cd 处理浓度的增加,伴矿景天地上部和根部Cd 含量均呈先增加后减少的趋势,而且地上部Cd含量明显高于根部。从伴矿景天地上部Cd 含量来看,各处理Cd 含量与对照相比均显著增加,分别增加了17.2、40.0、58.4、49.1倍和47.4倍,且植物地上部Cd含量除在100 mg∙kg−1和200 mg∙kg−1处理间无显著差异外,其他Cd浓度处理间均存在显著差异(P<0.05)。从伴矿景天根部Cd 含量来看,各处理Cd含量与对照相比均显著增加,分别增加了36.4、41.7、70.1、21.5倍和39.3倍。在75 mg∙kg−1Cd处理浓度时,地上部和地下部的Cd含量都达到最大值。由此可见,伴矿景天是一种Cd积累能力较强的植物,能够较好地吸收和转运土壤中的Cd,但Cd主要积累在地上部,根部累积量较少。
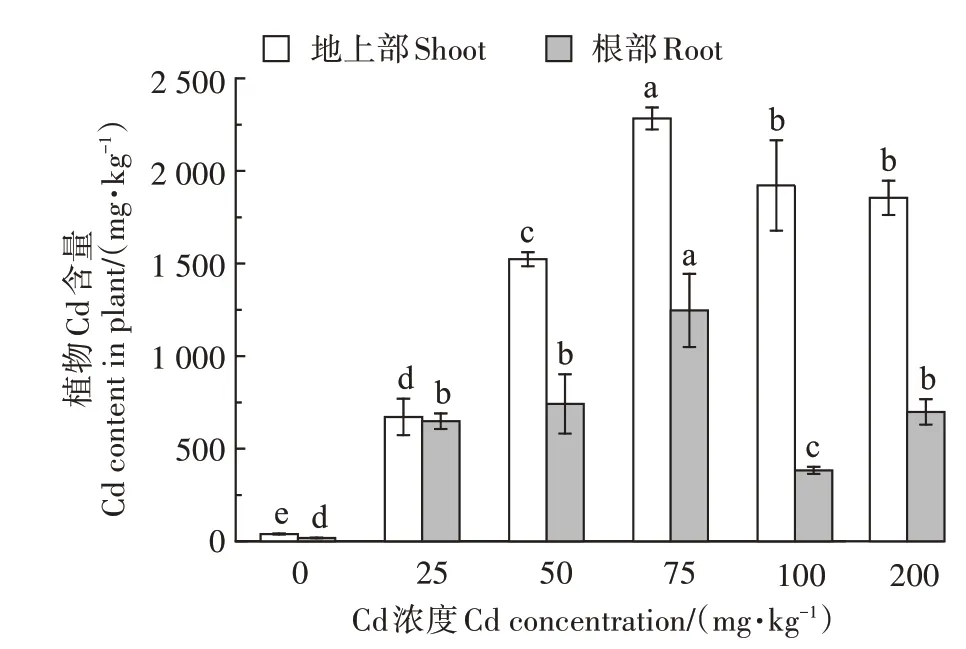
图5 不同Cd浓度处理下伴矿景天体内Cd含量Figure 5 Cd content in S.plumbizincicola under different Cd concentrations
由表2 可知,伴矿景天地上部生物量随Cd 处理浓度的增加呈先增加后减少的趋势。与对照相比,50、75 mg∙kg−1Cd 处理地上部生物量分别增加了4.9%、22.5%,Cd 处理浓度为100、200 mg∙kg−1时地上部生物量分别降低了6.9%、58.9%。Cd 处理浓度为75 mg∙kg−1时地上部生物量达到最大值,浓度为200 mg∙kg−1时降至最小值,且在Cd 处理浓度为25、75、200 mg∙kg−1时与对照之间存在显著差异(P<0.05)。伴矿景天根部生物量随Cd 处理浓度的增加逐渐降低,与对照相比,分别显著降低了52.9%、49.6%、43.8%、63.6%、78.5%(P<0.05)。由此可见,中低浓度的Cd 可以促进伴矿景天植株生长,中高浓度的Cd 对其生长有一定的抑制作用。

表2 不同Cd浓度处理下伴矿景天生物量(g·株−1)Table 2 Biomass of S.plumbizincicola under different Cd concentrations(g·plant−1)
由表3 可知,伴矿景天富集系数在Cd 处理浓度为50、75、100 mg∙kg−1时,分别为对照的2.1、1.4、3.0倍。而在Cd 处理浓度为25、200 mg∙kg−1时与对照相比降低了23.0%、58.1%,表明在中高Cd 浓度处理时,伴矿景天对Cd具有较强的富集能力。伴矿景天转运系数在Cd 处理浓度为100、200 mg∙kg−1时,分别为对照的2.3、1.2 倍,在Cd 处理浓度为25、50、75 mg∙kg−1时与对照相比分别降低了54.5%、4.5%、18.2%,表明高浓度Cd处理能够提高伴矿景天从根部向地上部转运Cd 的能力,中低浓度Cd 处理减少了Cd 向地上部的转运。伴矿景天有效转运系数除在Cd处理浓度为25 mg∙kg−1时与对照相比是降低的,其余Cd浓度处理下与对照相比均是增加的。
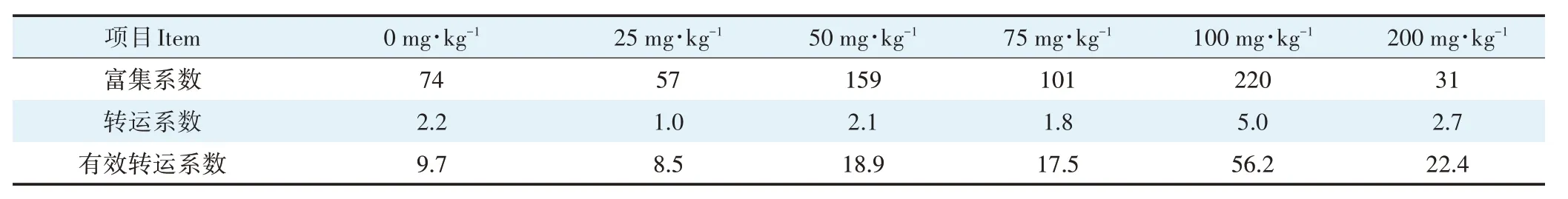
表3 不同Cd浓度处理下伴矿景天Cd累积特征Table 3 Cd accumulation characteristics of S.plumbizincicola under different Cd concentrations
2.5 相关性分析
由表4 可知,伴矿景天植株Cd 含量与细胞壁螯合态果胶含量呈显著正相关,相关系数分别为0.903和0.881(P<0.05),伴矿景天地上部Cd 含量与细胞壁碱性果胶含量呈极显著正相关(r=0.919,P<0.01);细胞壁碱性果胶含量与螯合态果胶含量之间呈显著正相关,相关系数分别为0.909(P<0.05)和0.952(P<0.01),表明在细胞壁对Cd 的累积过程中,果胶含量越高,伴矿景天对Cd 的累积量越大。伴矿景天根部细胞壁螯合态果胶含量与细胞壁果胶半乳糖醛酸含量呈显著负相关(r=−0.880,P<0.05),表明随着螯合态果胶含量的增加,细胞壁果胶半乳糖醛酸含量会降低。
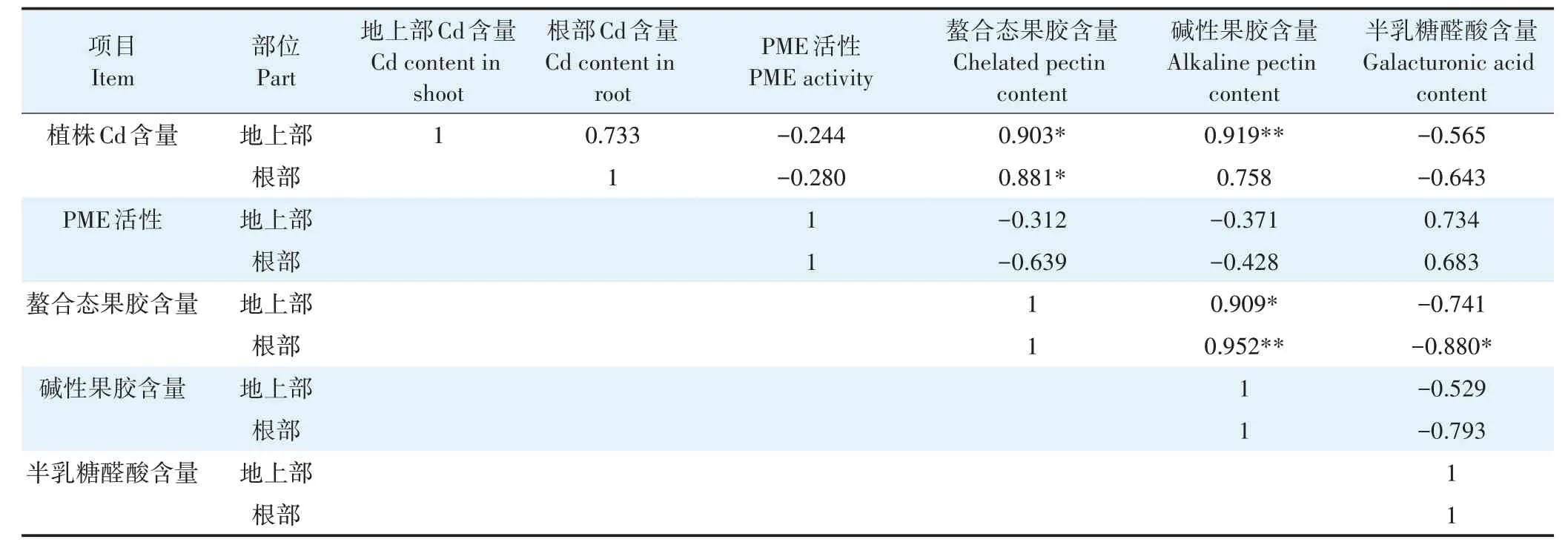
表4 伴矿景天植株Cd含量、PME活性、螯合态果胶含量、碱性果胶含量和半乳糖醛酸含量间的相关性分析Table 4 Correlation analysis of Cd content,PME activity,chelated pectin content,alkaline pectin content and galacturonic acid content of Sedum plumbizincicola
3 讨论
细胞壁是响应重金属胁迫的功能信号分子和代谢所在的位点,参与植物对重金属胁迫的响应过程[20−21]。植物通过改变细胞壁中各种化学成分的含量来提高细胞壁对金属离子的结合量,这是植物细胞壁耐Cd胁迫的一种机制。细胞壁的多糖组分尤其是果胶在固定Cd 方面发挥重要作用,果胶含量的变化可能是植物重金属耐性机理的表征[22]。果胶作为细胞壁的主要成分之一,其含量变化是植物对重金属胁迫的一种响应机制。Cd 胁迫下植物可通过调整果胶含量来增加或减少对重金属的积累。Konno等[23]研究发现,剑叶舌叶藓原丝体细胞壁上的果胶结合了43%的Cu。袁翠红[24]研究发现,果胶的去除使得细胞壁负电荷显著减少,降低了其与阳离子的结合能力,减弱其对重金属离子的抗性;Yu 等[25]的研究表明,果胶的去除使水稻根系吸附Cd 的能力下降了50%。徐劼等[26]研究发现,对芹菜细胞壁进行果胶酶改性处理,可去除根细胞中的部分果胶质,果胶含量降低后,其对Cd 的吸附能力降低了40.5%。在细胞壁果胶组分中,螯合态果胶的含量显著高于碱性果胶,螯合态果胶占果胶组分的绝大部分[27]。在本研究中,随着Cd胁迫浓度的增加,细胞壁螯合态果胶含量和碱性果胶含量增加(图1、图2),植物对Cd 的累积量也增加(图5),且细胞壁螯合态果胶含量高于碱性果胶含量,表明在植物对Cd 的累积过程中,螯合态果胶具有重要作用。
在细胞壁果胶组成中最基本的三种结构是同聚半乳糖醛酸(Homogalacuraonic acid,HG)、聚鼠李糖半乳糖醛酸Ⅰ(RhomnogalacturonanⅠ,RGⅠ)和聚鼠李糖半乳糖醛酸Ⅱ(RhomnogalacturonanⅡ,RGⅡ)[28],其中同聚半乳糖醛酸和聚鼠李糖半乳糖醛酸含有很多负电基团,可以与多种重金属螯合[29]。但在三种果胶结构域中,HG约占果胶多糖的70%,在细胞壁果胶结合重金属过程中发挥重要作用[27]。另外,半乳糖醛酸羧基在甲基转移酶的催化下形成甲基或者甲酯化。高度甲酯化的果胶分泌到细胞壁中,酯基就会被细胞壁内的果胶甲酯酶进行不同程度的去甲酯化,产生游离的羧基,与细胞壁中70%~90%的阳离子结合[30]。在本研究中,低浓度Cd胁迫下伴矿景天细胞壁果胶半乳糖醛酸含量增加,植物Cd含量也随之增加,这是因为细胞壁果胶半乳糖醛酸在PME 的作用下发生酯化反应,产生更多游离的羧基与Cd2+结合。有研究发现,细胞壁果胶中结合铜离子的主要组分为HG,HG可与约40%的铜离子紧密结合,且在低浓度铜处理下,HG含量会增加[23]。这表明细胞壁果胶半乳糖醛酸含量的变化是响应细胞壁对Cd累积的一种机制。
有研究发现,植物细胞壁重金属积累量与果胶的甲酯化程度有关,低酯化的果胶含有较多游离的羧基,可以提供更多重金属离子结合位点,而果胶甲酯化程度与细胞壁果胶甲酯酶活性之间存在密切关系[31−32]。在植物生长过程中,PME 会促使甲酯化果胶上的甲醇基从同聚半乳糖醛酸上脱离,降低果胶甲酯化程度,产生游离的羧基,增加与重金属离子的结合位点[33]。本研究发现,在Cd胁迫下PME 活性降低,果胶含量增加,伴矿景天对Cd的累积量增加,这是因为PME 可以通过影响果胶酯化程度为细胞壁结合重金属离子提供更多的带负电基团来响应Cd 的胁迫。Szerement 等[10]研究发现,Cd 胁迫使萝卜根中果胶甲基酯酶活性降低,果胶含量和果胶甲基化程度增加,植物Cd累积量增加。郭军康等[34]研究发现PME 活性会影响细胞壁果胶的含量,果胶含量增加,PME 活性会降低,植物对Cd的累积量会增加。本研究发现,不同浓度Cd 胁迫下,伴矿景天细胞壁果胶半乳糖醛酸含量先增加后降低,螯合态果胶含量和碱性果胶含量随Cd 处理浓度的增加而增加,根部细胞壁果胶甲酯酶活性逐渐降低。但在低浓度Cd 处理下,伴矿景天细胞壁螯合态果胶含量、碱性果胶含量和细胞壁果胶半乳糖醛酸含量显著增加,其结果与Cd 胁迫下非超积累生态型东南景天和番茄细胞壁果胶含量、褐藻细胞壁中的甘露糖和半乳糖醛酸含量变化一致[22,28,35]。
综上所述,在伴矿景天细胞壁果胶对Cd 的累积过程中,螯合态果胶含量和碱性果胶含量显著增加,而PME 则通过影响果胶发生甲酯化反应,导致半乳糖醛酸结构改变,产生大量游离的羧基,为果胶结合重金属离子提供更多的结合位点,进而增加细胞壁果胶对Cd2+的吸附。
4 结论
(1)伴矿景天地上部和根部细胞壁螯合态果胶、碱性果胶含量以及地上部果胶甲酯酶活性、果胶半乳醛酸含量和根部果胶半乳糖醛酸含量均随着Cd浓度的升高先增加后减少,根部果胶甲酯酶活性与对照相比逐渐降低。
(2)随着Cd 处理浓度的增加,伴矿景天体内Cd累积量先增加后减少,在75 mg·kg−1Cd浓度时累积量达到最高,且地上部Cd累积量高于地下部。
(3)伴矿景天细胞壁螯合态果胶与植物Cd 含量显著正相关,碱性果胶含量与植物地上部Cd 含量呈极显著正相关,伴矿景天根部螯合态果胶含量与果胶半乳糖醛酸含量呈显著负相关。
——α-葡萄糖醛酸酶的研究进展*

