生物标志物EHD3与胃癌中免疫细胞浸润的相关性研究
王源媛,周 妮,王 达,麦 平
(1.江苏大学医学院,江苏镇江 212013;2.甘肃省人民医院消化科,甘肃兰州 730000)
世界范围内每年新增胃癌(STAD)患者约99万人,其中因STAD 去世患者约有73.8 万人,STAD仍然是临床上发病率较高的癌症,常见危险因素有幽门螺旋杆菌(Hp)感染、高龄、高盐以及长期低果蔬饮食等[1-2]。目前STAD 早期诊断标志物CEA、CA19-9、CA72-4、CA125等敏感性和特异性尚不够理想,内镜检查和活检仍然是确诊的主要手段[3]。STAD 患者的中位生存期为16~28.58个月,行根治性手术的患者的5年生存率仅53.0%[4-5]。尽管目前手术是治疗STAD 的唯一方法,但新辅助、辅助治疗、靶向治疗及免疫治疗仍在不断探索[6]。随着高通量分子技术的不断发展,越来越多的免疫治疗检查点被发现,免疫治疗方式是STAD 的新兴研究方案。因此,探索预后生物标志物,提供一个预测患者生存和个体化治疗的标志物尤为重要[7]。EHD3 位于染色体2p23.1上。已有研究表明,EHD3可以调控细胞周期及凋亡,从而抑制胶质瘤的发生发展[8];也有研究报道,EHD3高甲基化可作为结直肠癌的预后标志物[9];同时小细胞肺癌、抑郁症、急性髓系白血病与EHD3的关系也有报道[10-12]。然而,EHD3在STAD中的预后价值尚不清楚,与免疫细胞浸润的关系尚未得到研究。
本研究从UCSC XENA[13]下载TCGA 和GTEx基因表达矩阵,对其预后价值进行评价,探讨EHD3与其免疫应答的关系,拟为个体化治疗带来新视角。
1 材料与方法
1.1 数据收集和整理
下载UCSC XENA(https://xenabrowser.net/datapages/)经Toil流程[14]统一处理的TCGA 和GTEx的TPM 格式的RNAseq 数据,并从中提取TCGA 的STAD 和GTEx中对应的正常组织数据以及泛癌数据,最后将TPM(transcripts per million reads)格式的RNAseq数据进行log2 转化,以备后续进行分析比较。
1.2 差异表达基因(DEGs)分析
本研究利用R 软件(3.6.3版本)中R 包ggplot2(3.3.3版本)进行EHD3差异表达基因分析,同时画出满足|log2(FC)|>1且P.adj<0.05的DEGs的火山图。运用R包DESeq2[15](1.26.0版本)分析得出EHD3高低表达组的DEGs,为基因富集分析准备数据。
1.3 功能富集分析
功能富集分析中包含基因本体(GO)数据库将基因功能分成3类:生物过程(BP)、细胞成分(CC)和分子功能(MF)以及京都基因和基因组百科全书(KEGG)分 析。通 过org.Hs.eg.db 包(3.10.0 版本)用于ID 转换;Cluster Profiler包[16](3.14.3 版本)用于富集分析,将DEGs 的阈值定义为|log2(FC)|>1且P.adj<0.05得到富集结果。
1.4 基因集富集分析
基因集富集分析(GSEA)用一个预先定义的基因集(MSigDB 数据库)(https://www.gsea-msigdb.org/gsea/msigdb/index.jsp)中的基因来探索EHD3高低表达组DEGs的功能和表型。对每个分析将计算次数设置为1 000次,满足FDR(qvalue)<0.05且P.adj<0.05的数据集认为有统计学意义[17]。
1.5 免疫浸润和免疫检查点分析
本研究共纳入24 个免疫细胞[18],采用GSVA包[19](1.34.0 版本)单样本基因集富集分析(ssGSEA)方法分析免疫细胞浸润情况。进一步分析了EHD3与免疫检查点之间的相关性,包括PD-1、PD-L1、CTLA-4、VISTA、TIM-3、LAG-3、TIGIT、CD48[20-22]。
1.6 预测模型开发
采用单因素和多因素Cox 回归分析,评估EHD3能否作为一个独立的预后因素,主要的临床参数包括TNM 分期、年龄以及主要治疗结果,同时制作了1年、3年、5年预测OS的列线图和校准图。通过观察校准图,以对角线作为最佳预测值,判断模型对实际结果预测效果,同时使用一致性指数(C指数)评估列线图的准确性。此过程中主要通过rms包(6.2-0版本)和survival包(3.2-10版本)完成数据分析[23]。最后通过基因表达谱交互分析(GEPIA2)数据分析平台[GEPIA 2(cancer-pku.cn)]分析了STAD 患者中EHD3表达的预后价值。
1.7 统计学分析
所有的统计分析和图表使用R 编程语言(版本3.6.3)进行。分类资料满足理论频数>5且总样本量>40的条件,选用卡方检验;不满足理论频数>5或总样本量>40的条件,选用Fisher精确检验。数值变量资料满足正态分布,选用t检验;不满足正态分布,选用Mann-WhitneyUtest。P<0.05认为差异具有统计学意义。
2 结 果
2.1 EHD3的差异表达分析
比较 来 自UCSC XENA 数 据 库 的TCGA 和GTEx中正常组织和肿瘤样本之间的EHD3表达情况,结果发现,EHD3在STAD 以及大多数类型的癌症中均有明显上调(图1)。此外,在EHD3的高低表达组中共鉴定出2 797 个DEGs,筛选条件设置为|log2(FC)|>1且P.adj<0.05,其中高表达基因数目2 227个,低表达基因数目570个。

图1 EHD3在不同组织样本中的表达Fig.1 Expression of EHD3 in different tissue samples
2.2 EHD3功能富集分析
GO 功能分析和KEGG 富集分析的结果如下。在满足P.adj<0.05且FDR(qvalue)<0.05条件下,BP共有749条,CC共有119条,MF共有81条,KEGG 共有46条。其中BP包括化学突触传递的调节、跨突触信号的调节、肌肉系统过程、膜电位的调节和轴突发生等(图2A);CC 包括含胶原蛋白的细胞外基质、突触膜、神经元胞体、突触前和谷氨酸能突触等(图2B);MF 包括受体配体活性、通道活动、被动跨膜转运蛋白活性、金属离子跨膜转运活性和底物特异性通道活性等(图2C)。KEGG 包括神经活性配体-受体相互作用、PI3K-Akt信号通路、钙信号通路、焦点粘连和c AMP信号通路等(图2D)。
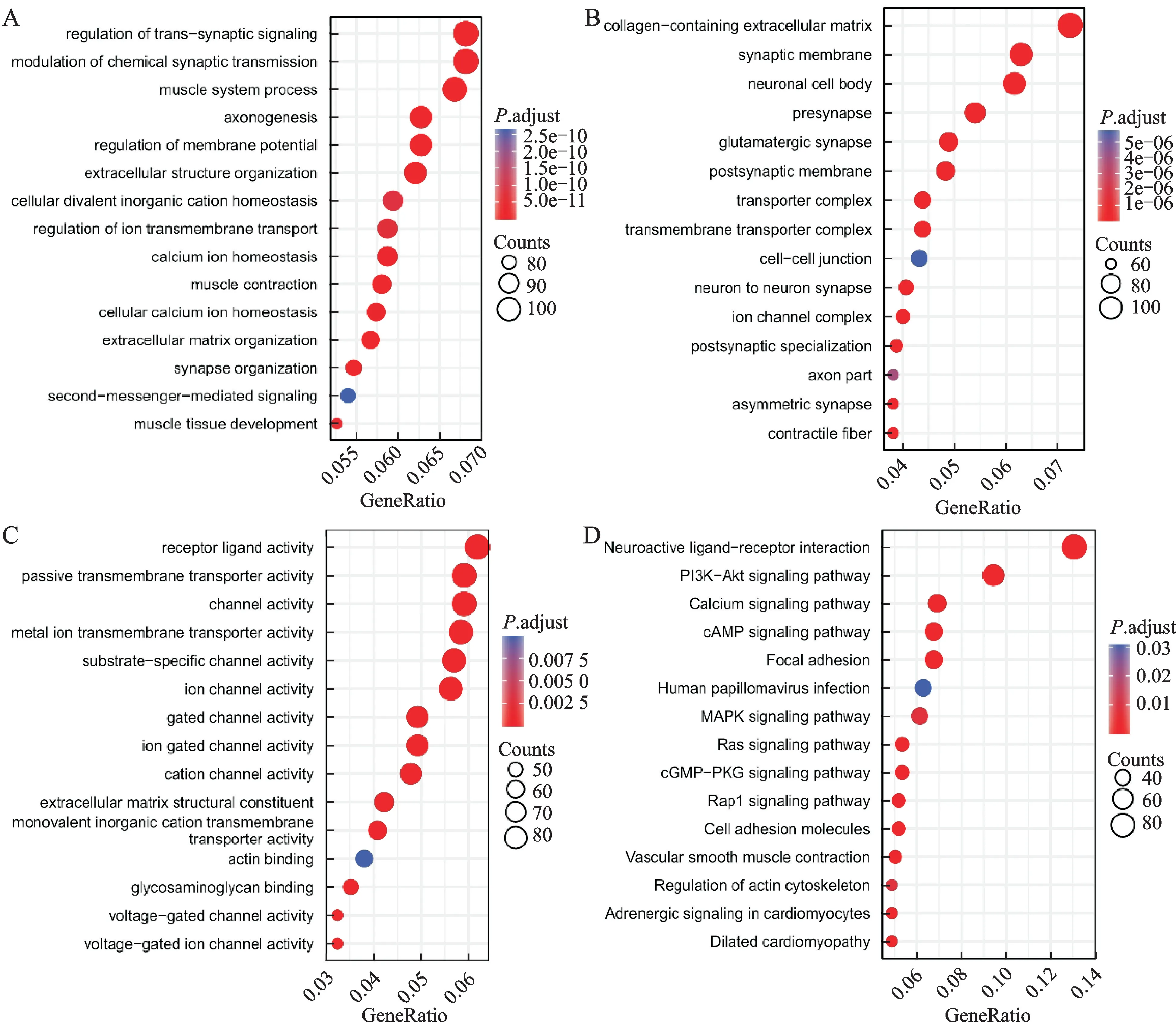
图2 功能富集分析结果Fig.2 Functional enrichment analysis
2.3 EHD3基因集富集分析
利用预先确定的基因集(MSigDB 数据库)做GSEA 分析,以进一步确定STAD 中EHD3高表达和低表达所参与的生物学功能。当符合FDR(qvalue)<0.05且P.adj<0.05时,发现EHD3高表达DEGs显著富集于GO 功能中的免疫应答调节信号通路、淋巴细胞活化的调控、T 细胞活化、体液免疫应答以及吞噬作用等(图3A);低表达组EHD3显著富集于核糖体、线粒体基因表达、呼吸小体、氧化还原酶复合物和病毒基因表达等(图3B)。B、T 细胞受体信号通路、癌症途径以及WNT、MAPK 信号通路等KEGG通路均显著富集于EHD3高表达DEGs(图3C);核糖体、氧化磷酰化、DNA 复制、RNA 降解和嘧啶代谢等KEGG 通路在低表达EHD3的DEGs中显著富集(图3D)。在标志性基因集中上皮间质转换、炎症反应、细胞凋亡、KRAS信号传导和TGF-β信号传导显著富集于EHD3高表达组中(图3E);MYC、E2F 靶标、氧化磷酰化、G2M 检查点以及DNA 修复显著富集于EHD3 低表达组中(图3F)。上述结果表明,EHD3可能对STAD 患者肿瘤微环境及免疫应答产生影响。
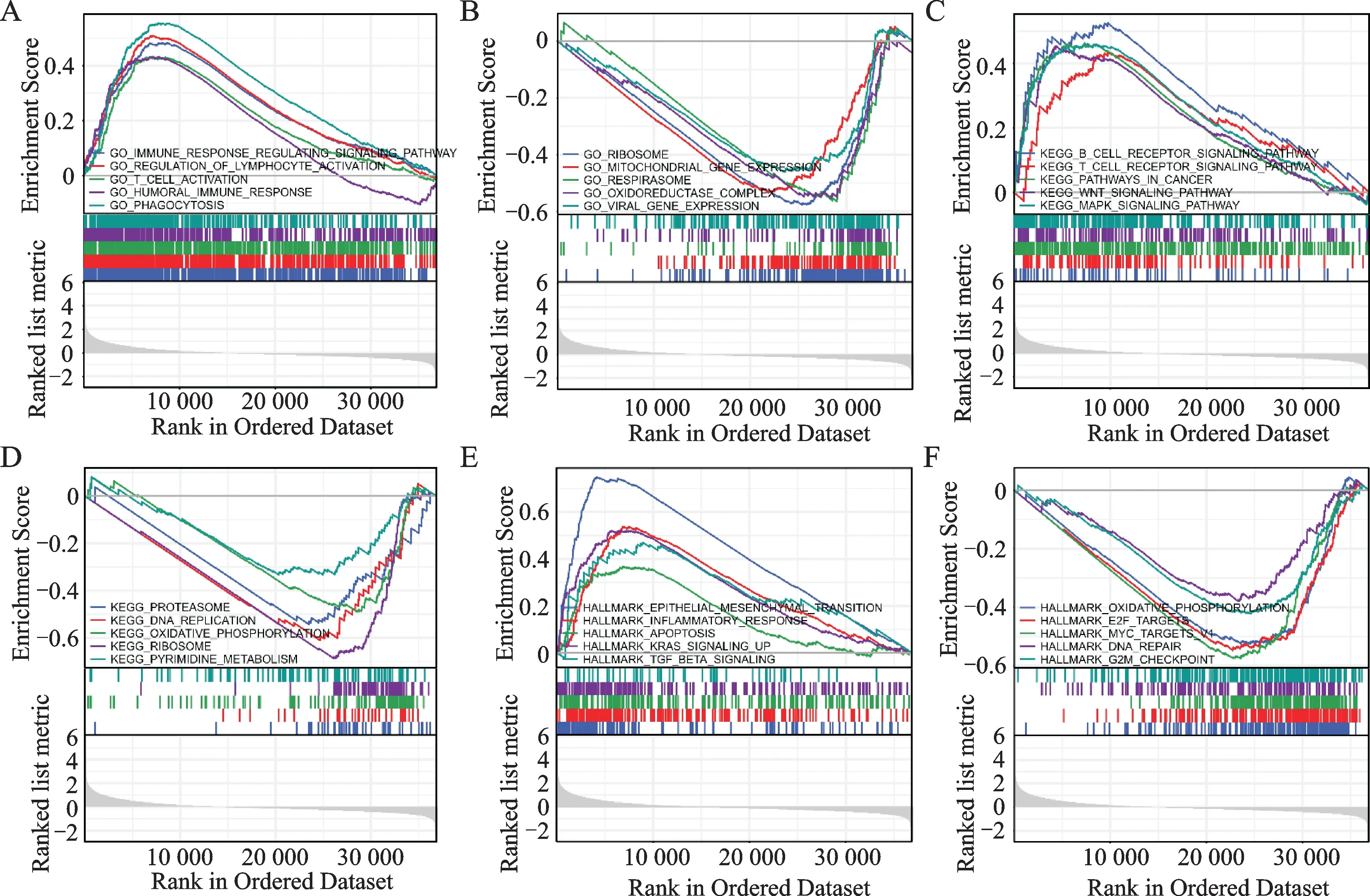
图3 EHD3相关的GSEA富集分析结果Fig.3 EHD3-related GSEA enrichment analysis
2.4 EHD3免疫浸润和免疫检查点分析
通过观察24个免疫细胞中不同EHD3 表达组之间的相互关系,发现T 细胞、B 细胞、CD8T 细胞、树突细胞(DC)、嗜酸性粒细胞、iDC、巨噬细胞、肥大细胞、嗜中性粒细胞、NK(自然杀伤)细胞、p DC、Tcm、Tem、TFH、Tgd、Th1(P均<0.001)以 及TReg细胞(P=0.003)在EHD3中高表达;Th17细胞(P=0.014)、Th2(P=0.006)细胞在EHD3中低表达(图4A)。此外,本研究评估了24种免疫细胞与EHD3的相关性,结果表明,EHD3 与Th17 细胞(r=-0.113,P=0.029)、Th2 细 胞(r=-0.116,P=0.025)呈负相关;aDC、NK CD56bright 细胞、NK CD56dim 细胞和T helper细胞与EHD3无相关性,其余免疫细胞与EHD3 呈正相关(P<0.001,图4B、图4C)。最后分析了EHD3的表达量与免疫检查点(包括PD-1、PD-L1、CTLA-4、VISTA、TIM-3、LAG-3、TIGIT、CD48)之间的关联,发现高表达EHD3 组PD-1、PD-L1、CTLA-4、VISTA、TIM-3、LAG-3、TIGIT、CD48 的表达水平均高于低EHD3表达组,同时发现8个免疫检查点均与EHD3的表达呈正相关(图5)。

图4 EHD3表达与免疫细胞浸润之间的关系Fig.4 Association between EHD3 expression and immune cell infiltration
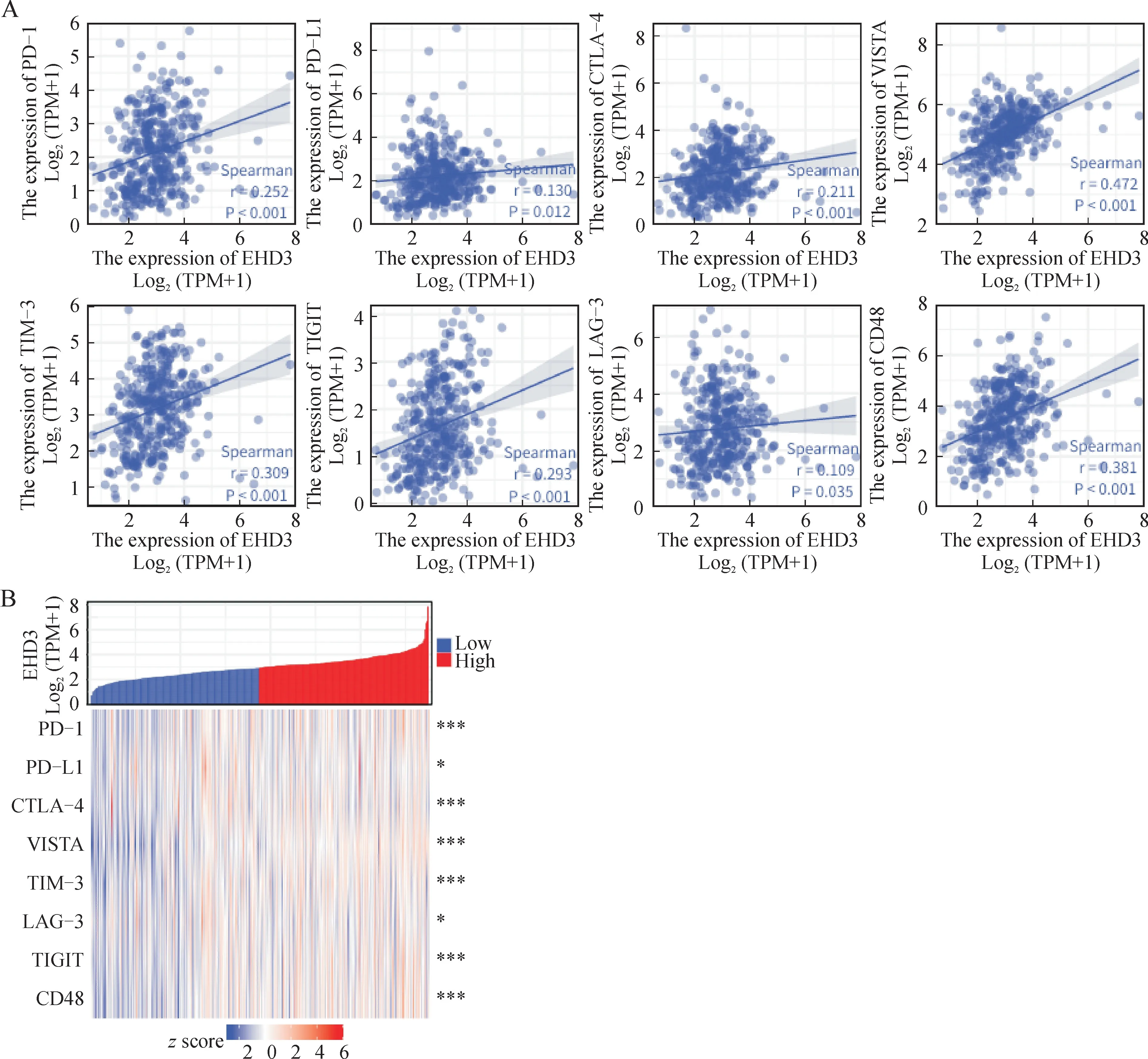
图5 EHD3表达与免疫检查点之间的关系Fig.5 Association between EHD3 expression and immune checkpoints
2.5 EHD3的表达与临床特征的关系
分析STAD 中EHD3高低表达组之间的主要临床特征,发现P值均大于0.05,说明分组之间相对均衡,能更好地用于后续研究(表1)。通过Cox回归分析了潜在的预测因子,单因素分析显示TNM 分期、主要治疗结果、年龄及EHD3的表达水平具有统计学意义(P<0.05),然后再进一步进行多因素分析和森林图绘制,其结果说明EHD3为一独立预后因素(HR=2.112,95%CI:1.340~3.327,P=0.001,图6)。

表1 STAD中EHD3表达与TNM 分期、主要治疗结果、年龄及HP感染的关系Tab.1 Association of EHD3 expression in STAD with TNM stage,primary treatment outcome,age and HP infection[n(%)]

图6 TNM 分期、主要治疗结果、年龄及EHD3 的多因素Cox回归分析结果的森林图Fig.6 Forest plot shows the results of the multifactorial Cox regression analysis for TNM stage,primary treatment outcome,age and EHD3
2.6 预测模型的构建
将EHD3及临床特征纳入列线图模型(图7A),开发预测1年、3年、5年的生存概率,同时绘制校准图(图7B)。结果发现C 指数为0.737(95%CI:0.713~0.761),校准图的预测概率与观测结果基本一致,说明模型有较好的预测性。此外,在GEPIA2数据库中进行了Kaplan-Meier生存分析,结果显示,EHD3高表达的STAD 患者与不良结局有关(P=0.002,图7C)。

图7 STAD中EHD3基因的预后预测模型和生存曲线Fig.7 Prognostic prediction model and survival curve of EHD3 gene in STAD
3 讨 论
STAD 是常见的恶性肿瘤,目前以手术切除为主,但其总体生存率仍较低,免疫治疗等新疗法已成为STAD 新的治疗希望[24-25]。免疫治疗与其他治疗协同作用的方案层出不穷,给STAD 患者带来了新的治疗前景,在不远的未来,较好的生物标志物一定能使STAD 治疗更加个性化和精确化[26-27]。
本研究结果表明,EHD3在STAD 患者中表达与其预后及免疫细胞浸润有明显关系。本研究首先发现EHD3在STAD 中表达上调,通过对比不同肿瘤表达情况,发现EHD3的表达在大多数类型的肿瘤中显著上调。随后通过富集分析EHD3的基因功能,提示EHD3与免疫应答有关。随着对肿瘤微环境和细胞免疫调节等方面研究的不断深入,更多的研究证实免疫细胞在肿瘤的发生和发展过程中具有重要而又复杂的功能[28-30]。
从富集分析的结果看,EHD3表达量与多数免疫细胞呈显著正相关。在免疫细胞中,自然杀伤(NK)细胞与EHD3表达的相关度最高(r=0.525,P<0.001)。NK 细胞作为一种细胞毒性淋巴细胞,其表面受体的活化或抑制作用可调控肿瘤活性并可增强免疫治疗抗肿瘤作用,而减少治疗毒性反应[31-32]。TFH 细胞(r=0.512,P<0.001)和EHD3 的表达呈正相关,TFH 细胞在对生发中心形成过程中具有重要意义。生发中心一旦形成则需要TFH 细胞维持其存在,调控生发中心B 细胞向浆细胞及记忆B 细胞的分化,进而提高CD8 T 细胞效应器功能以促进抗肿瘤免疫[33-34]。有文献报道,THF细胞在乳腺癌患者的长期存活过程中存在正相关[35]。另外,本研究还揭示了EHD3的表达与其免疫检查点(包括PD-1、PD-L1、CTLA-4、VISTA、TIM-3、LAG-3、TIGIT、CD48)之间存在正相关关系。提示EHD3在肿瘤免疫学研究中具有重要意义,可作为免疫治疗靶点而非单纯作为预后标志物使用。
接着就EHD3对STAD 患者的预后影响进行分析。Cox回归分析结果显示,除常见的危险因素如年龄、主要治疗结果等之外,EHD3作为STAD 患者独立预后指标存在,并进一步构建了基于EHD3表达水平的列线图预测模型,对STAD 的1年、3年和5年生存率进行预测,其C 指数达到了0.737(95%CI:0.713~0.761),而校准图预测概率则与观测结果吻合良好,表明该模型具有良好预测性。通过Kaplan-Meier生存分析验证了EHD3表达与OS相关,EHD3高表达与STAD 的不良结局有关。本研究所建立的模型能够为STAD 患者预后预测及个性化评估提供新的切入点。但本研究尚存在一定的局限性,应在建立前瞻性研究预测模型的同时加入验证集的临床样本,且EHD3的相关调控机制及信号通路还需要深入研究。
综上所述,EHD3在STAD 中表达上调,且高表达与预后不良有关。这可能与免疫细胞浸润有关。本研究提出了一个新观点,即EHD3是一个新的预后因素,也可能是STAD 的潜在治疗靶点。未来的研究将重点关注STAD 中EHD3的具体机制。

