子宫内膜癌组织血栓调节蛋白基因的表达及甲基化分析
朱颖捷,朱巍立
子宫内膜癌是以阴道出血或排液为主要临床表现的病因尚未明确的妇科肿瘤疾病,发病人群呈年轻化趋势。有研究认为异常DNA 甲基化[1]在子宫内膜癌发生发展过程中具有关键作用[2],DNA 甲基化水平明显升高,对于散发性子宫内膜癌具有较高的诊断价值[3],周芮琪[4]则发现CHST11 低甲基化诱导子宫内膜癌的发生,且与临床密切相关。近年来,血栓调节蛋白(THBD)基因受到研究者广泛关注,认为THBD是一种新型抑癌基因,该基因表达失活与肿瘤的发展有一定关系,而THBD启动子的低甲基化可能是导致该基因低表达的一个重要因素。本文通过850K 甲基化芯片测序、q-PCR 实验及甲基化特异性PCR 技术,对THBD在子宫内膜癌和癌旁组织中的表达及THBD基因的甲基化水平进行研究,现报道如下。
1 资料与方法
1.1 一般资料 58 例子宫内膜癌及其癌旁组织取自2020 年12 月至2022 年6 月嘉兴市妇幼保健院妇产科手术标本,取得标本迅速置液氮冷冻,-80 ℃冰箱保存备用。所有标本均经病理检查证实,临床资料完整,术前均未经放疗、化疗及性激素治疗。患者年龄22 ~80 岁,中位年龄56 岁。病理诊断均为子宫内膜样腺癌,按FIGO 标准进行病理组织学分级和手术病理分期,其中G1 级31 例,G2 级25 例,G3级2 例;Ⅰ期55 例,Ⅱ期1 例,Ⅲ期2 例。本研究经嘉兴市妇幼保健院伦理委员会审批通过。
1.2 主要试剂 Trizol RNA提取试剂购自索莱宝公司,DNA 提取试剂盒购自德国Qiagen 公司,重亚硫酸盐试剂盒及MSP 试剂盒购自天根生化科技有限公司,TAE溶液购自Biosharp公司,引物序列购自金智唯公司,逆转录试剂盒及SYBR Green Master Mix试剂盒购自日本Takara 公司。
1.3 方法
1.3.1 850K DNA 甲基化芯片测序 选取本组患者中的10 例子宫内膜癌组织标本及癌旁组织,进行850K DNA 甲基化芯片测序,数据来源深圳中科普瑞基因科技有限公司。
1.3.2 qRT-PCR 检测THBD mRNA 水平 Trizol 法提取各组织总RNA,所得RNAA260/A280 >1.7,符合纯度要求,反转录合成cDNA。PCR 反应条件:95 ℃2min,95℃15s,60℃15 ~30s,共40 个循环,见表1。

表1 基因引物序列及内参
1.3.3 甲基化特异性PCR 检测 采用DNA 甲基化修饰试剂盒对子宫内膜癌基因组DNA 进行甲基化修饰,具体操作按试剂盒说明书进行。PCR 反应体系:95 ℃预变性5 min,94 ℃变性20 s,60 ℃退火15~30s,72 ℃延伸20s共35 个循环,72 ℃延伸5min。扩增后产物用2%琼脂糖凝胶电泳,凝胶成像系统观察分析。THBD MSP 甲基化引物序列F:5’-TTTTTAGCGAAGAGTTTAATTTAGC-3’;R:5’-AACTAACCTACAATAACCAAACGAA-3’;未甲基化引物序列UF:5’-TTTTTAGTGAAGAGTTTAATTTAGTGG-3’;UR:5’-AACTAACCTACAATAACCAAACAAA-3’。扩增产物长144bp,MSP结果判定:仅扩增出甲基化条带者为完全甲基化,仅出现非甲基化条带者为未甲基化。
1.4 统计方法 采用SPSS 20.0统计软件进行分析,计量资料以均数±标准差表示,采用t 检验;计数资料采用2检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 850K DNA 甲基化芯片结果 10 例子宫内膜癌组织及癌旁组织呈高低甲基化趋势,在DMP差异甲基化基因中发现THBD、ZSCAN4 等基因呈低甲基化趋势(均P <0.05),见图1。

图1 甲基化芯片生信分析
2.2 MSP实验结果 58例子宫内膜癌组织中有仅20例检测到THBD基因启动子的甲基化,发生率为34.5%(20/58);在癌旁组织中有40 例检测到甲基化改变,发生率为69.0%(40/58),THBD基因启动子在子宫内膜癌中的甲基化水平明显下降(2=13.81,P<0.05),见图2。
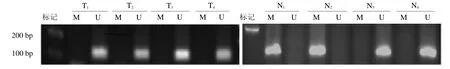
图2 子宫内膜癌病灶及癌旁THBD 甲基化情况
2.3 THBD 在子宫内膜癌中的表达水平 以GAPDH 为基础内参,结果显示THBD 基因在子宫内膜癌中的表达明显低于癌旁组织(t=15.36,P<0.05);内膜癌组织中非甲基化组较甲基化组THBD mRNA表达下降(t=4.25,P <0.05),见图3。
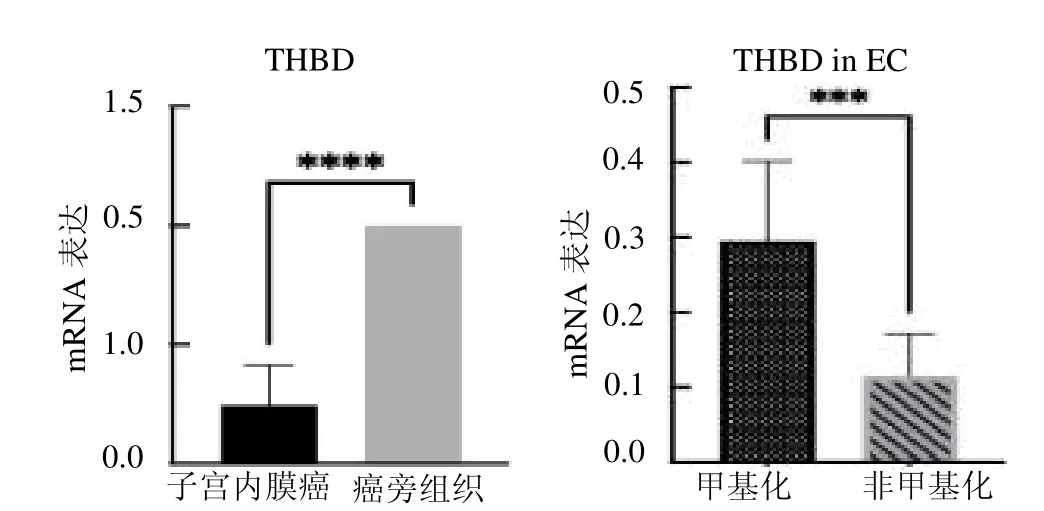
图3 THBD 基因mRNA 表达水平
2.4 THBD基因甲基化情况与临床病理特征的关系THBD 甲基化发生率在绝经状态、BMI 中差异均有统计学意义(均P<0.05),但在病理分期、肌层浸润深度及病理分期中差异均无统计学意义(均P >0.05),见表2。

表2 子宫内膜癌THBD基因启动子甲基化与临床病理特征的关系
3 讨论
子宫内膜癌是发生于子宫内膜的一类上皮性恶性肿瘤,其发生发展是多因素的生物学过程,涉及多基因、多阶段[1]。然而,目前尚不清楚其准确的发病机制,也缺乏特异性的分子标记物来早期诊断。因此,研究子宫内膜癌发病的分子机制和治疗靶点尤为重要。
THBD是一种由557 个氨基酸组成的多功能跨膜凝血酶受体,是蛋白C途径的关键调节因子,表达于内皮细胞、造血细胞和胎盘滋养层细胞等。THBD由位于20p11.21 染色体上的无内含子基因编码,蛋白分子量为70 ~100 kD,其含有N-末端凝集素样结构域、6 个表皮生长因子样结构域、丝氨酸-苏氨酸区、跨膜区和富含硫酸软骨素的细胞质短尾。THBD的胞外区约有一半由珠蛋白N-末端组成,其序列与C型动物凝集素相似,它们参与肿瘤生长[5]和炎症调节[6]。THBD 在多种人类肿瘤中异常表达,如间皮瘤[7]、肺癌及胰腺癌[8]等。许多实验研究表明,THBD 在肿瘤细胞中的表达水平与肿瘤细胞增殖和体外侵袭呈负相关[9]。张小雨等[10]通过对结直肠癌及非癌组织进行甲基化荧光检测,研究发现THBD 基因诊断结直肠癌的灵敏度及特异度分别为84.1%及87%,可以显著区分癌组织及非癌组织,有望成为结直肠癌早诊断及早筛查的肿瘤标志物。有研究对141 例直径小于6 cm的肝细胞癌切除病灶进行THBD免疫组织化学和临床病理研究,提示THBD 可能通过抗凝作用抑制肿瘤细胞与门静脉的黏附,从而阻止肝内转移[11]。上述研究均说明THBD是潜在抑癌基因,其抗炎、黏附作用可抑制肿瘤的发病、侵袭及迁移。在本研究中,THBD 基因在子宫内膜癌组织中表达普遍下降,说明在子宫内膜癌发展过程中,THBD扮演重要角色,可能是子宫内膜癌发生的一个潜在生物标志物。
为了解THBD 基因启动子甲基化水平,本研究采用MSP 检测方法验证850K 甲基化芯片测序结果,显示与癌旁组织相比,子官内膜癌组织中THBD基因启动子区呈明显低甲基化水平。这提示THBD基因启动子低甲基化可能是THBD mRNA 在子宫内膜癌组织中低表达的始发原因之一。值得注意的是,基因甲基化状态常与癌症的病理类型、临床特性及分子表型有密切关联,据此研究子宫内膜癌病灶甲基化程度有助于判断肿瘤的恶性水平。但在本研究中,通过分析临床资料发现患者绝经状态、BMI与THBD 甲基化水平有关,这提示女性患者性激素水平下降及BMI 升高可能是某些抑癌基因表观遗传学改变的病因。因此,针对具有子宫内膜癌高危因素,如围绝经期、肥胖等潜在发病人群,早期进行子宫内膜甲基化检测或筛查,对预防肿瘤发生并早期干预具有重要意义。
利益冲突 所有作者声明无利益冲突

