互花米草定植的养殖尾水处理人工湿地中古菌群落的组成与分布
谭 莹, 胡越航, 钱云霞, 郭安南
互花米草定植的养殖尾水处理人工湿地中古菌群落的组成与分布
谭 莹1, 胡越航1, 钱云霞1, 郭安南2,3*
(1.宁波大学 海洋学院, 浙江 宁波 315832; 2.宁波大学 食品与药学学院, 浙江 宁波 315832; 3.浙江省动物蛋白食品精深加工技术重点实验室, 浙江 宁波 315832)
为探究凡纳滨对虾养殖尾水处理过程中互花米草湿地的净化效果和沉积物古菌群落的组成与分布, 基于16S rRNA基因的高通量测序技术, 从沉积物环境因子、古菌群落结构和多样性、环境因子与古菌群落间的相互关系进行分析. 结果表明: 互花米草人工湿地深层沉积物的古菌群落多样性显著高于表层和根际沉积物; 门水平上, 互花米草人工湿地优势古菌为泉古菌门、广古菌门和奇古菌门; 纲水平上, 优势古菌为深古菌纲、甲烷微菌纲和热源体纲; 目水平上, 互花米草人工湿地中含3种氨氧化古菌和7种产甲烷古菌. 非度量多维尺度分析(NMDS)表明, 互花米草根际沉积物与深层沉积物古菌群落差异显著(<0.05), 与表层更为相似. 冗余分析(RDA)及Mantel检验表明, 影响古菌群落的主要环境因子包括pH、铵氮(NH4+-N)、总有机碳(TOC)和总磷(TP). 相关性热图表明奇古菌门和其中的亚硝基菌纲与环境因子的相关性最强. 氨氧化古菌群落与pH、NH4+-N、总氮(TN)和TP呈显著相关(<0.01), 产甲烷古菌与环境因子则无显著相关性. 人工种植互花米草能够有效改善湿地环境, 可为养殖尾水的湿地净化提供理论和实践依据.
古菌群落; 互花米草; 沉积物; 海水养殖尾水
随着人们对鱼虾需求的逐渐加大和捕捞业的日渐枯竭, 高密度、集约化的凡纳滨对虾()养殖规模逐步扩大[1-2], 养殖尾水也随之增加, 而养殖尾水的有效处理、达标排放是近海养殖可持续发展必须解决的问题之一. 人工湿地利用植物和湿地土对污染物进行有效的吸附和降解是海水养殖尾水生态处理的一种重要方式. 互花米草(Loisel)作为滨海湿地中常见的多年生直立草本植物, 具有耐盐、耐淤和耐淹的特性, 还能有效减少沿海潮汐侵蚀、消浪促淤[3], 杆叶也可作为饵料或肥料[4], 常被用于海水养殖尾水人工湿地中. 互花米草通过根系分泌物等化感物质影响土壤的理化性质, 进而影响微生物的群落结构[5]. 与光滩相比, 互花米草的入侵显著提高了中国东部滨海湿地土壤细菌丰度和多样性, 而土壤细菌丰度和群落组成主要受pH等理化性质的影响[6]; 在河口湿地中互花米草的入侵改变了湿地土壤细菌的优势菌属[7]; 黄河口中互花米草的种植改变了沉积物的理化性质, 有机碳的含量随种植年限的增加而增加, 革兰氏阳性菌和革兰氏阴性菌的比例显著增加[8]. 近年来, 随着研究的不断深入, 关于互花米草对湿地沉积物细菌群落影响的研究越来越广泛, 但在互花米草对湿地沉积物古菌群落的影响方面尚鲜见报道.
古菌广泛分布于土壤、海洋、淡水和河口等生境中, 能够像细菌一样利用有机或无机电子供体和受体进行各类能量代谢, 具有产甲烷、氧化氨或降解有机物等不同的生理生化功能, 参与碳、氮和硫等元素的生物化学循环等. 目前, 关于古菌在高浓度有机碳和氮的废水处理系统的功能研究逐渐增多. 例如, 近年来厌氧消化在处理畜禽粪便和城市废水等高浓度废水中得到了广泛应用, 其中的产甲烷古菌则是有机质厌氧消化作用的直接贡献者[9]. 产甲烷古菌是一类严格厌氧且系统发育差异极大的古菌[10], 主要分布于湿地[11]、稻田[12]等厌氧环境中, 它能利用环境中的有机质为底物, 通过乙酸型、氢型、甲基型、氧甲基型[13]和烷基型[14]多种途径产生甲烷, 在碳生物地球化学循环、可再生能源的利用和全球气候变暖方面有着突出贡献[15]. 氨氧化古菌(Ammonia-Oxidizing Archaea, AOA)在自然环境中的数量比氨氧化细菌更高, 最大差别可达8000倍[16], 是地球上最丰富的氨氧化微生物. 氨氧化古菌具有极高的底物氨亲和力和高效的自养固碳途径, 能够参与硝化作用氧化环境中的铵氮转化为植物更易吸收的硝酸盐, 此过程在缓解养殖废水氮素污染中具有重要意义[17].
为研究处理海水养殖尾水的人工湿地沉积物中古菌群落的组成与分布, 本文通过高通量测序分析不同位点沉积物的古菌群落组成、多样性及其与环境因子的相互关系, 进一步分析与C、N循环相关的氨氧化古菌和产甲烷古菌的群落变化, 阐明古菌在人工湿地中的作用, 为人工湿地处理养殖尾水提供科学依据.
1 材料与方法
1.1 研究区域选择及沉积物采集
互花米草人工湿地位于浙江宁波象山蓝尚海洋科技有限公司的凡纳滨对虾养殖场(N29.72° E121.86°), 对虾养殖平均产量7375kg·hm-2, 其养殖尾水排出至尾水沉淀池, 固液分离后一部分制成有机肥应用于农业, 另一部分经滤食性贝类吸收后流入互花米草人工湿地[18]. 根据养殖尾水的流经途径, 将人工湿地分为流入区(E)、中间区(M)和流出区(O) 3个区域, 每个区域采集沉积物表层(S)、互花米草根际(R)和人工湿地深层(D) 3个位点, 每个位点设置3个平行. 表层沉积物为水土交界面下2cm内的土层; 根际沉积物是用无菌水浸洗互花米草根表后形成的泥浆再离心(3000r·min-1, 5 min)得到; 深层沉积物为水土交界面以下40cm的无根区. 样品收集后保存于-80℃超低温冰箱, 直至分析.
1.2 沉积物理化指标测定
沉积物含水率(moisture)用干重法测定; 水土比5:1混合, 充分震荡后, 使用pH计(上海精科)测得上清液pH值作为沉积物的pH值; 硝态氮(NO3-- N)和铵态氮(NH4+-N)采用2mol·L-1KCl浸提后分别用酚二磺酸比色法和靛酚蓝比色法进行测定[19]; 沉积物土样总氮(TN)和总磷(TP)含量用酸消解法(Smart Chem 200 Discrete Analyzer)进行测定; 总有机碳(TOC)含量采用重铬酸钾氧化法进行测定.
1.3 DNA提取, PCR扩增及高通量测序
称取0.5g湿重沉积物, 用FastDNA土样试剂盒(MP Biomedicals, OH, USA)提取DNA, 提取步骤参考说明书. 用16S rRNA基因V3-V4区通用引物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R (5′-GGACTACNNGGGTATCTAAT-3′)进行PCR扩增, 产物用Takara凝胶回收试剂盒进行纯化, NanoDrop测定含量和纯度, 等量混合后使用高通量测序(Illumina, USA)平台进行测序.
1.4 Illumina数据处理
原始数据利用QIIME流程进行分析, 过滤和拼接低质量序列、去嵌合体等质控. 流程概括为剪接掉3个以上的连续且质控分小于20的碱基, 保留大于300bp的长序列, 然后用UCHIME去除嵌合体, 用UCLUST在97%的相似性水平聚类为分类操作单元(OTUs).
1.5 统计分析
基于Illumina OTU表, 利用R语言(version 3.6.3)计算每个样品的α-多样性指数, 包括香农多样性(Shannon diversity)、Chao1指数; 筛选门水平(相对丰度>1%)、纲水平(相对丰度>1.5%)的古菌群落, 利用Origin (version 2018)绘制堆叠柱状图; 差异分析除在表中特殊标注外, 均利用单因素方差分析(One-way ANOVA)完成; 筛选目水平中的产甲烷古菌和氨氧化古菌绘制堆积柱形图; 使用“vegan”包绘制非度量多维尺度分析(NMDS), 比较不同位点沉积物古菌群落差异; 使用“pheatmap”包绘制相关性热图(Heatmap), 分析各优势菌门和优势菌纲与环境因子的相关性; 对古菌群落和沉积物环境因子进行冗余分析(RDA)和Mantel检验.
2 结果与分析
2.1 不同位点沉积物理化性质
理化分析结果(表1)显示, 各位点沉积物pH均呈弱碱性, 根际沉积物的平均pH值(8.0)高于表层(pH=7.53)和深层(pH=7.35), 但组间差异不显著(>0.05). 沉积物中NH4+-N、TN和TP的含量均为表层>根际>深层, 且尾水流入区表层的含量显著高于中间区域和尾水流出区域表层的含量(<0.05); 根际沉积物中NO3--N的含量高于表层和深层, 但整体含量较低, 且各位点无显著差异(>0.05). 根际沉积物TOC含量显著高于其他位点(<0.01).
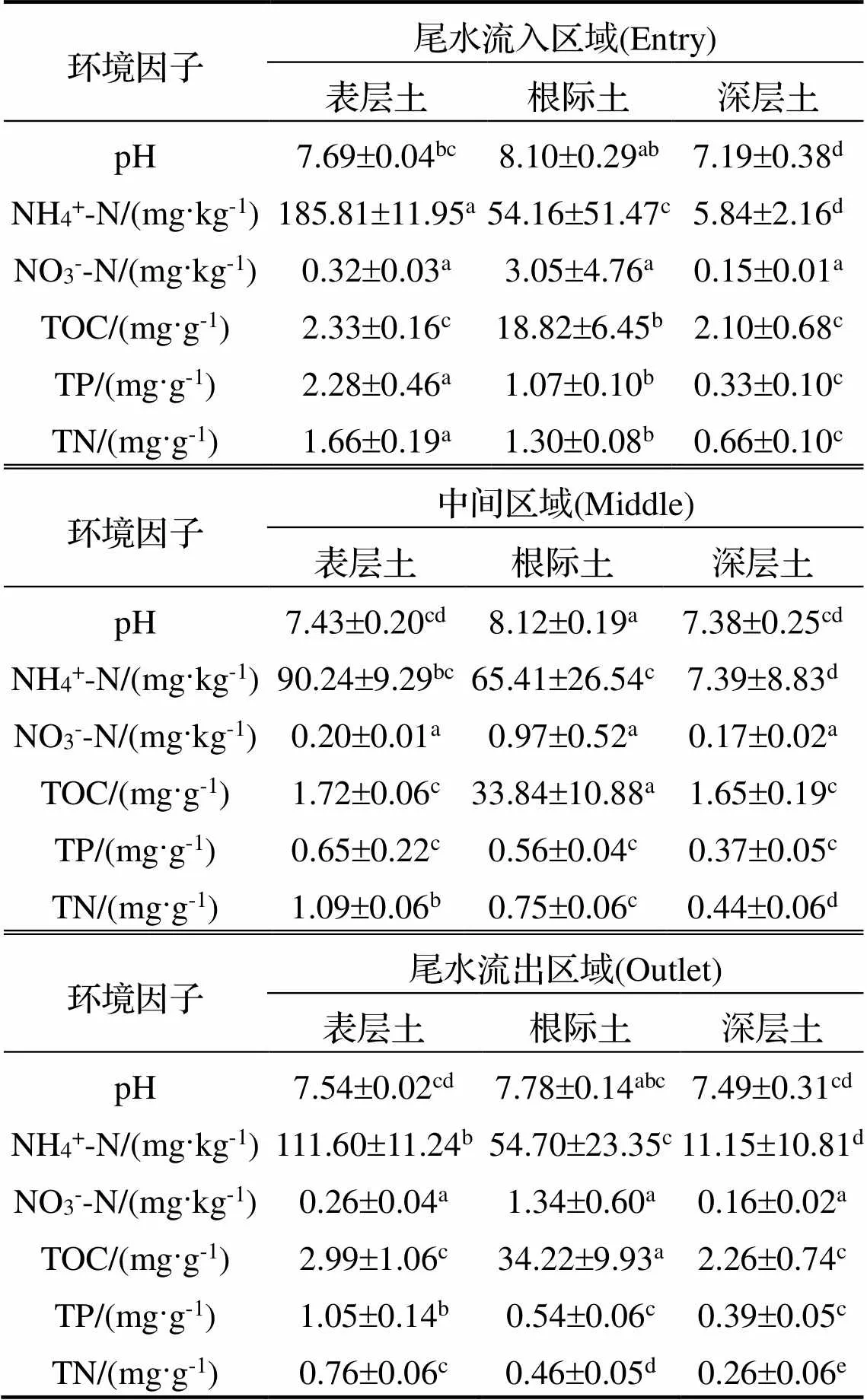
表1 独立样本t检验分析各位点沉积物环境因子的差异
注: 数值为平均值±标准偏差,=3; 字母不同为组间差异显著(<0.05); 下表同.
2.2 不同位点沉积物古菌群落组成和多样性变化
基于沉积物古菌OTUs进行Alpha多样性分析(表2), 从尾水流入区到流出区古菌的Chao1指数和Shannon指数均呈增加趋势. 流入区深层沉积物古菌的Alpha多样性显著高于表层和根际沉积物(<0.05), 而在流出区则表现为根际最高.
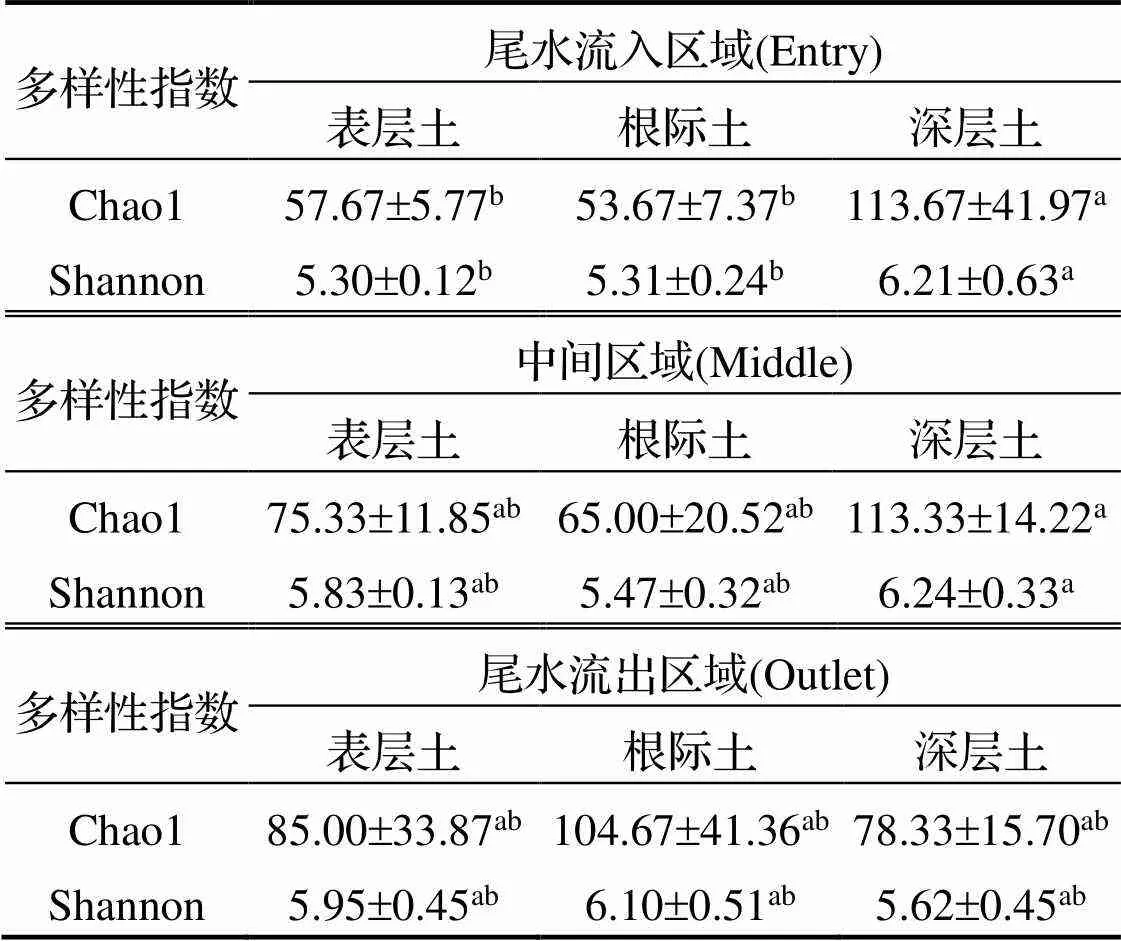
表2 沉积物古菌群落多样性指数
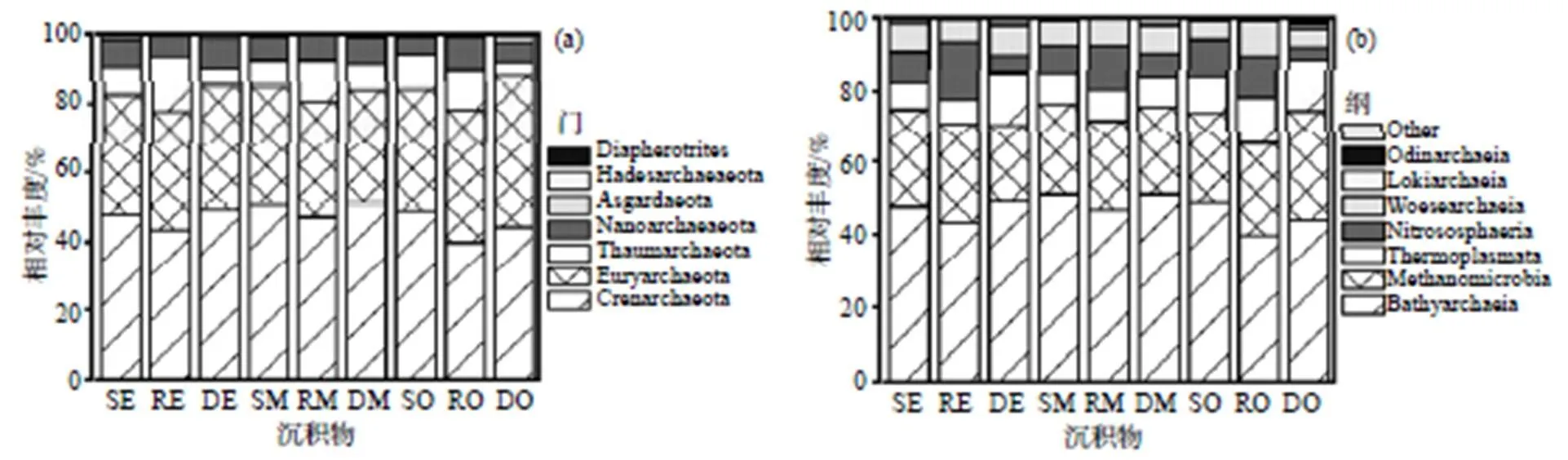
由图1(a)可见, 互花米草人工湿地沉积物中存在古菌的7个门类, 包括泉古菌门(Crenarchaeota)、广古菌门(Euryarchaeota)、奇古菌门(Thaumarcha- eota)、纳古菌门(Nanoarchaeaeota)、阿斯加德古菌门(Asgardaeota)、Hadesarchaeaeota和Diapherotrites. 其中, 泉古菌门和广古菌门是各位点的优势菌群, 共占80%左右. 泉古菌门在各位点的相对丰度占比均在40%以上, 根际沉积物泉古菌门的相对丰度略低于表层和深层沉积物, 但差异并不显著(>0.05), 而奇古菌门恰好相反(<0.05). 在各区域位点中广古菌门的相对丰度没有显著差异(>0.05).
在纲水平对古菌群落组成进一步分析, 由图1(b)可见, 主要包括深古菌纲(Bathyarchaeia)、甲烷微菌纲(Methanomicrobia)、热原体纲(Thermoplas- mata)、亚硝基菌纲(Nitrososphaeria)、乌斯古菌纲(Woesearchaeia)、洛基古菌纲(Lokiarchaeia)和奥丁古菌纲(Odinarchaeia)等. 深古菌纲作为各位点的优势菌纲, 平均相对丰度占总丰度的47%. 甲烷微菌纲、热原体纲也占有相当大的比例, 但组间差异并不显著(0.05). 亚硝基菌纲在根际沉积物中的相对丰度显著高于表层和深层沉积物(<0.05).
2.3 不同区域沉积物古菌群落结构的变化
对各区域位点沉积物古菌群落进行非度量多维尺度(NMDS)分析. 由图2可见, 古菌群落按不同区域聚类分布, 不同区域沉积物古菌群落存在显著差异(<0.05,2=0.23151). 相较于深层沉积物, 表层和根际沉积物的群落结构相似性更高.
SE: 流入区表层沉积物(Surface seidiment of Enter area); RE: 流入区根际沉积物(Rhizosphere seidiment of Enter area); DE: 流入区深层沉积物(Deep seidiment of Enter area); SM: 中间区表层沉积物(Surface seidiment of Middle area); RM: 中间区根际沉积物(Rhizosphere seidiment of Middle area); DM: 中间区深层沉积物(Deep seidiment of Middle area); SO: 流出区表层沉积物(Surface seidiment of Outflow area); RO: 流出区根际沉积物(Rhizosphere seidiment of Outflow area); DO: 流出区深层沉积物(Deep seidiment of Outflow area); 图2、图3和图5相同.
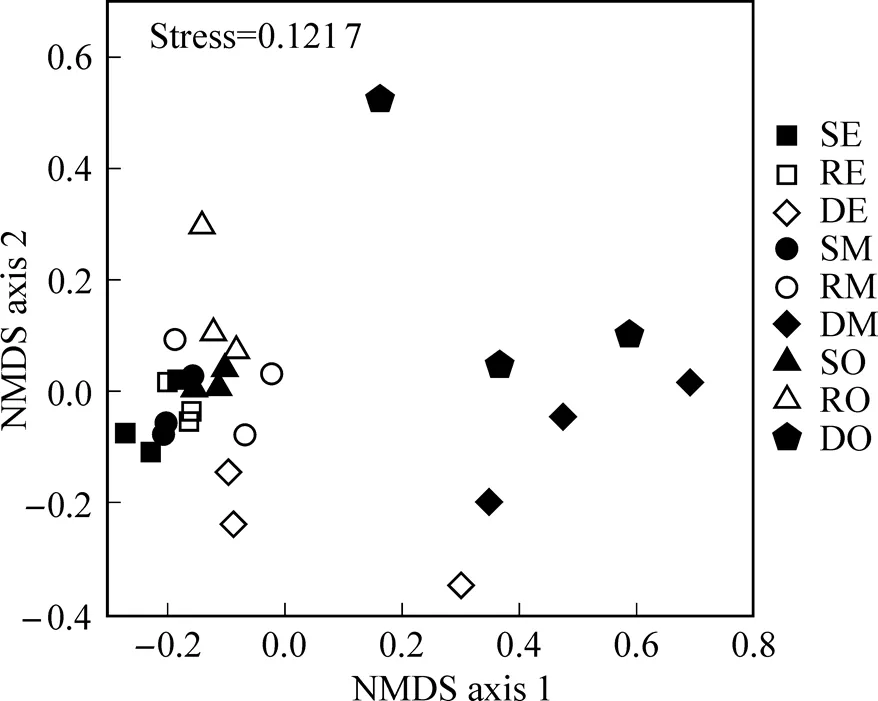
图2 非度量多维尺度分析沉积物古菌群落分布
2.4 沉积物古菌群落与环境因子的相互关系
对沉积物中的环境因子和古菌群落进行冗余分析. 由图3可见, 表层沉积物和根际沉积物受环境因子的影响较大, TP和NH4+-N与表层沉积物呈显著正相关(<0.05), TOC和pH与根际沉积物呈显著正相关(<0.05). 深层沉积物受养殖尾水的影响较小, 与各环境因子均无显著相关性.
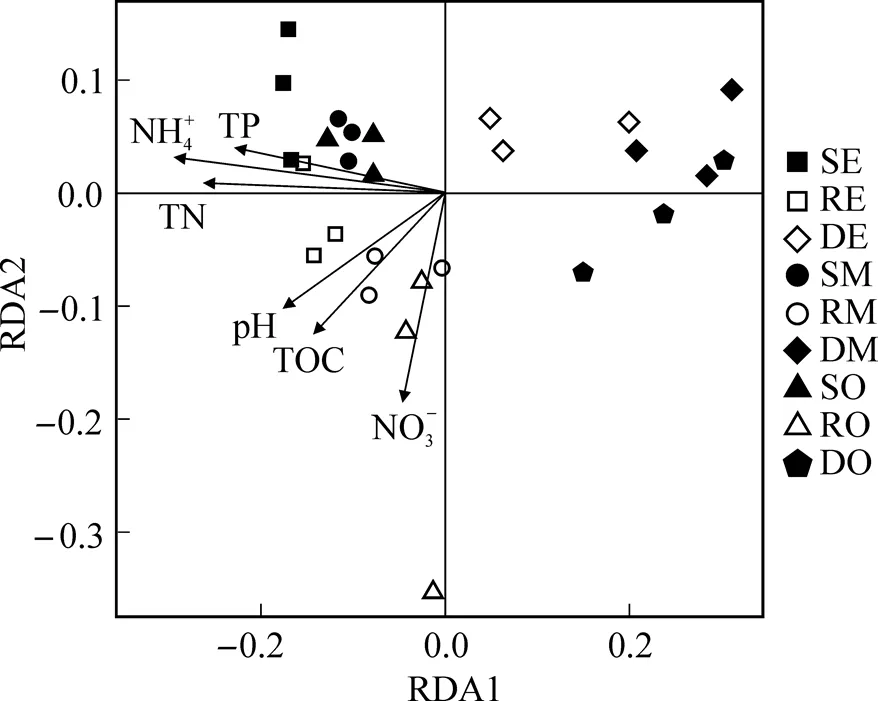
图3 沉积物古菌群落与环境因子的冗余分析
为了更深入地探究沉积物古菌群落与环境因子之间的相互关系, 对环境因子进行标准化处理, 由Mantel检验(Mantel test, 置换次数=999)分析表明, 古菌群落主要受pH、NH4+-N、TOC和TP等环境因子的影响(<0.05) (表3), 这与图4的分析结果相一致.
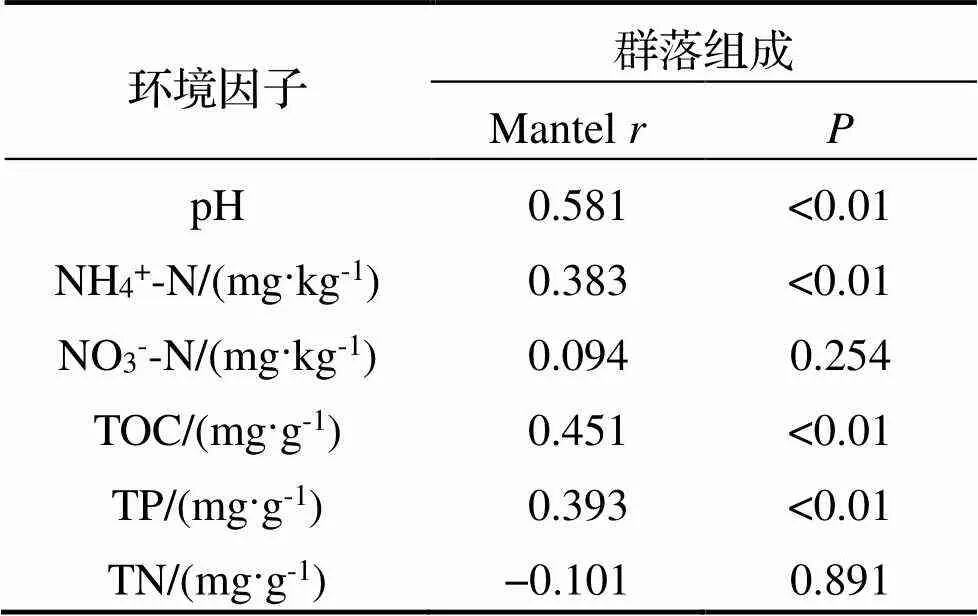
表3 古菌群落与环境因子相关性
基于相关性热图(Heatmap)分析环境因子对优势古菌门和优势古菌纲的影响(图4). TOC作为评价环境中营养指标的重要参数, 其与泉古菌门、阿斯加德古菌门、深古菌纲和洛基古菌纲呈较显著的负相关; 广古菌门与NH4+-N和NO3--N呈较显著的负相关, 广古菌门中的热原体纲也与NH4+-N呈较显著的负相关; 奇古菌门和亚硝基菌纲都与pH、TOC和NO3--N呈显著的正相关, 与奇古菌门不同的是亚硝基菌纲还与TP呈较显著的正相关.
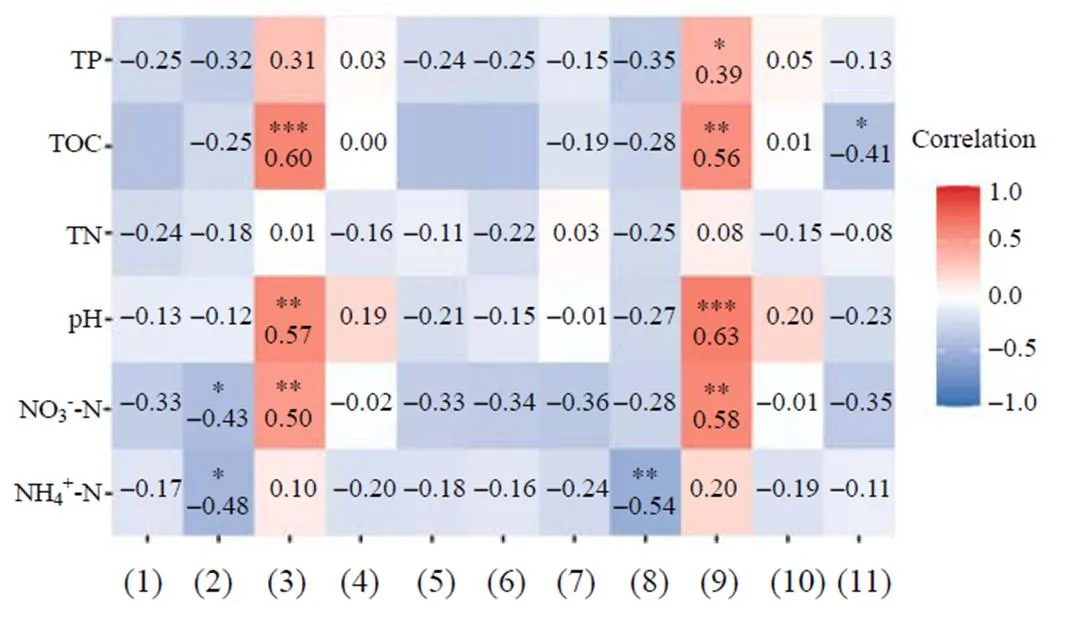
(1)Crenarchaeota; (2)Euryarchaeota; (3)Thaumarchaeota; (4)Nanoarcha- eaeota; (5)Asgardaeota; (6)Bathyarchaeia; (7)Methanomicrobia; (8)Thermo- plasmata; (9)Nitrososphaeria; (10)Woesearchaeia; (11)Lokiarchaeia; *: P< 0.05; **: P<0.01; ***: P<0.001.
2.5 氨氧化古菌和产甲烷古菌群落组成及其与环境因子的相互关系
为了分析湿地沉积物中参与C、N循环的功能古菌, 筛选出不同位点沉积物中的氨氧化古菌(AOA), 发现此湿地沉积物中氨氧化古菌存在于亚硝化侏儒菌目(Nitrosopumilales)、亚硝化球菌目(Nitrososphaerales)和亚硝化杆菌目(Nitrosotaleales) 3个目中. 其中, 亚硝化侏儒菌目为优势氨氧化古菌, 亚硝化球菌目和亚硝化杆菌目则只出现于个别样品中. 从流入区至流出区的水平方向可见, 各组间亚硝化侏儒菌目的相对丰度差异并不显著(> 0.05); 从表层到深层的垂直方向可见, 亚硝化侏儒菌目的相对丰度呈R>S>D的趋势, 其中, RM显著高于SM和DM(<0.05)(图5(a)).
目水平下分析不同位点沉积物产甲烷古菌的组成(图5(b)), 主要包括甲烷八叠球菌目(Methano- sarcinales)、甲烷微菌目(Methanomicrobiales)、马赛球菌目(Methanomassiliicoccales)、甲烷胞菌目(Me- thanocellales)、甲烷杆菌目(Methanobacteriales)、热原体目(Thermoplasmatales)和Methanofastidiosales. 其中, 甲烷八叠球菌目和甲烷微菌目为优势产甲烷古菌. 本湿地产甲烷古菌的组成较为丰富, 但各产甲烷古菌在不同区域和不同位点差异均不显著(>0.05).
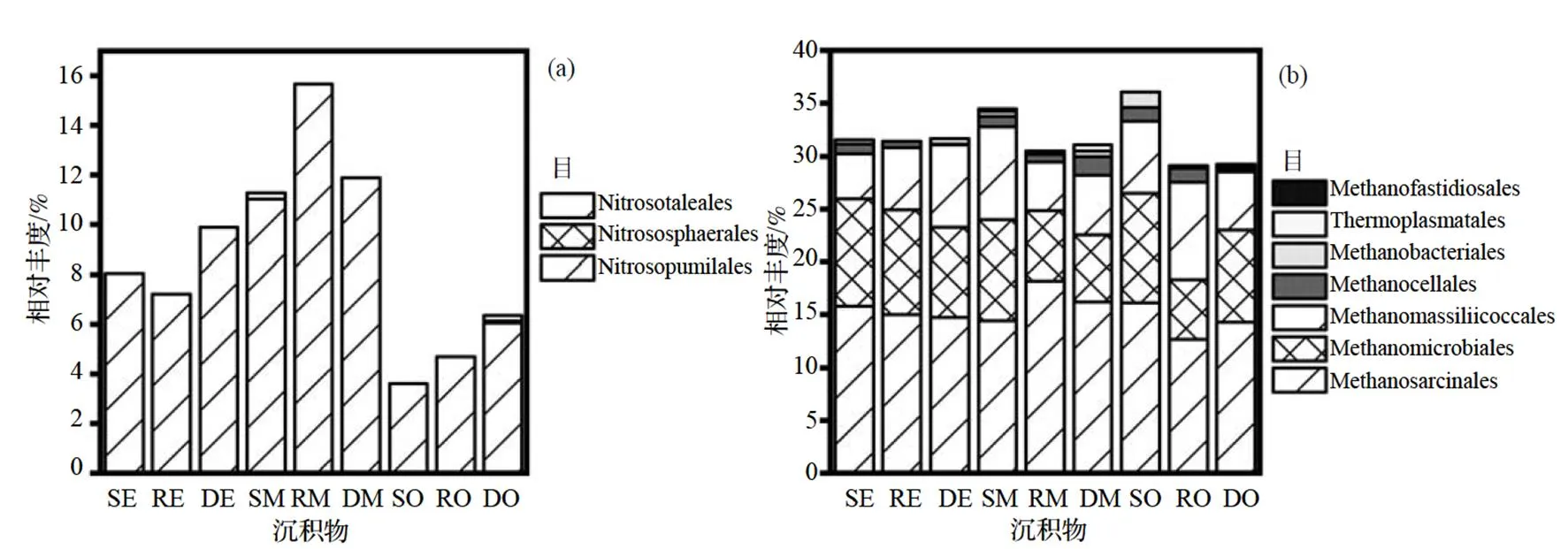
图5 各位点氨氧化古菌(a)和产甲烷古菌(b)在目水平的相对丰度
基于Pearson相关性分析了氨氧化古菌和产甲烷古菌与环境因子的相互关系. Mantel检验(Mantel test, 置换次数=999)分析表明, 氨氧化古菌群落结构与pH、NH4+-N、TN和TP呈显著正相关(< 0.01) (表4), 可见产甲烷古菌群落结构与各环境因子均无显著相关性.
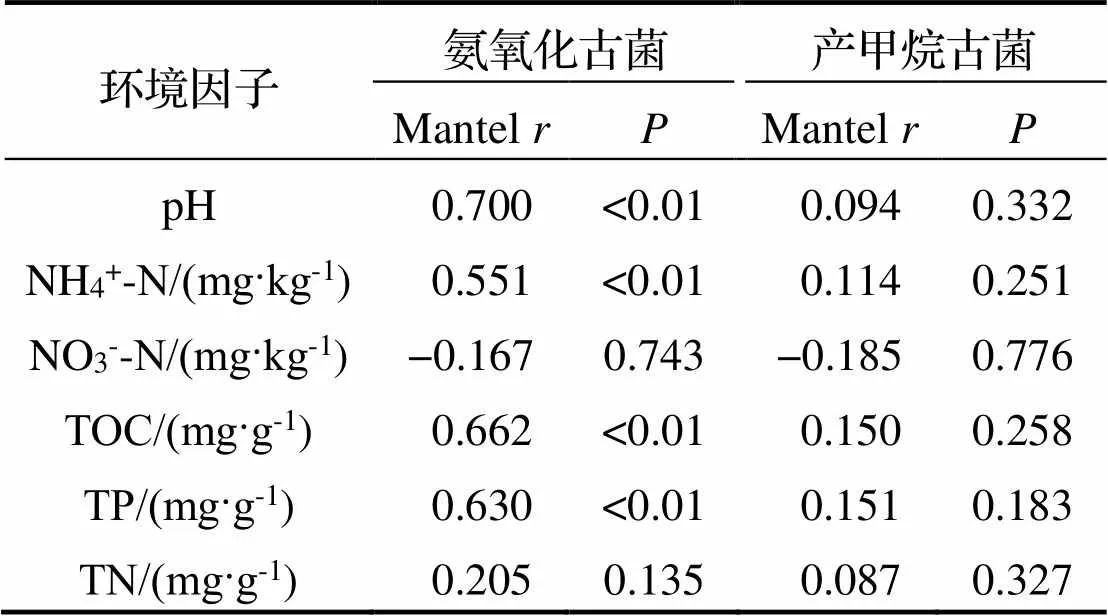
表4 氨氧化古菌和产甲烷古菌与环境因子相关性
3 讨论
3.1 人工湿地对沉积物理化性质的影响
研究表明, 凡纳滨对虾养殖尾水中氨氮、总氮和总磷质量浓度分别高达1.8、1.6和1.7 mg∙L-1 [20], 而人工湿地净化养殖尾水是当前主要的处理方式之一[18]. 在本文中, 从流入区到流出区, NH4+-N、TP和TN含量均呈降低趋势. 用定植不同植物的湿地处理市政污水和海水养殖尾水, 越靠近出水口, TP、TN和NH4+-N的含量越低[21], 而营养盐含量的降低是湿地净化作用的最直接体现. 另一方面, 植物作为人工湿地的重要组成部分, 是连接水体和沉积物的关键通道[22]. 互花米草可通过根系分泌物将光合固定产生的碳转移到根际沉积物中[23], 因此, 根际沉积物中TOC的含量显著高于表层和深层沉积物(<0.05). 湿地植物还可以通过根系释放氧气、TOC等有机质和酶, 进一步促进根际特定微生物的生长[24]. 此外, 湿地植物不仅能直接吸收尾水中的营养元素[25], 还可与微生物构成根际微环境, 共代谢强化去除尾水中的高浓度营养盐[26].
3.2 沉积物古菌群落组成、分布及其与理化性质的相互关系
本研究结果表明, 在互花米草湿地沉积物中泉古菌门、广古菌门和奇古菌门为优势古菌门类(图1(a)), 这与之前在其他湿地中检测到的优势古菌基本一致[27-28]. 泉古菌门通常是海洋环境中占比最高的古菌门[29], 深古菌纲作为泉古菌门的一个分支, 已被确立为一个古菌门类[30], 其在各位点的相对丰度均达40%以上(图1(b)). 深古菌是全球碳循环的重要驱动者之一, 参与甲烷代谢循环、产乙酸等多种功能[31]. 本湿地中广古菌门在各位点的相对丰度没有显著差异, 均在30%~40%之间(图1(a)), 产甲烷古菌基本隶属本门的甲烷微菌纲和热源体纲, 其中甲烷微菌纲的甲烷八叠球菌目和甲烷微菌目为优势目. 甲烷八叠球菌目是一类严格厌氧的产甲烷古菌, 可利用多种有机或无机化合物为底物产生甲烷, 能够耐受不同的逆境因子, 环境适应力强[32], 因而有研究者将甲烷八叠球菌固定化用于处理高浓度有机废水[33]. 本湿地中产甲烷古菌群落结构相对稳定, 与各环境因子之间均无显著相关性, 但其相对丰度占比较高(图5(b)). 产甲烷古菌的生长繁殖只能利用以碳等有机物为基质的产甲烷代谢获取能量[34], 可见, 产甲烷代谢过程既能降低沉积物中的高浓度营养盐, 还有助于沉积物中的甲烷向空气释放. 奇古菌门是近年来从泉古菌门中划分出来的一类中温泉古菌, 包含大量的氨氧化古菌[35]. 有研究者基于宏基因组分析发现某些奇古菌的DNA片段含有氨单加氧酶基因[36], 表明它们参与了氨氧化过程. 互花米草湿地氨氧化古菌较少, 而亚硝化侏儒菌目是本湿地中唯一的优势氨氧化古菌类群. 在深层沉积物中亚硝化侏儒菌目的相对丰度最低, 可能是受深层低氧气含量的限制. 有研究表明, 低氧环境会抑制亚硝化侏儒菌目的生长, 但其自身能够产生少量氧气进行氨氧化代谢[37]. 亚硝化侏儒菌目是海水及海洋沉积物的优势氨氧化古菌, 是第一类成功分离培养的氨氧化古菌, 其存在表明该环境氮代谢活跃[38]. 有大量研究指出pH和NH4+-N是影响氨氧化古菌的重要因素[39-40]. 由图5(a)可见, 氨氧化古菌的相对丰度分布规律与pH趋势相一致. 有研究者对全球范围内的土壤微生物研究发现, 在酸性(pH<5)、中性(5≤pH<7)和碱性(pH>7)土壤中存在不同生态类型的氨氧化古菌[41], 但多数氨氧化古菌更适应在中性或弱碱性条件下生长[42-43]; 在pH 6~8的土壤中, 氨氧化古菌相对丰度随pH的增加而增加[41]. 互花米草湿地为弱碱性, 根际的平均pH值(8.0)高于表层平均pH值(7.55)和深层平均pH值(7.35), Mantel检验分析表明氨氧化古菌与pH呈显著正相关(表4), 与文献结果类似. 也有研究者指出, 在酸性茶园土壤中的氨氧化古菌与pH值呈显著负相关[44], 这可能是适应酸性环境的氨氧化古菌随着pH的增加而生长受到抑制. 由于高氨养殖尾水的直排, 导致本湿地表层平均NH4+-N值(129.22mg·kg-1)显著高于根际平均NH4+-N值(58.09mg·kg-1)和深层平均NH4+-N值(8.12mg·kg-1) (表1), Mantel检验分析氨氧化古菌群落与NH4+-N呈显著正相关. 铵氮作为氨氧化过程的底物和氨氧化微生物的能量来源, 显著影响着氨氧化古菌群落. Verhamme等[45]将土壤分别置于低、中和高氨环境下培养一个月, 发现氨氧化古菌在各铵氮条件下均能生长. 更有研究者在NH4+-N质量浓度高达100mg·L-1的污水处理厂中检测出氨氧化古菌[46], 在NH4+-N质量浓度低于5μg·L-1的远洋中依然能够检测出氨氧化古菌[47]. 氨氧化古菌具有较丰富多样性, 能在较广的NH4+-N浓度范围内生长[47]. 相反, 氨氧化古菌也会通过影响沉积物中的环境因子进一步净化湿地环境. 氨氧化古菌的生长需要吸收部分氮素作为能量来源, 也能参与硝化作用, 将铵氮转化为硝氮, 供给植物吸收利用. 由于植物吸收有限, 其多余硝酸盐可通过厌氧呼吸(例如脱氮和氨氧化)进一步转化为氮气, 以降低沉积物中的高浓度氨对水生生物的毒性[48]. 本研究中, 根际氨氧化古菌的相对丰度最高, 参与硝化过程的群落也会更多, 这也可能是导致本湿地根际NH4+-N较低, 而NO3--N含量最高的原因之一. 总之, 人工湿地的有效除氮机制需要以植物和微生物为主导.
4 结论
本研究分析了互花米草人工湿地尾水处理过程中沉积物的古菌群落组成, 比较了不同区域及不同位点沉积物的古菌群落结构, 结合测定的理化性质分析了沉积物古菌群落与环境因子之间的关系, 主要研究结论如下:
(1)互花米草人工湿地能够有效地脱氮除磷, 增加沉积物有机碳含量, 在尾水净化过程中发挥重要作用.
(2)所研究湿地中的优势古菌为泉古菌门、广古菌门和奇古菌门. 亚硝化侏儒菌目为沉积物中主要的氨氧化古菌, 其相对丰度呈根际>表层>深层的变化趋势. pH和NH4+-N是影响氨氧化古菌生长的主要环境因子, 氨氧化古菌也能参与铵氮转化净化湿地环境. 产甲烷古菌群落组成稳定, 主要通过自身吸收碳源降低湿地中的高浓度营养盐.
[1] Yu Q R, Fu Z Q, Huang M X, et al. Growth, physiological, biochemical, and molecular responses of Pacific white shrimpfed different levels of dietary selenium[J]. Aquaculture, 2021, 535(4): 736393.
[2] Cheng Y M, Ge C R, Li W, et al. The intestinal bacterial community and functional potential ofin the coastal areas of China[J]. Micro- organisms, 2021, 9(9):1793.
[3] Zuo P, Zhao S H, Liu C A, et al. Distribution ofsppalong China’s coast[J]. Ecological Engineering, 2012, 40:160-166.
[4] Chung C H, Zhuo R Z, Xu G W. Creation ofplantations for reclaiming Dongtai, China, tidal flats and offshore sands[J]. Ecological Engineering, 2004, 23(3): 135-150.
[5] Callaway R M, Thelen G C, Rodriguez A, et al. Soil biota and exotic plant invasion[J]. Nature, 2004, 427(6976): 731-733.
[6] Yang W, Jeelani N, Zhu Z H, et al. Alterations in soil bacterial community in relation toLoiselinvasion chronosequence in the eastern Chinese coastal wetlands[J]. Applied Soil Ecology, 2019, 135:38- 43.
[7] Zheng J, Li J J, Lan Y Q, et al. Effects ofinvasion on Kandelia candel rhizospheric bacterial community as determined by high-throughput sequencing analysis[J]. Journal of Soils and Sediments, 2019, 19(1):332-344.
[8] Zhang G L, Bai J, Jia J, et al. Shifts of soil microbial community composition along a short-term invasion chronosequence ofin a Chinese Estuary[J]. Science of the Total Environment, 2019, 657:222-233.
[9] Demirel B, Scherer P. The roles of acetotrophic and hydrogenotrophic methanogens during anaerobic conversion of biomass to methane: A review[J]. Reviews in Environmental Science and Bio/Technology, 2008, 7(2):173-190.
[10] Kvenvolden K A. Potential effects of gas hydrate on human welfare[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3420-3426.
[11] Wu D, Zhao C, Bai H, et al. Characteristics and metabolic patterns of soil methanogenic archaea communities in the high-latitude natural forested wetlands of China[J]. Ecology and Evolution, 2021, 11(15):10396-10408.
[12] Pump J, Pratscher J, Conrad R. Colonization of rice roots with methanogenic archaea controls photosynthesis- derived methane emission[J]. Environmental Micro- biology, 2015, 17(7):2254-2260.
[13] Mayumi D, Mochimaru H, Tamaki H, et al. Methane production from coal by a single methanogen[J]. Science, 2016, 354(6309):222-225.
[14] Zhou Z, Zhang C J, Liu P F, et al. Non-syntrophic methanogenic hydrocarbon degradation by an archaeal species[J]. Nature, 2022, 601(7892):257-262.
[15] Spang A, Caceres E F, Ettema T J G. Genomic exploration of the diversity, ecology, and evolution of the archaeal domain of life[J]. Science, 2017, 357(6351): 3883.
[16] Herrmann M, Saunders A M, Schramm A. Effect of lake trophic status and rooted macrophytes on community composition and abundance of ammonia-oxidizing prokaryotes in freshwater sediments[J]. Applied and Environmental Microbiology, 2009, 75(10):3127-3136.
[17] Xie J H, Yan J, He H X, et al. Evaluation of the key factors to dominate aerobic ammonia-oxidizing archaea in wastewater treatment plant[J]. International Biodeterio- ration & Biodegradation, 2021, 164:150289.
[18] 张涛, 史会来, 平洪领, 等. “浙江省南美白对虾(海水)集约化养殖尾水处理现状”调研报告[J]. 水产养殖, 2020, 41(3):71-73.
[19] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000:49.
[20] Iber B T, Kasan N A. Recent advances in shrimp aquaculture wastewater management[J]. Heliyon, 2021, 7(11):e08283.
[21] Wong Y S, Tam N F Y, Lan C Y. Mangrove wetlands as wastewater treatment facility: A field trial[J]. Hydrobiologia, 1997, 352:49-59.
[22] Liu F, Sun L, Wan J B, et al. Performance of different macrophytes in the decontamination of and electricity generation from swine wastewater via an integrated constructed wetland-microbial fuel cell process[J]. Journal of Environmental Sciences, 2020, 89(3):252-263.
[23] Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57(1):233-266.
[24] Brix H. Do macrophytes play a role in constructed treatment wetlands?[J]. Water Science and Technology, 1997, 35(5):11-17.
[25] 熊飞, 李文朝, 潘继征, 等. 人工湿地脱氮除磷的效果与机理研究进展[J]. 湿地科学, 2005, 3(3):228-234.
[26] 赵倩, 庄林岚, 盛芹, 等. 潜流人工湿地中基质在污水净化中的作用机制与选择原理[J]. 环境工程, 2021, 39 (9):14-22.
[27] Tripathi B M, Kim M, Lai-Hoe A, et al. pH dominates variation in tropical soil archaeal diversity and community structure[J]. FEMS Microbiology Ecology, 2013, 86(2):303-311.
[28] Fan L M, Barry K, Shi L L, et al. Archaeal community compositions in tilapia pond systems and their influencing factors[J]. World Journal of Microbiology & Biotechnology, 2018, 34(3):43.
[29] 陈明明, 王少璞, 韦梦, 等. 象山港网箱养殖区沉积物的古菌空间分布[J]. 生态学报, 2014, 34(14):4099-4106.
[30] 王风平, 周悦恒, 张新旭, 等. 深海微生物多样性[J]. 生物多样性, 2013, 21(4):445-456.
[31] Pan J, Zhou Z C, Béjà O, et al. Genomic and transcriptomic evidence of light-sensing, porphyrin biosynthesis, Calvin-Benson-Bassham cycle, and urea production in Bathyarchaeota[J]. Microbiome, 2020, 8(1): 1-12.
[32] Zhi S L, Li Q, Yang F X, et al. How methane yield, crucial parameters and microbial communities respond to the stimulating effect of antibiotics during high solid anaerobic digestion[J]. Bioresource Technology, 2019, 283:286-296.
[33] 杨秀山, 李军, 田沈,等. 固定化甲烷八叠球菌及处理高浓度有机废水研究[J]. 环境科学学报, 2003, 23(2): 282-284.
[34] Thauer R K. Biochemistry of methanogenesis: A tribute to marjory stephenson[J]. Microbiology, 1998, 144(9): 2377-2406.
[35] Brochier-Armanet C, Boussau B, Gribaldo S, et al. Mesophilic crenarchaeota: Proposal for a third archaeal phylum, the Thaumarchaeota[J]. Nature Reviews Microbiology, 2008, 6(3):245-252.
[36] Yang J, Jiang H, Dong H, et al. amoA-encoding archaea and thaumarchaeol in the lakes on the northeastern Qinghai-Tibetan Plateau, China[J]. Frontiers in Micro- biology, 2013, 4:329.
[37] Kraft B, Jehmlich N, Larsen M, et al. Oxygen and nitrogen production by an ammonia-oxidizing archaeon [J]. Science, 2022, 375(6576):97-100.
[38] Stahl D A, de la Torre J R. Physiology and diversity of ammonia-oxidizing archaea[J]. Annual Review of Microbiology, 2012, 66:83-101.
[39] Hu B L, Liu S, Wang W, et al. pH-dominated niche segregation of ammonia-oxidising microorganisms in Chinese agricultural soils[J]. FEMS Microbiology Ecology, 2014, 9(1):290-299.
[40] Zhang Y, Chen L J, Dai T J, et al. Ammonia manipulates the ammonia-oxidizing archaea and bacteria in the coastal sediment-water microcosms[J]. Applied Microbiology and Biotechnology, 2015, 99(15):6481-6491.
[41] Gubry-Rangin C, Hai B, Quince C, et al. Niche specialization of terrestrial archaeal ammonia oxidizers[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(52):21206-21211.
[42] Tourna M, Stieglmeier M, Spang A, et al., an ammonia oxidizing archaeon from soil[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(20):8420-8425.
[43] Kim J G, Jung M Y, Park S J, et al. Cultivation of a highly enriched ammonia-oxidizing archaeon of thaumar- chaeotal group I.1b from an agricultural soil[J]. Environmental Microbiology, 2012, 14(6):1528-1543.
[44] Yao H Y, Gao Y M, Nicol G W, et al. Links between ammonia oxidizer community structure, abundance, and nitrification potential in acidic soils[J]. Applied and Environmental Microbiology, 2011, 77(13):4618-4625.
[45] Verhamme D T, Prosser J I, Nicol G W. Ammonia concentration determines differential growth of ammonia- oxidising archaea and bacteria in soil microcosms[J]. Multidisciplinary Journal of Microbial Ecology, 2011, 5(6):1067-1071.
[46] Park H D, Wells G F, Bae H, et al. Occurrence of ammonia-oxidizing archaea in wastewater treatment plant bioreactors[J]. Applied and Environmental Microbiology, 2006, 72(8):5643-5647.
[47] Treusch A H, Leininger S, Kletzin A, et al. Novel genes for nitrite reductase and Amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling[J]. Environmental Microbiology, 2005, 7(12): 1985-1995.
[48] Al-Ajeel S, Spasov E, Sauder L A, et al. Ammonia- oxidizing archaea and complete ammonia-oxidizingin water treatment systems[J]. Water Research X, 2022, 15:100131.
Composition and distribution of archaea community in constructed wetland for treatment of mariculture wastewater byLoisel
TAN Ying1, HU Yuehang1, QIAN Yunxia1, GUO Annan2,3*
( 1.School of Marine Sciences, Ningbo University, Ningbo 315832, China; 2.College of Food and Pharmaceutical Sciences, Ningbo University, Ningbo 315832, China; 3.Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province, Ningbo 315832, China )
The constructed wetland, which planted withLoisel, was used to treat the tail water ofculture. In order to elucidate the composition and distribution of archaea community in wetland sediments and the impact of the rhizosphere, the environmental factors, community structure, diversity of archaea, and their relationship were analyzed in the present study. The results showed that the diversity of archaeal community in the deep sediments was significantly higher than that of surface and rhizosphere sediments. At the phylum level, the dominant archaea were Crenarchaeota, Euryarchaeota and Thaumarchaeota. At the class level, the dominant archaea include Bathyarchaeia, Methanomicrobia and Thermoplasmata. Three kinds of ammonia-oxidizing archaea and seven kinds of methanogenic archaea were found in the constructed wetland at the order level. Non-metric multidimensional scaling (NMDS) analysis showed that the archaeal community in the rhizosphere sediments was significantly (<0.05) different from the deep sediments, but similar with the surface layers. Redundancy analysis (RDA) and Mantel test showed that the main environmental factors affecting the archaeal community included pH, ammonium (NH4+), total organic carbon (TOC) and total phosphorus (TP). The ammonia-oxidizing archaea (AOA) were significantly and positively correlated with pH, NH4+, total nitrogen (TN) and TP (<0.01). The above results showed that artificial planting ofLoiselhad changed the archaeal community of wetland sediments and was important for the treatment of mariculture tailwater.
archaea community;Loisel; sediment; mariculture tailwater
X826
A
1001-5132(2023)03-0001-09
2022−08−25.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
浙江省重点研发计划项目(2019C02055); 宁波市公益项目(202002N3002).
谭莹(1997-), 女, 湖北宜昌人, 在读硕士研究生, 主要研究方向: 微生物生态. E-mail: tanying199702@163.com
通信作者:郭安南(1980-), 女, 安徽庐江人, 实验师, 主要研究方向: 微生物学. E-mail: guoannan@nbu.ed
(责任编辑 章践立)

