肝癌组织中p-STAT3、VIP的表达及与患者生存的相关性分析
李 一
河南省邓州市中心医院肿瘤一科 474150
肝癌为主要的消化系统恶性肿瘤,调查显示,全球每年新增85万例肝癌患者,多数患者发现时已至中晚期,严重威胁患者生命。研究发现,即使经过手术治疗,肝癌的复发率仍然较高。目前认为,肝癌患者术后生存与病毒感染、脉管侵犯、甲胎蛋白水平等多种因素相关,但是在评估肝癌患者预后中的应用有限,肝癌患者预后评估的敏感性指标仍需进一步探索。磷酸化信号转导及转录活化因子3(Phosphorylated-signal transducer and activator of transcription 3,p-STAT3)为信号转导及转录活化因子3(Signal transducer and activator of transcription 3 ,STAT3)的活化产物,研究发现,其与肝硬化组织的癌变明显相关[1]。血管活性肠肽(Vasoactive intestinal peptide,VIP)为内含28个氨基酸的碱性脑肠肽,研究发现,其可通过巨噬细胞的极化促进肝癌的发生和发展[2]。但是目前关于肝癌组织p-STAT3、VIP与患者生存的相关性研究较少。因此,本文以80例肝癌患者为研究对象,对此进行了分析,报道如下。
1 资料与方法
1.1 一般资料 纳入2015年3月—2018年2月我院肿瘤科收治的肝癌患者80例,其中男57例,女23例,年龄26~71岁,平均年龄(48.95±13.54)岁,肿瘤直径3~8cm,平均肿瘤直径(5.18±1.45)cm,AJCC临床分期:Ⅰ期35例,Ⅱ期19例,Ⅲ期21例,Ⅳ期5例。患者均签署知情同意书,本研究经医院医学伦理委员会审核批准。纳入标准:确诊为原发性肝癌[3];资料完整;接受随访。排除标准:术前行放化疗等相关治疗者;伴其他恶性肿瘤;继发性肝癌;自身免疫性疾病;合并其他消化系统疾病;血液系统疾病;不配合治疗者。
1.2 观察指标 (1)所有患者均行肝切除术,术中取肝癌组织和癌旁组织制作蜡块标本,肝癌组织蜡块均经病理诊断,确认为肝细胞性肝癌,癌旁组织蜡块确认为肝脏正常组织。将患者石蜡标本制成4μm切片后,使用免疫组化法测定肝癌病理组织和癌旁组织中的p-STAT3、VIP表达,其中p-STAT3在细胞核内表达,VIP在细胞质中表达。随后将切片置于高倍显微镜下观察,阴性对照为PBS缓冲液,阳性对照为已知的p-STAT3、VIP阳性切片。免疫组化结果由1名经验丰富的病理科医师随机取5个高倍镜视野进行染色强度和着色细胞占比评分:染色强度中,0分未着色,1分轻度着色,2分中度着色,3分重度着色;着色细胞占比中,0分为占比≤5%,1分为5%<占比≤25%,2分为25%<占比≤50%,3分为占比>50%。两项乘积即为免疫组化最终评分,评分≥4分为高表达,低于4分即为低表达。免疫组化S-P试剂盒、p-STAT3抗体、VIP抗体均购买自美国圣克鲁斯生物技术公司。(2)对所有患者术后进行电话或门诊随访,记录肝癌患者总生存时间(Overall survival,OS),其中OS为患者术后至死亡或末次随访的总时间,末次随访日期为2021年2月。使用Kaplan-Meier法对不同p-STAT3、VIP表达患者进行生存分析。(3)分析影响肝癌患者生存的单因素。比较不同临床特征肝癌患者的3年生存率。(4)将单因素结果中差异有统计学意义的因素纳入COX多元回归中,分析影响肝癌患者生存的危险因素。

2 结果
2.1 p-STAT3、VIP在肝癌及癌旁组织中的高表达率比较 p-STAT3、VIP在肝癌组织中的高表达率高于癌旁组织,差异有统计学意义(P<0.05)。见表1。

表1 p-STAT3、VIP在肝癌及癌旁组织中的高表达率比较 [n(%)]
2.2 不同p-STAT3、VIP表达患者的OS比较 80例肝癌患者均获得有效随访,无失访病例,随访时间7~53个月,中位随访时间为26个月。p-STAT3低表达患者的OS为(36.32±2.59)个月,高表达患者为(24.76±2.20)个月,VIP低表达患者的OS为(40.53±3.53)个月,高表达患者为(26.50±1.91)个月。p-STAT3和VIP低表达肝癌患者的OS均高于高表达患者,差异有统计学意义(χ2=7.943、7.311,P<0.05)。见图1和图2。
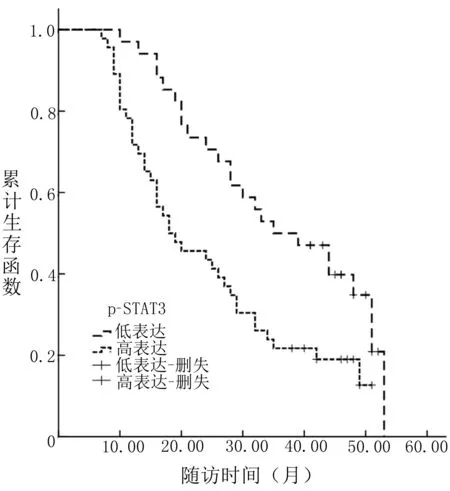
图1 不同p-STAT3表达患者的OS比较

图2 不同VIP表达患者的OS比较
2.3 影响肝癌患者生存的单因素分析 80例肝癌患者的3年生存率为33.75%(27/80)。单因素分析表明,肿瘤包膜不完整、p-STAT3高表达、VIP高表达均与患者3年生存率相关(P<0.05)。见表2。

表2 影响肝癌患者生存的单因素分析[n(%)]
2.4 影响肝癌患者生存的危险因素 将肿瘤包膜不完整、p-STAT3高表达、VIP高表达纳入影响肝癌患者生存的COX回归分析中,赋值方法:肿瘤包膜不完整(是=1,否=0),p-STAT3高表达(是=1,否=0),VIP高表达(是=1,否=0)。结果表明,肿瘤包膜不完整、p-STAT3高表达、VIP高表达均为影响肝素患者生存的危险因素(P<0.05)。见表3。

表3 影响肝癌患者生存的危险因素
3 讨论
肝癌早期症状不典型,大部分患者确诊时已至中晚期,调查显示,尽管医疗技术的进步使肝癌患者预后得到一定改善,但是5年生存率仍然较低,约为14.1%,目前肝癌已经成为恶性肿瘤患者致死的主要疾病类型[4]。肝癌的复发和转移为影响肝癌患者术后生存的主要因素,其中p-STAT3可通过调控抗凋亡基因survivin等多种活性因子水平,促进肿瘤细胞的增殖和侵袭,研究发现,肝癌组织中p-STAT3的表达量与肿瘤直径、TNM分期等具有明显的相关性[5]。VIP为机体内分泌和免疫系统的重要调节因子,研究发现,其可通过磷脂酰肌醇3-激酶、Ras蛋白/丝裂原活化蛋白激酶等通路,阻碍免疫监视,促进肿瘤逃逸[6]。通过明确p-STAT3和VIP与肝癌患者生存的相关性,可为肝癌患者治疗方案优化及预后评估提供相关依据。
本文发现,p-STAT3、VIP在肝癌组织中的高表达率均明显高于癌旁组织,提示p-STAT3、VIP均可能与肝癌的进展相关。其中p-STAT3主要位于细胞核中,可通过激活细胞增殖凋亡相关基因,阻碍缺氧诱导因子-1α的降解,促使细胞的增殖失调以及恶性转化,此外,p-STAT3还可通过上调血管内皮生长因子水平,促进肿瘤新生血管的生成,进而参与至肝癌的发生发展中[7]。正常情况下,VIP可通过与肝细胞表面的VIP受体相结合,在肝细胞内与溶酶体作用失活,肝癌的发生可导致患者肝功能障碍,影响VIP受体活性,进而使肝脏组织中VIP失活减少,表达升高[8]。
本文发现,p-STAT3和VIP低表达肝癌患者的OS均明显高于高表达患者,且p-STAT3高表达、VIP高表达均为影响肝素患者生存的危险因素。其中p-STAT3高表达可通过胚胎发育相关基因Twist和类胰岛素生长因子通路调控转录因子Slug水平,促进肿瘤细胞的上皮间质转化,有助于肝癌细胞的迁移和侵袭,增加了肝癌复发和转移的风险,进而不利于患者预后[9]。VIP高表达可通过增强葡萄糖苷酶2蛋白活性,减少肿瘤细胞凋亡,促使肿瘤细胞逃逸,此外,VIP还可通过促使M2型巨噬细胞水平的增加,减少机体T细胞水平,进而有助于肿瘤细胞的转移,提高了肝癌患者复发的风险[10]。此外,本文中,肿瘤包膜不完整与患者生存明显相关,这可能是由于对于包膜不完整的肿瘤细胞,可明显增加其向血管和肝脏浸润的风险,并有助于提高微卫星灶的发生率,使肝癌复发和转移的风险增加,进而使生存期缩短[11]。
综上所述,肝癌组织中p-STAT3和VIP均呈高表达,且与患者生存明显相关,提示p-STAT3和VIP均可作为肝癌患者预后评估的有效指标。

