改良内镜下黏膜摘除术治疗消化道息肉的临床效果分析
陈瑶莉 刘文俊
(1.铜川市人民医院消化内科,陕西 铜川 727100;2.汉中市南郑区人民医院消化内科,陕西 汉中 732100)
息肉是一种赘生物,发于人体组织的黏膜表面,属于良性肿瘤的一种类型。临床对息肉的命名依据为其所发生的部位。消化道是息肉的高发部位,常见于大肠(结肠和直肠),而小肠则较为少见[1]。由于息肉形成时大多数患者并未明显临床症状,很多临床患者在其它疾病诊治过程中发现,随着息肉的长大,其发生癌变的风险越来越高[2]。鉴于息肉的危害,临床对于消化道息肉患者,一旦确诊应及早采用外科手术进行切除,避免其恶变为癌。随着显微技术的发展,内镜下息肉切根治术成为临床主要的手术方式,经典手术方案为内镜下电切术但其存在切除不彻底易复发的风险。随着手术经验的积累及新方法的探索,改良内镜下黏膜摘除术应运而生。本方案对比分析内镜下电切术与改良内镜下黏膜摘除术的切除效果及安全性,为临床此类患者手术优选提供参考依据。
1 资料与方法
1.1一般资料 选取2018年4月至2021年3月拟在我院行手术治疗的消化道息肉摘除术患者100例,其中50例采用内镜下常规电切术治疗设为对照组,50例采用改良内镜下黏膜摘除术治疗设为观察组。对照组男31例,女19例;年龄(57.12±8.07)岁,体质量指数(24.12±3.37)kg/m2;息肉位置构成:胃14例,大肠35例,小肠1例;子肉直径(1.61±0.52)cm;息肉数量:1枚42例,2枚及以上8例;息肉形态构成:扁平息肉11例,有蒂息肉28例,广基息肉11例。观察组男33例,女17例;年龄(57.08±8.12)岁;体质量指数(24.08±3.33)kg/m2;息肉位置构成:胃13例,大肠36例,小肠1例;息肉直径(1.57±0.54)cm;息肉数量:1枚41例,2枚及以上9例;息肉形态构成:扁平息肉10例,有蒂息肉29例,广基息肉11例。纳入标准[3]:所有患者均出现消化道症状就诊后并经内镜检查确诊为消化道息肉;符合手术治疗指征,知晓手术利弊,签署知情同意书。排除标准:合并严重心脑血管系统、神经系统、血液系统、肝肾功能等疾病影响手术及术后康复者;怀孕、哺乳妇女;随访资料收集不全者。两组一般资料比较差异无统计学意义(P>0.05)。
1.2方法 两组患者均由同一组消化科手术医师及护士实施手术,术前进行访视,使患者知晓手术流程、围术期注意事项及需配合事项。对照组采取内镜下黏膜电切术:常规术前上消化道准备或肠道手术准备,若为胃息肉则行上消化道内镜,肠道息肉则行肠道内镜手术;全麻,取左侧卧位,头颈部、脊柱处于同一平面,镜下观察到0.5 cm以下无蒂息肉,吸净息肉水分后活检钳钳除息肉;观察到直径超过0.5 cm无蒂息肉,先在息肉黏膜处注射肾上腺素,再用套圈器套紧息肉底部,息肉隆起后采用年高频电凝刀切除息肉并电凝止血,若为直径超过0.5 cm的有蒂息肉,采用电凝直接切除,取出息肉组织、撤除内镜;术后卧床静养,禁食24 h后予以流食1周,逐渐过渡到清淡易消化日常饮食,根据手术部位予以药物康复治疗,胃部息肉予以质子泵抑酸剂,肠道息肉予以抗生素,合理补液,忌生冷饮食及烟酒、油腻、刺激食物。观察组采取改良内镜下黏膜摘除术:术前准备及手术方式选择同对照组,内镜下找到病灶后,沿着病灶边缘1~2 mm周围指向病灶中心点斜行注射靛胭脂、肾上腺素(浓度:1:10 000)、0.9%氯化钠注射液混合液,观察到息肉基底完全抬起暴露后,用圈套器套扎高频电凝切除息肉;根据创面情况可采取止血或创面荷包缝合,创面较小者采用钛铗夹闭,息肉取出后撤出内镜,术后处理同对照组患者。
1.3观察指标 比较两组患者手术指标(手术时间、术中出血量、术后进食时间、术后下床活动时间、术后住院时间);两组患者息肉切除情况;两组患者随访期间并发症情况。
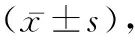
2 结 果
2.1手术指标比较 两组手术耗时、术后进食时间、术后下床活动时间及术后住院时间组间差异无统计学意义(t=0.137、1.257、1.374、1.341,P>0.05),观察组术中出血量低于对照组(t=4.571,P<0.05)。见表1。
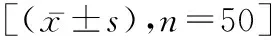
表1 两组患者手术指标比较
2.2息肉切除率比较 观察组患者息肉一次性切除率94.00%(47/50)明显高于对照组的84.00%(42/50)(χ2=3.461,P<0.05)。
2.3并发症发生率及复发率比较 对照组患者出现术后疼痛3例、穿孔2例、息肉残留2例,并发症发生率16.00%;观察组患者出现术后疼痛1例、穿孔1例、息肉残留1例,并发症发生率6.00%。观察组患者术后并发症发生率低于对照组(χ2=6.137,P<0.05)。随访1年,观察组患者息肉复发率2.00%低于对照组8.00%(χ2=4.139,P<0.05)。
3 讨 论
消化道息肉的诱因较多,如饮食习惯、生活朝夕、遗传、免疫系统、慢性炎症均可导致息肉消化道息肉的发生。随着临床研究的深入,息肉的癌变倾向越来越受到临床的重视[4]。一旦发现消化道息肉应及早进行有效切除治疗,避免癌变的发生。由于消化道息肉位置较深,内镜下行消化道息肉切除是临床主要手术方式。本方案对改良内镜下消化道息肉摘除术的临床疗效及安全性与电切术进行比较,以期为临床手术方式优选提供参考。
本文结果显示,相较于单纯内镜下消化道息肉黏膜电切术,改良内镜下黏膜摘除术术中出血量更小,术后并发症率及复发率更低,息肉完切率更高,说明改良内镜下黏膜摘除术是优于常规内镜下黏膜电切术的临床疗效及安全性。改良内镜下黏膜摘除术通过对息肉黏膜下层注射肾上腺素,使息肉周围的血管产生收缩,使得黏膜在短暂时间内隆起,病灶基底层与固有肌层充分分离,利于电切刀切除操作,从而提高了切除成功率[5],同时切除过程对固有肌层的撕裂更小,出血量更小。充分体现了该手术是摘除息肉的特点,而减轻了切除的操作。同时,息肉隆起与固有肌层分离,使得手术操作者可更好地控制息肉的切除深度,从而降低术中出血量[6]。内镜下黏膜切除术治疗时,由于存在液体垫,抬高了粘膜病变组织,使得黏膜下厚度明显增加,再行圈套高频电流切除,有效避免了高频电对消化道造成的损伤,从而减少了穿孔、术后疼痛等并发症率,提升了手术的安全性。
综上所述,改良内镜下黏膜摘除术治疗消化道息肉可有效提升息肉切除率,降低术后并发症发生率及复发率,是更适合消化道息肉患者的手术治疗方案。

