新型冠状病毒奥密克戎变异株胸部CT 征象演变及与野生型对照研究
王莉,史丽霞,丁文龙,杨晴媛,仲玲珊,李楠,赵新骞,邢志珩
新型冠状病毒(SARS-COV-2)的奥密克戎(Omicron)变异株被世界卫生组织(WHO)定为关切变异株[1],其表现出更高的传染性和免疫逃避能力,这与病毒刺突蛋白的突变有关。尽管Omicron 引起的症状比之前的毒株更温和,但较野生型(wild-type,WT)毒株的传播速度迅速增加,病例数量也明显增多[2]。目前,新型冠状病毒感染(corona virus disease 2019,COVID-19)病人仍主要采用胸部CT 评价胸部病变情况,既往有研究对Omicron 与其他变异株的临床及CT 影像表现进行了比较[3-5],但对Omicron病人住院期间胸部CT 动态演变分析较少。本研究对2022 年天津Omicron 变异株病人胸部CT 征象归纳、分析,并与2020 年WT 病人的临床及影像资料比较,以总结Omicron 病人胸部病变演变规律。
1 资料与方法
1.1 研究对象 回顾性纳入2022 年1—2 月于天津市海河医院诊断为Omicron 感染的416 例病人(Omicron 组),以及2020 年1—2 月确诊为SARSCOV-2 感染且有武汉旅居史(或为其密接)的128例WT 病人(WT 组)。其中,住院期间胸部CT 出现肺炎表现的病人,Omicron 组有134 例,WT 组有123 例。纳入标准:(1)经SARS-COV-2 核酸检测阳性,且Omicron 组经全病毒基因组测序诊断明确分型;(2)符合《新型冠状病毒肺炎诊疗方案(试行第八版)》诊断标准[6];(3)临床资料完整,包括性别、年龄、临床表现(发热、咳嗽和咳痰、咽痛、鼻塞流涕、腹泻/腹痛)和疫苗接种情况;(4)住院期间至少行3次胸部CT 检查。排除标准:(1)影像资料欠清晰;(2)患有其他肺部疾病(包括传染病、肿瘤和间质病变);(3)有肺部手术史;(4)妊娠期。
1.2 设备与方法 采用佳能(东芝)64 层螺旋CT 扫描设备(Aquilion Prime 128,Canon Medical Systems,Otawara,日本)进行扫描。受试者接受深吸气屏气训练,于深吸气后屏息时扫描,范围自肺尖到肺底。扫描参数:管电压120 kV,自动管电流调节,扫描层厚5 mm,层间距5 mm,螺距为1.5,视野(FOV)500 mm×500 mm,旋转时间0.5 s/r,矩阵512×512,准直器宽度64×0.5 mm。重建层厚1.0 mm,层间距0.8 mm。
1.3 影像数据分析 影像数据上传至Vitrea v4.0.704.1 工作站进行处理和分析。选择肺窗(1 600 HU,-500 HU)、纵隔窗(400 HU,40 HU)阅片。由2 名具有5 年以上胸部影像诊断经验的医生独立对病人CT 影像分析,如评判不一致则由1 名具有15 年以上胸部影像诊断经验的医生确定分析结果。有症状病人以症状出现的时间作为起病时间,即第1 天;无症状病人以首次核酸检测阳性的时间作为第1 天[7]。将起病时间与CT 检查时间的间隔定义为间隔时间。
1.3.1 视觉严重程度评分(visual severity score,VSS) 采用VSS 方法[8]对胸部影像进行评分,通过计算单个肺叶病灶面积占相应肺叶总面积的比例并评估,5 个肺叶总评分为双肺VSS(0~20 分):(1)0 分,肺叶无病灶;(2)1 分,病灶占比1%~25%;(3)2 分,病灶占比26%~50%;(4)3 分,病灶占比51%~75%;(5)4 分,病灶占比76%~100%。对2 组病人首次阳性CT、高峰CT(多次CT 中选择肺炎病灶范围最大者)影像进行VSS 评分,并记录相应检查的间隔时间。
1.3.2 CT 征象分类 分析Omicron 组病人住院期间出现肺炎的CT 影像特征(134 例病人共281 次胸部CT 检查)。根据Fleischner 学会胸部CT 征象分类[9],评价如下内容:(1)主要征象,磨玻璃密度、实变;(2)伴随征象,小叶间隔增厚、小叶内间隔增厚、纤维索条、反晕征、网格影、胸膜下线、牵拉性支气管扩张;(3)病灶分布,胸膜下分布为主、沿支气管血管束分布为主、2 种分布均等;(4)肺外征象,纵隔淋巴结肿大、心包积液、胸腔积液。根据间隔时间分为不同病程,并分析相应病程中的征象:(1)第1 阶段(第1—5 天);(2)第2 阶段(第6—9 天);(3)第3阶段(第10—14 天);(4)第4 阶段(第15 天后)[10]。
1.4 统计分析 采用SPSS 26.0 软件进行数据分析。计量资料采用Kolmogorov-Smirnov 检验分析是否符合正态分布,非正态分布的计量资料以中位数[M(P25,P75)]表示,2 组间比较采用Mann-Whitney U检验。计数资料以例(%)表示,2 组间比较采用χ2检验或Fisher 确切概率检验。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组间临床资料比较 与WT 组相比,Omicron组年龄较低,疫苗接种率较高;出现发热和乏力者较少,而咽痛和鼻塞流涕较多(均P<0.05)。2 组间其他临床资料的差异无统计学意义(均P>0.05),详见表1。
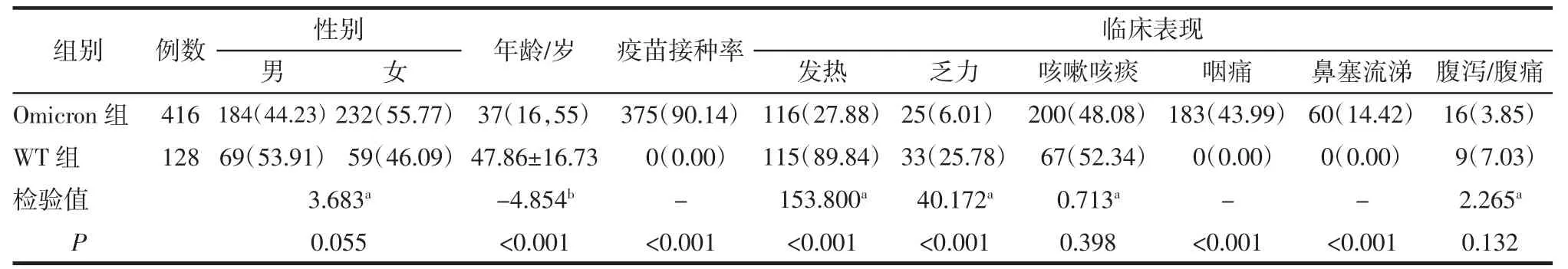
表1 2 组病人临床资料的比较 例(%)
2.2 2 组间CT 阳性率、VSS 评分及间隔时间比较 Omicron 组首次CT 阳性率和住院期间CT 阳性率均低于WT 组(均P<0.05),首次阳性CT 和高峰CT 的VSS 均低于WT 组(均P<0.05),高峰CT的间隔时间长于WT 组(P<0.05),详见表2。

表2 2 组间阳性率、VSS 评分及间隔时间比较 例(%)
2.3 Omicron 组胸部CT 征象动态演变 134 例Omicron 病人住院胸部CT 分析显示,以胸膜下区(≥60.27%)分布磨玻璃密度影(≥97.87%)为主要胸部CT 表现,随时间进展,肺实变比例增多(27.59%~66.07%)。第10 天后,小叶内间隔增厚、纤维索条、胸膜下线、牵拉性支气管扩张、心包积液及胸腔积液比例增高。详见表3,图1-2。
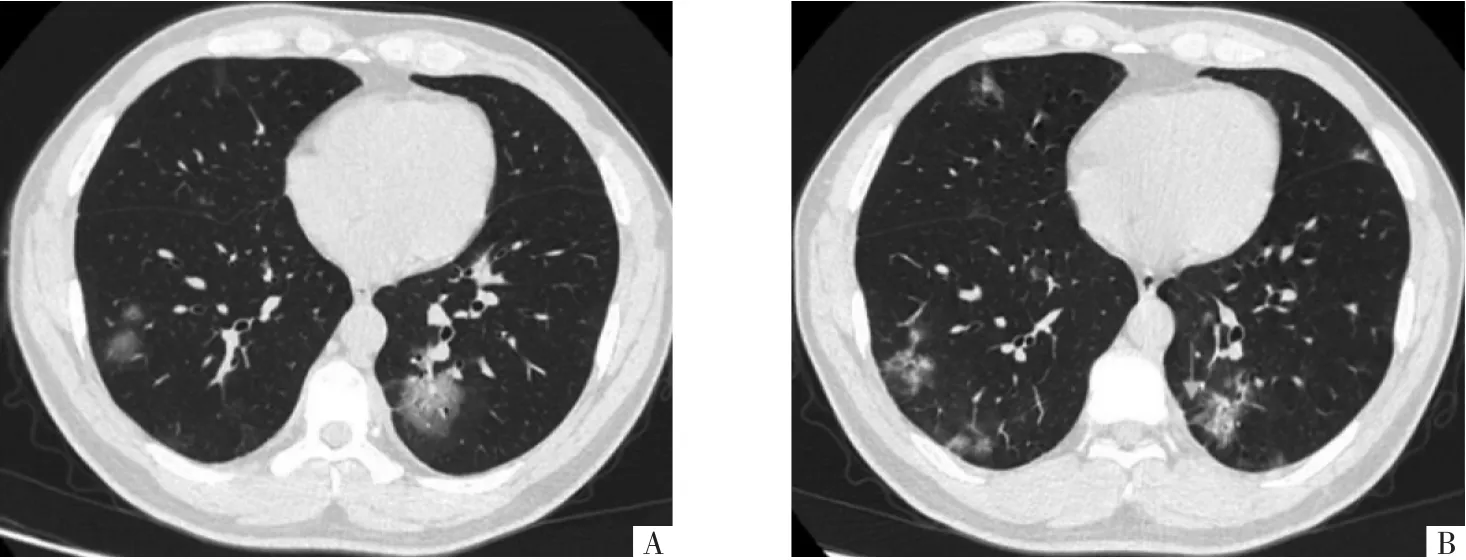
图1 Omicron 病人,男,42 岁。A 图为第7 天胸部CT 影像(第2 阶段、急性期),双肺胸膜下区多发磨玻璃密度,边界欠清晰;B 图为第13 天胸部CT 影像(第3 阶段、机化期),双肺病灶密度轻度增高,边界清晰,形态不规则,呈收缩趋势,左肺下叶显示小叶间隔增厚(箭头)。

图2 Omicron 病人胸部CT 征象。A 图为小叶内间隔增厚(箭头);B 图为胸膜下线(箭头);C 图为纤维索条(箭头);D 图为牵拉性支气管扩张(箭头)。
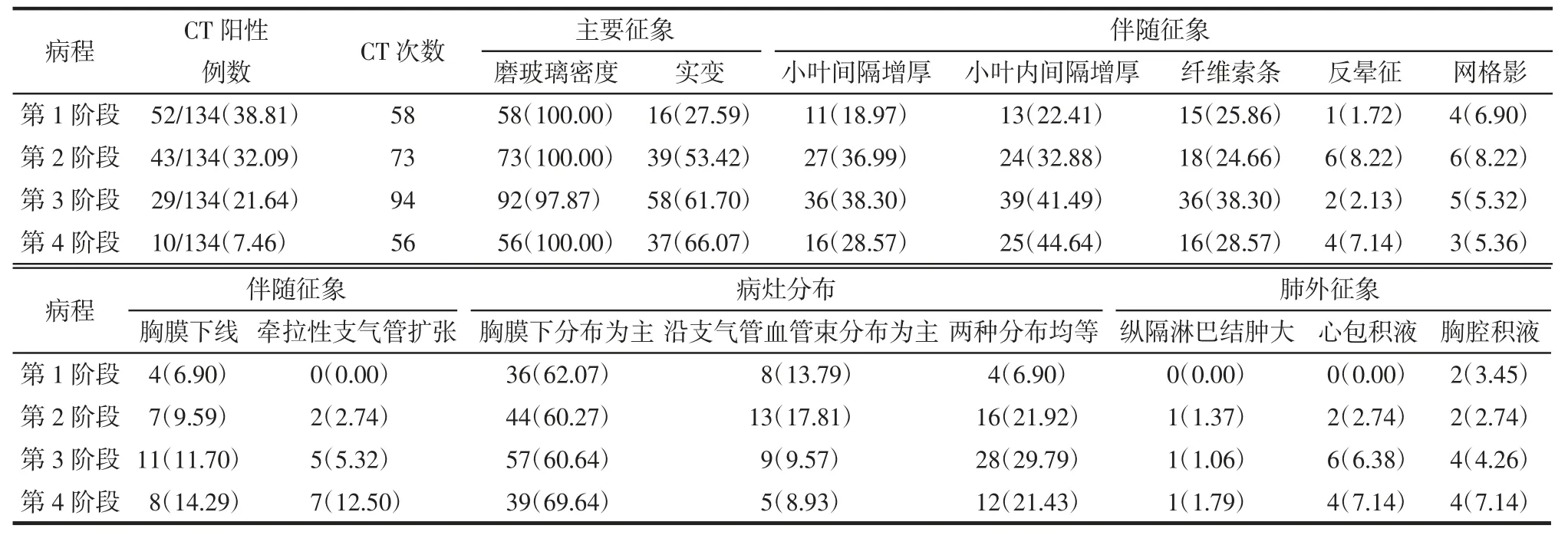
表3 Omicron 病人胸部CT 征象动态演变 例(%)
3 讨论
CT 作为快速诊断COVID-19 的影像检查方法,可以多层面显示肺部病变及疾病不同阶段的特征,是提示疾病进展或转化的重要工具,有利于为COVID-19 病人选择合理的治疗方案。
本研究中,Omicron 组较WT 组更年轻,这与Gu 等[3]的研究结果一致。在临床表现方面,WT 病人多表现为发热和咳嗽,与赵等[11]的研究结果相似;而Omicron 病人更多表现为咳嗽、咽痛、发热和鼻塞流涕,与Kirca 等[12]研究结果相符,提示Omicron 更易感染上呼吸道。
疫苗接种是预防广泛病毒感染、降低发病率和死亡率的关键策略[15]。本研究中,WT 组是COVID-19 疫情之初的病人,疫苗尚未研发,均未接种疫苗;而Omicron 病人发病是在疫苗接种广泛普及后,疫苗接种率为90.14%。Tian 等[16]研究显示,接种疫苗的病人在感染SARS-COV-2 后IgG 水平迅速升高,表明疫苗具有相对持久的保护作用,同时CD4+T淋巴细胞、CD8+T 淋巴细胞和B 淋巴细胞也比未接种的病人升高。这可能也是Omicron 致病性表现更温和的原因之一。由于疫苗在一定程度上可以激活机体免疫系统,帮助机体更快地对抗病毒,笔者推测疫苗的使用可能与CT 肺炎出现时间及达峰时间的延迟有关。
本研究中,WT 病人住院期间CT 阳性率为96.09%,而Omicron 组CT 阳性率仅为32.21%,且首次阳性CT 和高峰CT 的VSS 评分均低于WT 组病人。Shuai 等[13]发现,与WT 变异株相比,Omicron变异株的致病性降低,体内复制效率低,在感染细胞中诱导细胞损伤的水平相对较低。Trunfio 等[14]对体外和动物模型进行研究,结果表明Omicron 在下呼吸道的复制能力和毒力均较WT 减低。这可能是本研究中Omicron 组致病性及严重程度均低于WT组的原因之一。
不同病程的胸部CT 表现可能在一定程度上反映了胸部病变的病理机制。COVID-19 病人一般会经历弥漫性肺泡损伤的2 个时期,包括急性期和机化期[17]。急性期以细胞因子风暴引起肺间质和肺泡上皮细胞的剧烈炎症反应为主,对应的临床病程即为本研究中的前2 个阶段。第1 阶段(第1—5 天)的CT 表现以磨玻璃密度(100%)为主,部分病人出现肺实变(27.59%);第2 阶段(第6—9 天)的CT 表现仍以磨玻璃密度(100%)为主,但肺实变(53.42%)明显增多,同时小叶间隔增厚(36.99%)及小叶内间隔增厚(32.88%)也增多,这均提示肺间质水肿和肺泡渗出,因此急性期的治疗主要是抗病毒抗感染治疗及支持治疗[17]。第2 个时期即为机化期,这个时期会有损伤修复、纤维增生等组织机化现象,CT 常表现为纤维化征象增多。本研究中,Omicron 组半数以上的病人在第10 天后达到CT 肺炎高峰,随后进入机化期,对应本研究划分的后2 个阶段。第3 阶段(第10—14 天)小叶间隔增厚、小叶内间隔增厚、纤维索条、胸膜下线及牵拉性支气管扩张增多;第4阶段(第15 天后)小叶内间隔增厚、胸膜下线及牵拉性支气管扩张持续增多,与Zhou 等[18]和Gu 等[19]的结果相似。尽管纤维索条在第4 阶段减少,但仍较前2 个阶段增多,这可能是由于第4 阶段病灶吸收、减少所致。当临床发现机化期病情出现进行性加重,可酌情考虑使用抗纤维化药物[17]。本研究中病灶以胸膜下区分布为主的胸部CT 超过60%。这种分布可能是由于病毒更容易侵及细支气管和肺泡,引起需要免疫细胞参与的炎症反应,而免疫细胞聚集在血管和淋巴管内并在胸膜下区分布较丰富,故病灶多分布在肺的胸膜下区[18]。通过CT 影像能够区分急性期和机化期,有助于医生根据病程不同时期及时调整治疗方案。
综上所述,Omicron 肺炎病变发生率低、范围小,且高峰出现时间晚。临床上可以根据CT 机化征象(如小叶内间隔增厚、纤维索条、胸膜下线、牵拉性支气管扩张等)区分Omicron 病程急性期和机化期,从而调整相应治疗方案。
由于本研究所有病例均为中国人,且来自同一机构,样本可能存在偏倚;另外,本研究未根据严重程度及疫苗接种针次对病例进行分类,同时也未纳入嗅觉、味觉减退或丧失、肌痛、结膜炎的临床数据。因此,今后需进一步扩大样本量,纳入多中心多人种病人进行验证,还可以进一步比较不同分型病人的影像征象与时间的关系。

