外源激素对浙贝母愈伤组织诱导与不定芽分化的影响
刘荣淇,邓金文,苏柏朗,谢国勇,2,赵玉成,朱 艳*,秦民坚*
(1.中国药科大学 中药学院,江苏 南京 211198;2.中国药科大学 药用植物园,江苏 南京 211198)
浙贝母Fritillaria thunbergiiMiq.为百合科贝母属多年生草本植物,以干燥鳞茎入药,具有清热化痰止咳、解毒散结消痈的功效[1],是我国常用大宗中药材,被列为“浙八味”之一。传统人工种植浙贝母繁殖系数低,生产周期长,生产成本高[2],且由于种质资源不同,种植技术不规范,各地浙贝母的产量与质量参差不齐,严重影响和制约了浙贝母产业的可持续发展[3]。
离体培养是当前珍稀名贵植物品种种质保存和快速繁殖的有效途径之一,运用组织培养进行浙贝母快速繁殖或者快速生产次生代谢产物具有重要意义,目前利用浙贝母的鳞茎、茎段、叶片、花等[4-6]诱导出了小鳞茎 ,一定程度上提高了鳞茎产量, 缩短了生长周期,加速了浙贝母的生产速度和繁殖率[7],但鳞茎结构较特殊且长于地下,灭菌难度较高,限制了相关组织培养的广泛展开。同时各项组织培养工作缺少连贯性与系统性,浙贝母离体培养体系的建立尚不完善[8]。截至目前,对浙贝母愈伤组织诱导和芽分化的组织形态学观察未有相应研究,难以对浙贝母再生体系的建立与生产种植提供指导。本实验优化了浙贝母鳞茎的消毒方案,初步建立浙贝母离体培养体系,进一步探索其器官发生和形态建成途径,旨在为浙贝母高效再生体系的建立提供理论基础,促进浙贝母的可持续开发利用。
1 材料与仪器
实验材料采自中国药科大学药用植物园,经中国药科大学中药学院秦民坚教授鉴定,为百合科植物浙贝母Fritillaria thunbergiiMiq.的鳞茎。凭证标本存放于中国药科大学中药学院中药资源系。
NIKON ECLIPSE E200 型显微镜[尼康映像仪器销售(中国)有限公司];HISTOSTAT 820 型石蜡切片机(美国 Reichert 公司);BXM-30R 型立式压力蒸汽灭菌器(上海博迅医疗生物仪器股份有限公司);LRH-400-G Ⅱ型光照培养箱(广东省医疗器械厂)。
2 方法
2.1 鳞茎的消毒
选取春季生长健康的浙贝母鳞茎置于烧杯中,用水将其表面泥土清洗干净,用适量洗洁精溶液浸泡5 min,再在流水下冲洗30 min。置于超净工作台上,用75%酒精消毒30 s 后无菌水冲洗1 次,再用如下方案进行消毒,其中每次次氯酸钠消毒后均用无菌水冲洗4 次。
方案1:2%次氯酸钠溶液消毒16 min;方案2:2%次氯酸钠溶液消毒20 min;方案3:2%次氯酸钠溶液消毒8 min 两次;方案4:2%次氯酸钠溶液消毒10 min 两次;方案5:2%次氯酸钠溶液消毒8 min 后,用0.55%植菌清溶液消毒16 min;方案6:2%次氯酸钠溶液消毒8 min 后,用0.55%植菌清溶液消毒20 min;方案7:2%次氯酸钠溶液消毒10 min 后,用0.55%植菌清溶液消毒20 min;方案8:2%次氯酸钠溶液消毒12 min 后,用0.55%植菌清溶液消毒20 min。
完成后用无菌滤纸吸干表面水分,切除透明部分,切成小块接种于MS 固体培养基中,每种消毒方法接种30 块,15 d 后分别统计污染率。
2.2 愈伤组织的诱导
前期预实验发现KT、6-BA 以及NAA 对愈伤组织的生长影响较大,结合袁艺等[9]的研究,探究愈伤组织诱导所需最佳KT、6-BA 和NAA 的浓度配比。
将用最佳消毒方法消毒后的浙贝母鳞茎切成小块,接种于附加有不同浓度的 NAA、KT 组合及不同浓度NAA、6-BA 组合的 MS 固体培养基上(表1 培养基1 ~ 7),每种培养基接种40 块,(25±1)℃暗培养,45 d 后统计诱导率以及生长情况。
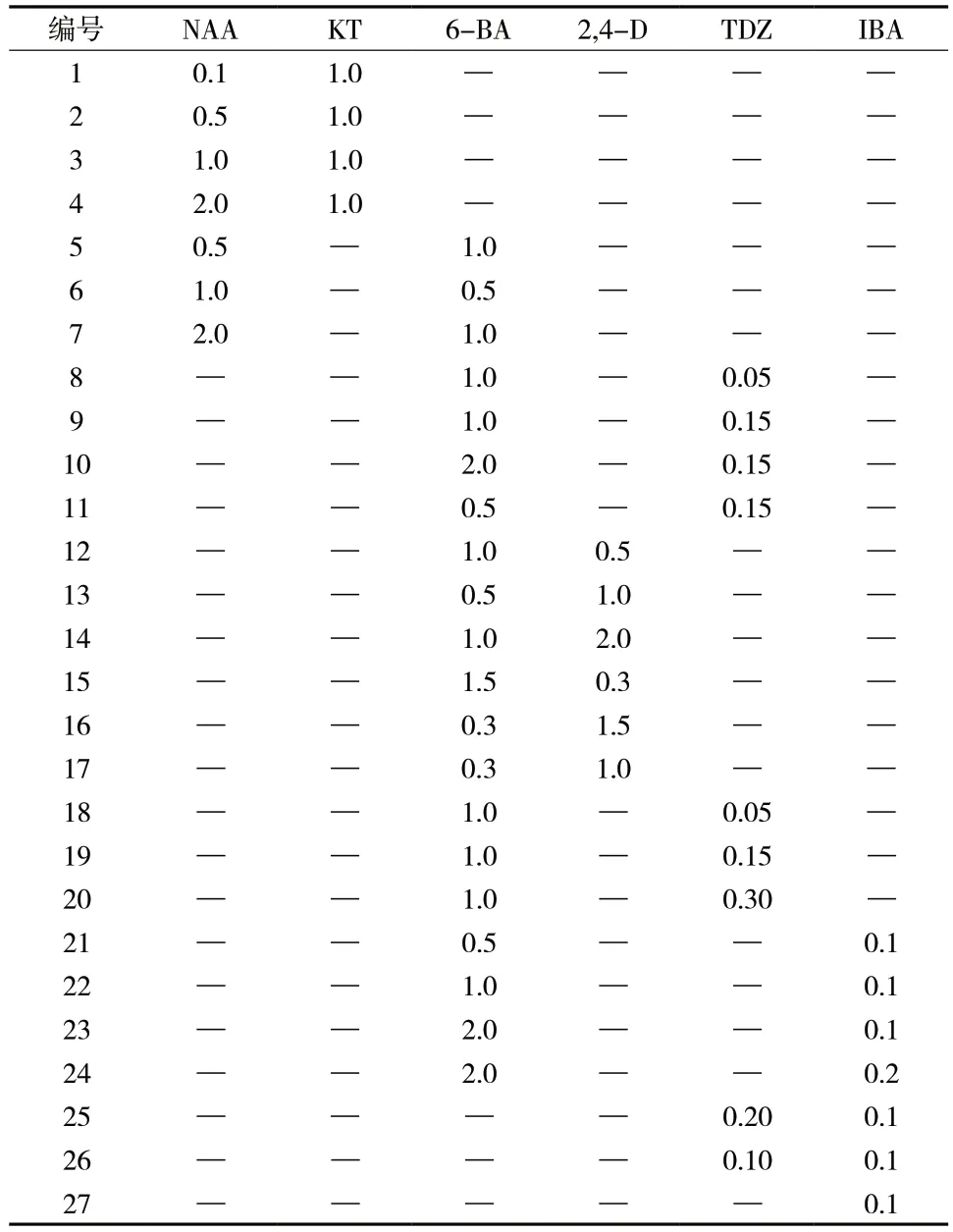
表1 不同MS 培养基激素组成(mg/L)Tab.1 Hormone composition of different MS media(mg/L)
2.3 愈伤组织的继代增殖
选取生长状况良好、质地紧密、颜色淡黄的愈伤组织,在超净工作台中切成合适大小后接于含有不同浓度的 6-BA 与TDZ 或 2,4-D 组合的MS 固体培养基上(表1培养基8 ~ 14),每种培养基接种30块,(25±1)℃暗培养,30 d 后观察其颜色质地及生长状态。
2.4 愈伤组织的再分化
前期预实验发现细胞分裂素 6-BA、TDZ 以及生长素 NAA 对小苗的生长有较大影响,因此主要通过调节6-BA 与 NAA 或TDZ 的比例来促进不定芽的发生,探究愈伤组织再分化所需最佳激素组合的浓度配比。
将长势较好的浙贝母愈伤组织在超净工作台中分成大小相近的部分接种于加有 6-BA、TDZ、NAA组合的 MS 固体培养基上(表1 培养基15 ~ 20),每种培养基接种30 块,培养条件(25±1)℃,光照1 500 lx,12 h/d,30 d 后统计发生率以及生长情况。
2.5 不定芽的继代增殖
前期预实验发现细胞分裂素 6-BA、TDZ 以及生长素 IBA 对小苗的生长影响较大。结合苏新[10]的研究结果,主要探究丛生苗生长及增殖所需最佳6-BA、TDZ 和IBA 的浓度配比。
选取生长较好的不定芽转入添加有 6-BA 或TDZ和 IBA 不同配比的培养基中(表1 培养基21 ~ 27),每种培养基接种30 株,培养条件同“2.4”,45 d 后统计不定芽的苗、叶的生长状况及长势。
2.6 数据统计与分析
使用SPSS 22.0 软件进行数据处理与统计分析。多组间比较采用方差分析,以P<0.05 为差异有统计学意义。涉及的测定指标计算公式如下:
2.7 组织形态学观察
对长势良好的愈伤组织及不定芽进行取样,将材料放入FAA 固定液中(福尔马林∶乙酸∶50%乙醇=1 ∶1 ∶18)固定24 h 后,按照石蜡切片制作流程制作石蜡切片,使用番红-固绿染色后在显微镜下观察并拍照。
3 结果与分析
3.1 不同消毒方法对鳞茎污染率的影响
接种15 d 后观察各方案材料污染具体情况,见表2。不同方案处理对材料污染率差异有统计学意义(P<0.05)。
表2 不同消毒方法对浙贝母鳞茎污染率的影响(±s,n = 30)Tab.2 Effects of different disinfection methods on bulb contamination rate of F. thunbergii(±s,n = 30)

表2 不同消毒方法对浙贝母鳞茎污染率的影响(±s,n = 30)Tab.2 Effects of different disinfection methods on bulb contamination rate of F. thunbergii(±s,n = 30)
注:同列小写字母完全不同,表示差异有统计学意义(P <0.05),表3、表5 同。
序号 消毒方案 污染率 / %1 2%次氯酸钠溶液16 min 53.3±7.2ae 2 2%次氯酸钠溶液20 min 36.7±2.7bcef 3 2%次氯酸钠溶液8 min + 2%次氯酸钠溶液8 min 35.6±4.2bcef 4 2%次氯酸钠溶液10 min + 2%次氯酸钠溶液10 min 20.0±4.7dgh 5 2%次氯酸钠溶液8 min + 0.55%植菌清溶液16 min 43.3±4.7abce 6 2%次氯酸钠溶液8 min + 0.55%植菌清溶液20 min 31.1±5.7bcf 7 2%次氯酸钠溶液10 min + 0.55%植菌清溶液20 min 18.9±3.1dgh 8 2%次氯酸钠溶液12 min + 0.55%植菌清溶液20 min 14.4±1.6dgh F 17.160 P 0.000
由表2 可知,将2%次氯酸钠溶液与0.55%植菌清溶液组合进行消毒处理,可使污染率保持在较低水平,并减少次氯酸钠对材料的损伤。但8 号消毒方案中消毒处理过后的材料状态明显不如7 号消毒方案。
综合材料消毒后状态与15 d 后污染率,认为7号消毒方案最适宜。
3.2 不同激素配比对愈伤组织诱导的影响
接种 45 d 后观察发现,部分材料有愈伤组织的生成,几乎无褐变现象,具体状况见图1A、表3。不同培养基处理对愈伤组织诱导率差异有统计学意义(P<0.05)。

图1 浙贝母愈伤组织诱导及不定芽生长状况Fig.1 Callus induction and adventitious bud condition of F. thunbergii
表3 不同培养基对浙贝母愈伤组织诱导的影响(±s,n = 40)Tab.3 Effects of different media on callus induction of F. thunbergii(±s,n = 40)

表3 不同培养基对浙贝母愈伤组织诱导的影响(±s,n = 40)Tab.3 Effects of different media on callus induction of F. thunbergii(±s,n = 40)
编号 愈伤组织平均数 / 个 愈伤组织诱导率 / %1 6.7 16.7±1.2abd 2 9.3 23.3±3.1ab 3 25.7 64.2±4.2c 4 5.0 12.5±5.4adg 5 1.3 3.3±3.1efg 6 0.3 0.8±1.2ef 7 3.7 9.2±2.4deg F 86.407 P 0.000
从结果可得,NAA 与KT 的各种组合相对其它组合对浙贝母的愈伤组织均有更好的诱导效果,其中3 号培养基愈伤组织诱导率最高。故认为,在KT 保持不变的情况下,在一定范围内愈伤组织诱导率随NAA 浓度增加而增加,且NAA 对愈伤组织的生长状况具有促进作用;当NAA 浓度达到2.0 mg/L 时,愈伤组织的诱导率迅速下降,表明在一定范围内低浓度NAA 有助于浙贝母鳞茎的愈伤组织诱导,而高浓度NAA 具有抑制作用。同时,各组合诱导出的愈伤组织质地较致密,颜色浅青黄色,表面具颗粒状突起,均为胚性愈伤组织。
因此初步认定3 号培养基是较为适宜的浙贝母鳞茎愈伤组织诱导培养基。
3.3 不同激素配比对愈伤组织继代培养的影响
接种 30 d 后观察发现,部分愈伤组织体积变大,也有部分出现褐变现象,具体状况见图1B、表4。

表4 不同培养基对浙贝母愈伤组织增殖的影响Tab.4 Effects of different media on callus proliferation of F. thunbergii
从结果可得,6-BA 与2,4-D 的组合对浙贝母愈伤组织增殖几乎无效果,愈伤组织在其中长势较差,而且整体表现为非胚性愈伤组织。6-BA、TDZ 的各组合培养基均能促进愈伤组织的增殖,并且大部分愈伤组织为胚性愈伤组织。在继代培养基中,9 号的长势较好,增长最明显。且在30 d 的培养后,各培养基中愈伤组织已经有部分芽生成。在TDZ 浓度不变的情况下,其长芽的数量随着6-BA 浓度下降而下降,而愈伤组织增长的差异不大。
综合愈伤组织的生长状态和芽分化情况,初步认定9 号培养基是较适宜的浙贝母鳞茎愈伤组织继代增殖培养基。
3.4 不同激素配比对愈伤组织再分化的影响
接种 30 d 后观察发现,部分材料有不定芽的生成,有部分有褐变现象,具体状况见图1C、表5。不同培养基处理对不定芽诱导效果差异有统计学意义(P<0.05)。
表5 不同培养基对浙贝母愈伤组织不定芽诱导的影响(±s,n = 30)Tab.5 Effects of different media on adventitious bud induction of callus of F. thunbergii(±s,n = 30)

表5 不同培养基对浙贝母愈伤组织不定芽诱导的影响(±s,n = 30)Tab.5 Effects of different media on adventitious bud induction of callus of F. thunbergii(±s,n = 30)
编号 不定芽平均数 / 个 不定芽诱导率 / %15 12.7 42.2±4.2adf 16 16.3 54.4±1.6bc 17 18.3 61.1±6.8bc 18 12.0 40.0±2.7adf 19 25.7 85.6±4.2e 20 13.3 43.3±5.4adf F 29.633 P 0.000
从结果可得,NAA 和TDZ 均促进愈伤组织不定芽发生。添加了NAA 的15 ~ 17 号培养基不定芽发生率相对较低,再分化产生的不定芽颜色白,叶片细弱,数量少;添加了TDZ 的18 ~ 20 号培养基不定芽发生率相对较高,再分化产生的不定芽颜色绿,叶片强壮,数量相对较多。比较18、19、20 号培养基,19 号培养基的不定芽发生率最高,且长势较旺盛。
因此初步认定19 号培养基是适宜的浙贝母愈伤组织再分化培养基。
3.5 不同激素配比及添加剂对不定芽继代培养的影响
接种 45 d 后观察发现,大部分接种的不定芽有较大的变化,几无褐变现象,具体状况见图1D、表6。
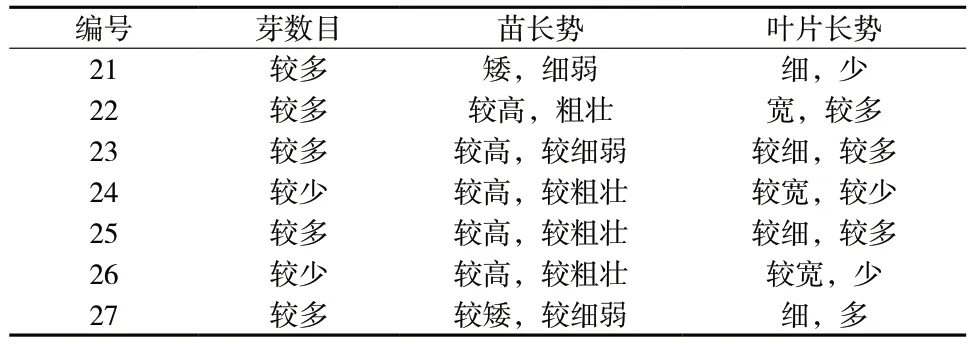
表6 不同培养基对浙贝母不定芽增殖的影响Tab.6 Effects of different media on adventitious bud proliferation of F. thunbergii
结果表明IBA 与TDZ 的组合以及IBA 单独使用时对不定芽的增殖生长效果不明显,增殖的芽较细弱,叶片均未展开,且偏黄绿色,长势及状态都较差。
IBA 与6-BA 的各种组合中不定芽的增殖生长状况均优于25 ~ 27 号培养基。22 号培养基结果最佳,其不定芽长势旺盛,芽的数量较多,排列紧密,苗较粗壮,叶片较宽且绿,状态较好。同时,6-BA ∶IBA =10 ∶1 时,在高浓度激素条件下,苗较粗壮而高,不定芽数量较少,且叶片部分未展开,长势较低浓度激素条件下的材料状态差。
因此初步认定22 号培养基为比较适宜的浙贝母不定芽继代增殖培养基。
3.6 浙贝母愈伤组织及不定芽的组织形态学观察
材料石蜡切片的结果见图2。可以观察到愈伤组织的大部分细胞呈现球形或近球形,细胞核大而明显,细胞质浓,细胞分裂旺盛,无液泡或液泡较小,属于胚性细胞。随着愈伤组织不断增殖,可以观察到多个分生细胞中心。围绕愈伤组织的边缘分化出多个芽原基,如图2B 中BP 所示;并不断分裂伸长,最终形成不定芽,如图2C 中AB 所示。

图2 浙贝母愈伤组织分化不定芽的组织形态学观察Fig.2 Histomorphological observation on adventitious bud differentiation of callus of F. thunbergii
4 讨论
浙贝母鳞茎取自土壤中,且表面有较多褶皱,极易因为消毒不彻底而污染。本实验尝试了多种消毒方案,较全面地探索了浙贝母鳞茎的消毒方法。为降低对环境的影响,未使用升汞,而使用了次氯酸钠及一种新型消毒剂——植菌清,后者对植物的伤害比较小,又有较好的消毒效果。实验结果表明,运用不同消毒剂组合对浙贝母鳞茎进行二次消毒效果更佳,该结果与张淑梅等[12]对伊贝母消毒方式的探究结果相似。推测可能因为二次消毒过程保持了消毒剂的浓度,同时植菌清含有表面活性剂成分,有较好的消毒效果。
贝母类外植体含有内源激素较少,培养过程中鳞叶细胞脱分化产生愈伤组织时无法提供足够的激素[13]。在诱导培养基中添加不同浓度NAA 与KT 的组合,其愈伤组织诱导率相对NAA 与6-BA 组合呈现出不同程度的增加,且为胚性愈伤组织。此结果与俞超等[4]对浙贝母愈伤组织的研究结果一致。说明生长素浓度过高对愈伤组织诱导不利,而KT 可能在改善愈伤组织质量方面发挥作用。在后续培养中,部分培养基中仍有愈伤组织产生,3 号培养基诱导效果最好,最终愈伤组织诱导率可达到90.0%。后续实验可在此基础上继续优化,减少诱导所需时间,完善愈伤组织诱导体系。
在愈伤组织继代增殖过程中,较高2,4-D 激素浓度的13、14 号培养基中的愈伤组织生长状况较差,难以存活;而较高6-BA 激素浓度的8 ~ 10 号培养基中的愈伤组织生长状况较好,长势较佳,结果与王立强等[14]报道相似。认为愈伤组织继代时高浓度生长素使组织松散极易褐化,继代后难以存活,甚至呈烂泥状;高浓度细胞分裂素使愈伤组织结构致密,继代时不易褐化死亡。
TDZ 对某些单子叶植物如荸荠[15]等的不定芽发生有较好的效果。浙贝母的愈伤组织再分化的实验结果表明,6-BA 浓度一定时,TDZ 比NAA 更有利于诱导不定芽。推测认为之前的培养基中生长素类植物激素含量相对较高,让愈伤组织内部同样有较高的生长素类植物激素积累,因此单纯添加细胞分裂素类激素到一定比例即能较好地促进其不定芽的发生。与刘亚菊等[16]在平贝母组织培养中TDZ 的促进其脱分化与分化的作用结果一致。
本实验认为不定芽的苗高且健壮,叶片宽大,颜色绿色或深绿色,长势旺盛为最佳生长状态。IBA 与6-BA 的各种组合效果比单独使用某一种激素更好,表明正确的激素组合比单一激素能更好地促进组织培养产物的增殖生长。这与苏新等[6]对浙贝母组织培养所需激素种类的研究结果一致,且和苏新[17]在浙贝母种胚的组织培养中不定芽诱导和生长的研究结果类似。说明在不定芽生长过程中,较低的生长素浓度与较高的细胞分裂素水平对其有利,促进芽细胞分裂的6-BA 相对TDZ 更有利于不定芽的增殖。
本实验证实了浙贝母组织培养器官发生的间接途径,即通过诱导浙贝母鳞茎脱分化形成愈伤组织,再由愈伤组织分化形成不定芽。表明浙贝母鳞茎在春天苗期,细胞分裂活动旺盛时期能够较好地诱导胚性愈伤组织,这一结果与苏新等[6]关于浙贝母组织培养影响因素的结果一致。
5 结论
本实验确定了浙贝母愈伤组织诱导、增殖及分化的培养条件,建立了浙贝母愈伤组织及不定芽的诱导增殖体系,为浙贝母的生物学特性研究、快繁体系建立奠定一定的基础。关于快繁体系的遗传稳定性以及浙贝母组织形态发生方式的调控有待进一步研究。

