化疗药物心脏毒性风险的预测模型构建及效能评价
高倩男,高 雪,李 冉
近年来,化疗是抗肿瘤治疗的基础,但化疗所致心脏毒性难以避免[1]。临床研究显示,化疗药物介导的心脏毒性一旦发病,缺乏有效的治疗手段,可危及病人生命,增加死亡风险[2]。评估化疗药物心脏毒性的潜在危险因素,尽早筛选高危病人,密切监测病人心功能,针对性地给予预防措施,使得肿瘤病人获得更多收益。目前,临床对早期心脏毒性尚无有效的监测方法,筛选化疗药物心脏毒性的危险因素、识别高危病人,成为近期肿瘤学科和心血管学科交叉领域的研究热点。乳腺癌是目前严重危害女性健康的恶性肿瘤,化疗是乳腺癌的主要疗法之一,有研究显示,化疗药物介导的心脏毒性是乳腺癌病人死亡的重要因素[3]。本研究选取乳腺癌病人作为研究对象,筛选化疗药物心脏毒性的危险因素,以期为化疗药物心脏毒性临床的早期发现、早期诊断提供依据。
1 资料与方法
1.1 研究对象 选取2019年1月—2020年1月我院肿瘤内科收治的173例乳腺癌病人为研究对象。纳入标准:经穿刺活检诊断为乳腺癌;女性;无远处转移;预计生存期>3年;病人知情同意参与本研究。排除标准:存在其他恶性肿瘤;精神疾病或认知功能障碍。
1.2 化疗方案 TC方案:环磷酰胺药物(环磷酰胺>75 mg/m2)联合紫杉醇类药物(多西他赛>75 mg/m2或紫杉醇2 175 mg/m2);AT方案:紫杉醇类药物(多西他赛>75 mg/m2或紫杉醇>1 mg/m2)联合中蒽环类药物(吡柔比星≥50 mg/m2或表柔比星≥75 mg/m2);AC方案:中蒽环类药物(吡柔比星≥50 mg/m2或表柔比星>75 mg/m2)和环磷酰胺(环磷酰胺>75 mg/m2),每个周期21 d,共4~6个周期。曲妥珠单抗靶向治疗序贯方案:8 mg/kg曲妥珠单抗首次负荷剂量后,每3周维持量6mg/kg,曲妥珠单抗治疗18次(疗程均为1年)。
1.3 心脏毒性诊断标准 美国心功能评估委员会制定的化疗药物相关心脏毒性标准[4]:左室射血分数(LVEF)降低≥10%(且绝对值≤55%),伴发无症状的LVEF降低≥15%(且绝对值≤50%)或相关心力衰竭症状。
1.4 资料收集 通过医院电子病例系统收集相关资料,包括年龄、婚姻状况、生育史、体质指数(BMI)、高血压史、糖尿病史、冠心病史、肿瘤位置、临床分期、辅助化疗方案、曲妥珠单抗靶向治疗、放疗史、基线LVEF、基线心率、心电图异常(以T波改变、ST段改变、QRS波改变及心律失常为标准)、非特异性ST段改变、心电图异常次数(抗肿瘤治疗期间,每周期至少1次心电图检查)。反复核查资料内容,采用双人录入EpiData 3.1软件确定数据库,数据录入后逻辑查错,剔除重复、错误、纰漏数据,确保数据的完整性和准确性。
2 结 果
2.1 化疗药物心脏毒性发生情况 随访至2021年1月,共168例乳腺癌病人完成随访,平均随访时间为13.2个月,最长随访时间为16个月。168例病人中,其中35例出现符合化疗药物心脏毒性事件,占20.83%(35/168)。35例病人中,LVEF降低(19.48±3.10)%,其中出现明显胸闷症状病人3例,占8.57%(3/35),其余均无明显胸闷不适感,主要表现为无症状的LVEF降低,且所有病人均未终止或暂停抗肿瘤药物治疗。
2.2 影响化疗药物心脏毒性的单因素分析 将168例乳腺癌病人根据是否发生心脏毒性分为毒性组(35例)和无毒性组(133例)。两组糖尿病史、冠心病史、辅助化疗方案、心电图异常、非特异性ST段改变、心电图异常次数、放疗史、曲妥珠单抗靶向治疗比较,差异有统计学意义(P<0.05)。详见表1。
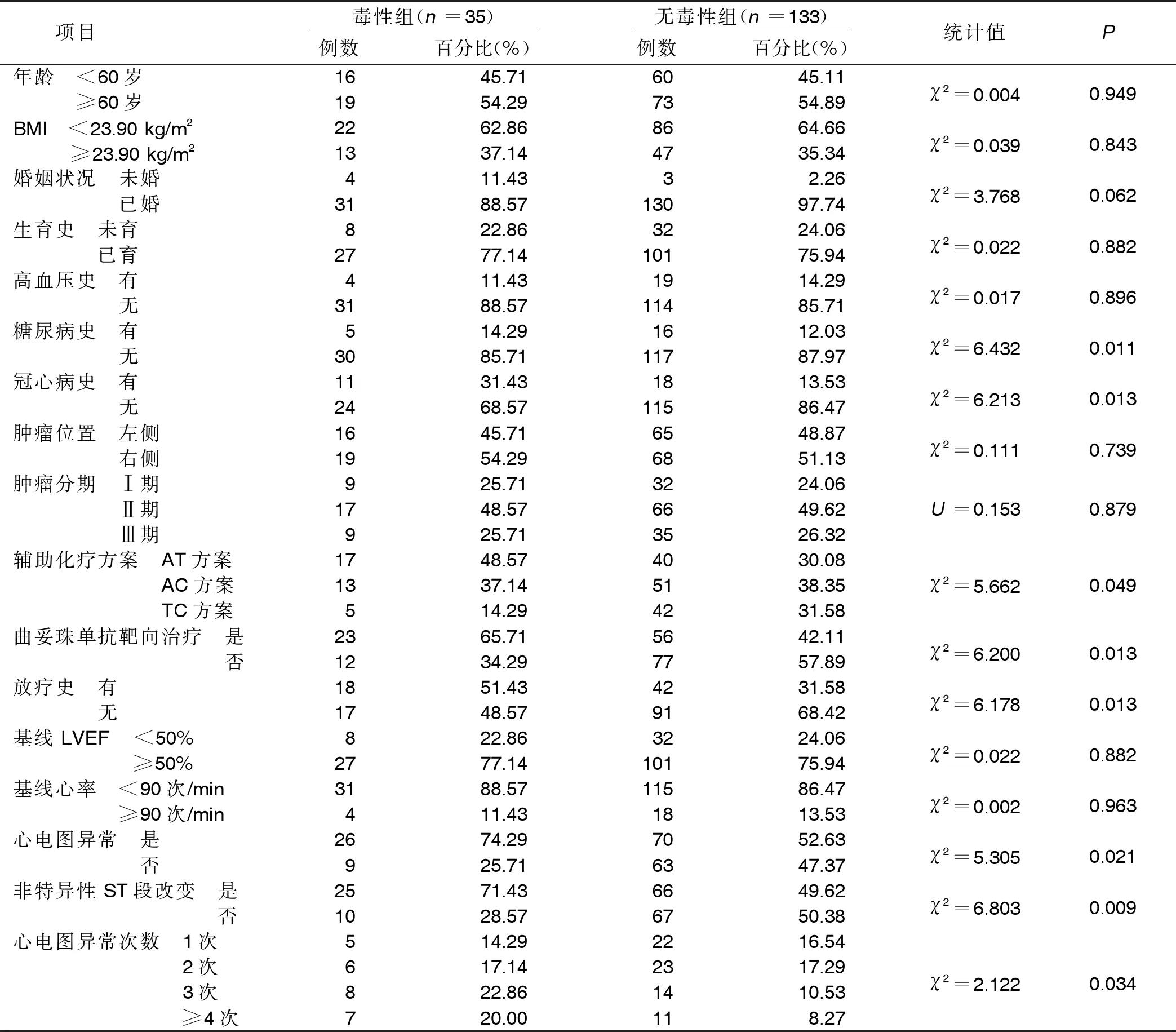
表1 影响化疗药物心脏毒性的单因素分析
2.3 影响化疗药物心脏毒性的多因素Logistic回归分析 将乳腺癌病人是否发生化疗药物心脏毒性作为因变量(否=0,是=1),将单因素分析中差异有统计学意义的因素作为自变量(赋值见表2),构建Logistic回归模型。结果显示,冠心病史、心电图异常、心电图异常次数、放疗史及曲妥珠单抗靶向治疗是化疗药物心脏毒性发生的危险因素(P<0.05)。详见表3。

表2 变量赋值

表3 化疗药物心脏毒性的多因素Logistic回归分析
2.4 基于Logistic回归模型评价构建预测模型并评价其化疗药物心脏毒性的预测效能 评价Logistic回归方程模型,似然比χ2=121.547,P<0.05,提示模型构建存在有统计学意义。Waldχ2=129.361,DF=7,P<0.05,表明方程系数存在显著差异。Hosmer-Lemeshow拟合优度检验显示模型拟合效果良好,χ2=8.611,P>0.05。使用Stata 10.0软件Predict pre1命令,将原始自变量冠心病史、心电图异常、心电图异常次数、放疗史及曲妥珠单抗靶向治疗经Logistic回归模型拟合生成联合预测因子,运用roctab sepsis pre1,d命令,列出联合预测因子取不同值时对应的灵敏度、敏感度,取约登指数为最大值时联合预测因子所对应的数值作为最佳临界值,即0.192,ROC曲线下面积(AUC)为0.916,预测模型灵敏度为88.57%,特异度为79.70%。详见图1。
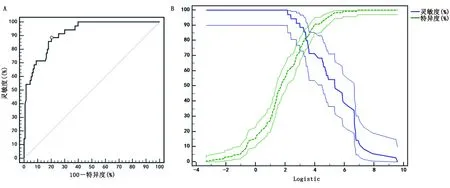
图1 Logistic回归模型对化疗药物心脏毒性事件的预测效能(A为ROC曲线图;B为回归分析的临床效能)
3 讨 论
化疗药物心脏毒性具有不可逆性和进展性,潜伏期较长,通常从第1次化疗至症状表现至少需1年时间,增加治疗难度,影响预后效果[5]。本研究结果显示,168例乳腺癌病人,化疗药物心脏毒性发生率为20.83%,与郑丽等[6]报道相近,表明乳腺癌化疗存在心脏毒性风险,临床对此需加以关注。
临床实际工作中,乳腺癌病人化疗是一种综合性的治疗,联合应用辅助放疗、药物等多种对心脏具有不良影响的治疗手段均可致使心脏毒性的发生更复杂[7]。查找分析引起化疗药物心脏毒性的影响因素,筛选识别高危病人,做好早预测、早诊断对减轻化疗对癌症病人的不良影响至关重要。本研究通过多因素Logistic回归分析发现,放疗是乳腺癌化疗病人的独立危险因素,且有放疗史的乳腺癌化疗病人发生心脏毒性的风险是无放疗史病人的2.646倍。另有研究显示,放疗联合曲妥珠单抗可增加心脏毒性风险[8]。目前,曲妥珠单抗靶向治疗联合乳腺癌放疗的最大临床试验来源于N9831试验,但试验结果显示二者的联合未增加乳腺癌病人发生心脏毒性的风险[9]。动物实验表明,放疗和曲妥珠单抗之间具有一定的协同作用[10]。
放疗介导的心脏毒性损伤从开始至出现临床症状中位潜伏时间为3.2年[11]。目前,临床研究随访时间在5年内,故对二者联合的心脏安全性问题不足以得到准确结论。常规化疗序贯曲妥珠单抗、放疗联合引发的心脏毒性损伤事件可能复杂多变,有待于进一步随访观察。本研究结果显示,曲妥珠单抗靶向治疗是乳腺癌病人化疗药物心脏毒性的危险因素之一,临床应用中需综合考虑,选择最优治疗方案。以往研究显示,曲妥珠单抗与蒽环类药物联合应用可显著增加心脏毒性风险[12]。临床治疗中,为了减少或避免化疗心脏毒性发生,对采用曲妥珠单抗治疗病人,临床医师可避免其与蒽环类药物联合应用,多数以紫杉醇类药物替代治疗。多项报道证实,蒽环类药物与曲妥珠单抗合用可显著增强疗效,避免蒽环类药物使用削弱其治疗效果[13-14]。蒽环类药物造成的心脏毒性事件已被临床认识,且心脏毒性损害程度与蒽环类药物使用剂量有相关性。因此,临床治疗中,小剂量应用蒽环类药物对化疗病人的心脏是一种安全有效的选择。目前对曲妥珠单抗靶向治疗与蒽环类药物联合治疗缺乏大规模的临床观察,二者的联合使得心脏毒性机制更复杂,具体作用机制有待进一步研究证实。
本研究结果显示,心电图异常及心电图异常次数是乳腺癌病人化疗心脏毒性的影响因素,且随心电异常次数增加,病人心脏毒性发生率明显提高。一项横断面研究显示,化疗过程中,病人心电图异常比例明显增加,且化疗开始后4周(即化疗早期)可出现[15]。在心功能评估方面尤其是亚临床心脏功能改变方面,心电图具有其他心血管检查无法替代的重要作用。20世纪70年代,有研究显示,化疗期间肿瘤病人心电图异常变化与化疗介导的心脏毒性事件存在明显的相关性[16-17]。因此,在临床化疗过程中,应加强对病人的心电图监测,及时发现心电图异常,尽早做出科学、合理的应对措施。本研究结果显示,31.43%的发生心脏毒性病人合并冠心病,明显高于未发生心脏毒性病人(合并冠心病病人占13.53%),且冠心病是化疗药物心脏毒性的危险因素,原因可能在于化疗药物使得较为脆弱或已遭受损伤的心肌细胞承受更大的损伤负荷,对心脏自身修复机制造成直接影响,最终造成不可逆心功能损伤[18]。在此基础上,为进一步证实构建的预测模型对化疗药物心脏毒性的预测价值,本研究运用Stata 10.0软件中的Predict pre1命令对预测价值进行验证,结果显示,预测模型对化疗药物心脏毒性的灵敏度为88.57%,特异度为79.70%。可见,该模型对化疗介导的心脏毒性具有良好的预测价值,可筛选鉴别高危因素,及时发现高危病人,尽早采取针对性干预措施并及时调整化疗方案,降低心脏毒性风险,减轻对预后的不良影响。
综上所述,乳腺癌化疗病人存在心脏毒性风险,冠心病史、心电图异常、心电图异常次数、放疗史及曲妥珠单抗靶向治疗是其发生的影响因素,临床对存在上述因素的病人需综合考虑制定安全、有效、合理的化疗方案,并积极采取针对性干预措施,以降低心脏毒性风险,减轻其损伤程度。心电图异常和心电图异常次数是心脏毒性的危险因素,且随着心电图异常次数增加,化疗心脏毒性发生率逐渐升高,考虑心电图可作为心脏毒性的独立预测因子,但其可靠性仍需进一步深入探讨。本研究纳入的研究对象仅有乳腺癌1种肿瘤类型,今后工作中可扩大研究范围,全面分析其他类型肿瘤病人化疗介导的心脏毒性发生情况及其影响因素,使广大肿瘤病人受益。

