大蒜病毒多重RT-PCR检测体系的建立与应用
赵永强,樊继德,陆信娟,刘灿玉,张碧薇,杨青青,葛 洁,史新敏,杨 峰
(江苏徐淮地区徐州农业科学研究所,江苏徐州 221121)
大蒜(Allium sativum L.)是世界上第二重要的葱属植物,作为重要的调味类蔬菜和药用植物,种植范围广泛分布于亚热带至温带地区[1]。据联合国粮食及农业组织(FAOSTAT)统计数据显示,我国是世界上最重要的大蒜产销国,2021年大蒜收获面积831 832 hm2、产量 20 513 385.83 t,分别占世界总收获面积和总产量的50.13%和72.73%。
大蒜是典型的无性繁殖作物,病毒侵染后可以在其体内世代积累,造成严重的产量损失和品质下降[2]。我国大蒜普遍受到病毒侵染,且多为复合侵染。侵染我国大蒜的病毒主要包括香石竹潜隐病毒属(Carlavirus)的青葱潜隐病毒(Shallot latent virus,ShLV)和大蒜普通潜隐病毒(Garlic common latent virus,GarCLV);马铃薯 Y 病毒属(Potyvirus)的韭葱黄条病毒(Leek yellow stripe virus,LYSV)和洋葱黄矮病毒(Onion yellow dwarf virus,OYDV);青葱 X 病毒属(Allexivirus)的大蒜A病毒(Garlic virus A,GarV-A)、大蒜 B 病毒(Garlic virus B,GarV-B)、大蒜C 病毒(Garlic virus C,GarV-C)、大蒜 D 病毒(Garlic virus D,GarV-D)、大蒜 E 病毒(Garlic virus E,GarV-E)和大蒜X病毒(Garlic virus X,GarV-X)等[3-6]。
应用无病毒种植材料是解决大蒜病毒病的最有效途径。无病毒大蒜种植材料可以通过体外组织培养技术实现,包括微繁殖、分生组织培养、热疗、化学疗法、冷冻疗法和体细胞胚胎发生等[7]。由于体外组织培养技术尚未达到100%的脱毒率,因此准确、快速、高效的大蒜病毒检测技术是完善大蒜脱毒良繁体系的迫切需求。在已开发的众多大蒜病毒检测方法中,多重RT-PCR方法由于同时具备准确、灵敏、高效和低成本优势而被普遍接受。MAJUMDER等[8]于2014年开发了一种多重RT-PCR方法,用于同时检测和鉴定感染印度大蒜的 OYDV、ShLV、GarCLV和葱属X病毒属病毒。HU等[9]2015年也开发了一种多重RT-PCR检测体系,可以同时检测在我国湖南省鉴定的4种大蒜病毒/病毒组(OYDV、LYSV、ShLV和allexiviruses)。然而,在对大蒜组培苗和大田植株进行病毒检测时,ShLV、GarCLV、LYSV、OYDV和allexiviruses的单独或混合感染时有检出,虽然NAM等[10]2015年通过两组独立的多重RT-PCR配合,实现了对上述5种病毒/病毒组的有效检测和鉴别,但仍然不能满足大蒜病毒高效、快速检测的技术需求。因此,本研究针对以上5种病毒/病毒组开发多重RT-PCR检测体系,用以快速、简洁地鉴别这5种病毒/病毒组。
1 材料和方法
1.1 病毒与大蒜组培苗、大田样品来源
在前期病毒检测中,“徐蒜6号”大蒜组培苗样品 XS6-2检测到 GarCLV、OYDV和 allexiviruses,XS6-28检测到ShLV、LYSV和OYDV(结果未提供)。将样品XS6-2和XS6-28的cDNA等比混合为同时含有 ShLV、GarCLV、LYSV、OYDV 和 allexiviruses的cDNA混合液,用于本研究多重RT-PCR体系的建立和优化。
根据日常病毒检测经验,由保留两个叶原基的茎尖培养获得的大蒜组培苗脱毒效果较差,体内残留的病毒多样性丰富。为了验证建立的多重RT-PCR方法,以大田常规种植的大蒜品种“徐蒜6号”鳞茎为外植体,定制了一批由保留两个叶原基的茎尖培养获得的大蒜组培苗。挑选高度大于10 cm的组培苗24株,采集假茎基部1.5~2.0 cm以上全部组织,保存于-80℃,用于后续总RNA提取。
大田样品取自田间大蒜植株第3~4片完全展开的叶片,具体信息见表1。

表1 大田大蒜样品Table 1 Garlic field samples
1.2 总RNA的提取与cDNA合成
大蒜组培苗样品和大田样品液氮冷冻研磨,利用柱式植物总RNA抽提纯化试剂盒(生工生物工程有限公司,上海)提取总RNA,以随机引物Random Primers为反向引物、M-MuLV第 1链cDNA合成试剂盒合成cDNA(生工生物工程有限公司,上海),-20℃保存备用。
1.3 引物的设计与合成
在考虑引物特异性、Tm相容性以及扩增子长度等因素的基础上,ShLV和OYDV的检测选用HU等[9]开发的引物,allexiviruses(包括 GarV-A、GarV-B、GarV-C、GarV-D、GarV-E和GarV-X)简并引物参考DOVAS等[11]。另外,从GenBank数据库中检索到GarCLV(NC_016440.1)和 LYSV(NC_005029.1)外壳蛋白(CP)基因序列,使用Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast)筛选了两对特异性引物用于检测GarCLV和LYSV。引物主要信息见表2,交由生工生物(上海)有限公司合成。

表2 大蒜病毒检测引物Table 2 Primers used in detection of garlic viruses
1.4 单重PCR与多重PCR扩增
以cDNA混合液为PCR反应模板,5对特异性引物分别进行单重和多重PCR扩增。PCR反应体系为:PCR Mix(2×SanTaq Plus PCR Mix 预混液,生工生物,上海)25 μL、cDNA 混合液模板 2 μL、10 μmol/L的正反向引物各2 μL、灭菌ddH2O 补足至50 μL。反应程序:94℃预变性3 min,94℃变性30 s,56 ℃退火 30 s,72 ℃延伸 45 s,循环 30次,最后72℃继续延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析。
1.5 多重PCR扩增产物的克隆及测序
多重PCR扩增产物电泳条带分别用DNA凝胶回收试剂盒(MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0,TaKaRa,大连)回收纯化,回收产物连接pMD18-Tvector并转化DH5α感受态细胞,挑选单菌落扩繁,提取质粒进行PCR鉴定,然后将获得的阳性克隆菌液送交生工生物(上海)有限公司进行测序。测序结果在NCBI上用BLAST工具进行比对分析。
1.6 多重PCR检测体系的优化
用NanoDrop 2000超微量紫外/可见分光光度计测定 ShLV、GarCLV、LYSV、OYDV 和 allexiviruses阳性克隆质粒初始浓度,根据王莹等[12]的计算公式,计算得出各病毒质粒拷贝数。将5种质粒按比例稀释并混合为浓度均为1.0×108copies/μL的质粒混合液。用上述质粒混合液为模板,分别对多重PCR体系的退火温度和引物比例进行优化。
1.7 单重和多重PCR检测体系灵敏度测定
上述质粒混合液通过10倍稀释,依次稀释至1.0 ×105、1.0 ×104、1.0 ×103、1.0 ×102、1.0 ×101和1.0×100copies/μL,以 ddH2O 为阴性对照,分别应用单重和多重PCR体系检测,比较两种检测方法的灵敏度。
1.8 多重RT-PCR体系应用分析
对24份定制的大蒜组培苗样品和48份大田样品进行多重RT-PCR检测分析,并利用5对特异性引物分别对编号25~48的大田样品进行单重RT-PCR检测,以验证建立的多重RT-PCR检测方法的适应性。
2 结果与分析
2.1 引物特异性与相容性
以cDNA混合液为模板的单重与多重PCR扩增结果(图1)表明,5对引物单重PCR均可以扩增出一条单一的、清晰的目的条带,大小与预期基本一致;多重PCR体系可以扩增获得5条特异性的目的条带,且条带分布合理,容易区分。
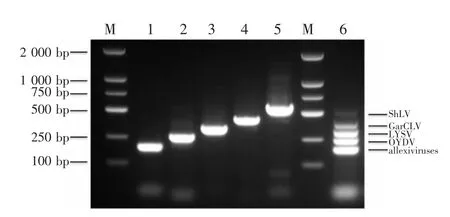
图1 大蒜病毒单重PCR与多重PCR检测Figure 1 Single PCR and multiplex PCR detection of garlic viruses
分别对多重PCR扩增获得的5条特异性条带进行克隆及测序。序列测定结果证明,从上到下5条特异性条带的大小分别为 592、431、338、265、190 bp,与预期完全一致;5条序列分别与GenBank中公布的ShLV澳大利亚分离物HQ258896.2的相似性达100%、GarCLV中国分离物MN059119.1的相似性达98%、LYSV中国分离物MN059516.1的相似性达100%、OYDV中国分离物MN059609.1的相似性达100%、allexiviruses(包括GarV-A中国分离物MN059321.1、GarV-D中国分离物MN059341.1、GarV-E中国分离物AJ292230.1、GarV-X中国分离物MN059398.1)的相似性达98%。这说明多重PCR扩增出的5条特异性片段来自这5种大蒜病毒/病毒组基因。
2.2 多重PCR体系的优化
分光光度法测得 ShLV、GarCLV、LYSV、OYDV和 allexiviruses质粒初始浓度分别为 59.1、53.5、56.3、57.2和88.2 ng/μL,计算得出对应质粒浓度分别为1.64 ×1010、1.56 ×1010、1.69 ×1010、1.76 ×1010和2.80×1010copies/μL。
以稀释、混合后浓度均为1.0×108copies/μL的5种病毒质粒混合液为模板,对多重PCR体系的退火温度进行优化。在引物体积比 1∶1∶1∶1∶1 的情况下,设置参试退火温度 54.0、54.2、54.5、55.1、55.9、56.6、57.4、58.1、58.9、59.5、59.8、60.0 ℃。结果表明(图2),在设定的参试温度范围内,ShLV、LYSV和OYDV扩增效果受退火温度影响较小,而GarCLV和allexiviruses变化较大,其中,GarCLV的最佳退火温度为56.6、57.4、58.1、58.9、59.5、59.8、60.0 ℃,而allexiviruses 在 54.0、54.2、54.5、55.1、55.9、56.6 ℃可以获得更明亮的条带。因此,确定本研究建立的多重PCR体系的最佳退火温度为56.6℃(图2泳道 6)。
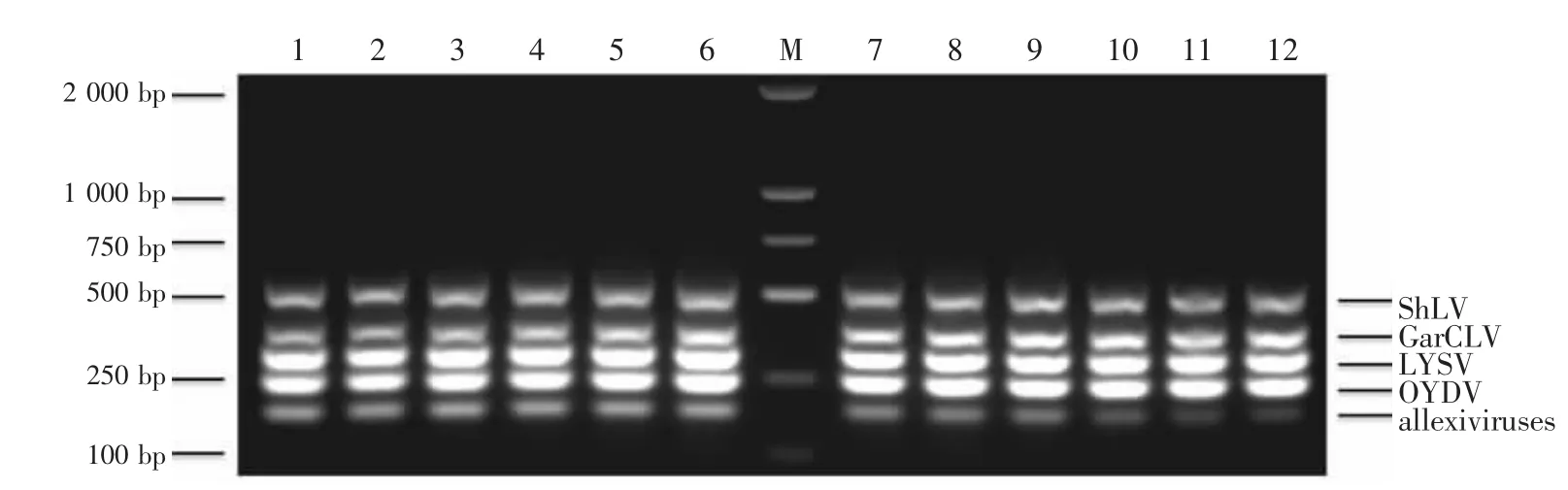
图2 退火温度对多重PCR扩增的影响Figure 2 The effect of annealing temperature on multiplex PCR anplification
另外,通过条带明亮程度可以明显看出,本研究设计的5组特异性引物会相互影响,特别是ShLV和allexiviruses的扩增效率受到显著影响,因此进一步对多重PCR体系的引物比例进行了优化。设置ShLV、GarCLV、LYSV、OYDV 和 allexiviruses引物体积比分别为 1∶1∶1∶1∶1、12∶8∶3∶3∶14、6∶4∶1∶1∶8、5∶4∶2∶2∶7、5∶3∶2∶2∶8、4∶3∶2∶2∶9、10∶8∶3∶3∶16 和 5∶3∶1∶1∶10,即 50 μL反应体系中各正反向引物用量分别为2/2/2/2/2、3/2/0.75/0.75/3.5、3/2/0.5/0.5/4、2.5/2/1/1/3.5、2.5/1.5/1/1/4、2/1.5/1/1/4.5、2.5/2/0.75/0.75/4 和2.5/1.5/0.5/0.5/5 μL。凝胶成像结果表明(图3),引物体积比 10∶8∶3∶3∶16(图3泳道7)PCR扩增获得的5条特异性条带亮度最为均匀,可以有效抵消引物间的相互影响。
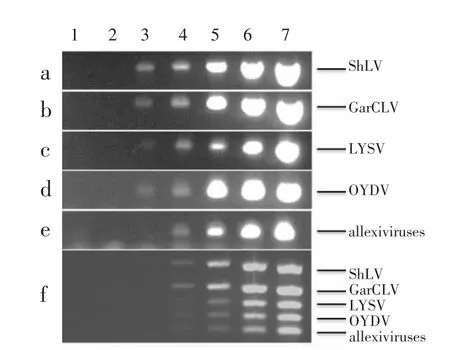
图3 多重PCR检测体系引物比例筛选Figure 3 Primer ratio test in multiplex PCR
因此,确定50 μL的最佳反应体系为:2×PCR Mix 25 μL、cDNA 混合液模板 2 μL、引物混合液(ShLV、GarCLV、LYSV、OYDV 和 allexiviruses引物体积比10∶8∶3∶3∶16)20 μL、无菌 ddH2O 补足 50 μL。反应程序:94℃预变性3 min;94℃变性30 s,56.6℃退火30 s,72℃延伸45 s,循环30次;72℃继续延伸10 min。
2.3 检测灵敏度分析
灵敏度测定结果表明,单重PCR检测ShLV(图4a)、GarCLV(图4b)、LYSV(图4c)和 OYDV(图4d)的最低检测浓度均为1.0 ×101copies/μL,而allexiviruses(图4e)为 1.0×102copies/μL。多重 PCR检测灵敏度测定结果(图4 f)表明,在最佳体系和反应条件下,5种病毒/病毒组的最低检测浓度均为1.0×102copies/μL。因此,多重PCR检测灵敏度相较于单重PCR有一定程度的降低。
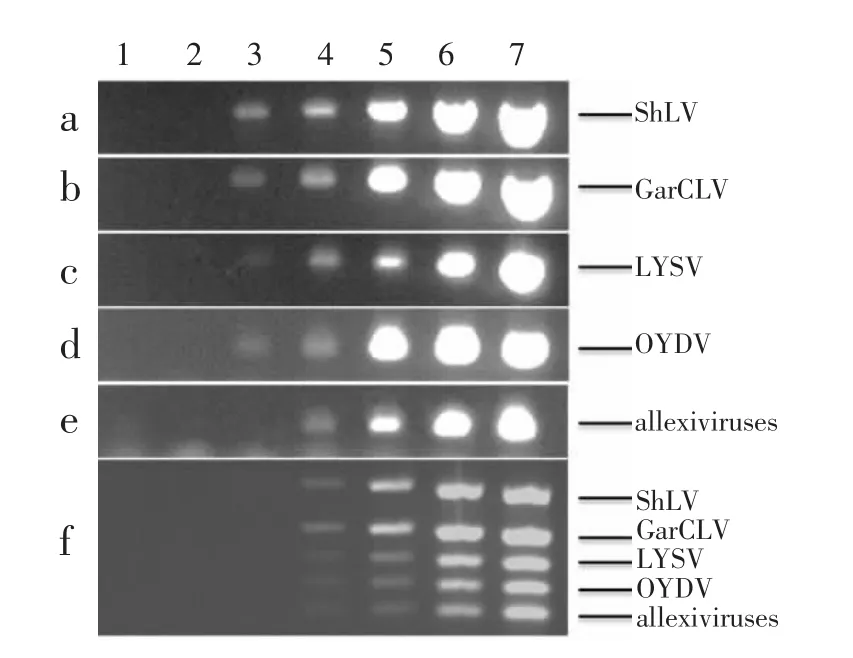
图4 单重PCR与多重PCR检测灵敏度Figure 4 Sensitivity of single PCR and multiplex PCR
2.4 多重RT-PCR体系应用效果
用建立的多重RT-PCR体系检测定制的24份大蒜组培苗样品。结果表明(图5),2份样品完全脱除大蒜病毒(样品6和20),10份样品病毒载量明显降低(样品 1、3、7、10、11、13、16、19、21 和 24)。未完全脱除病毒的组培苗样品中,1份样品检测到1种病毒残留(样品4检测到GarCLV)、4份样品检测到2种病毒/病毒组残留(样品1检测到GarCLV和allexiviruses;样品 10和 21检测到 GarCLV和LYSV;样品17检测到ShLV和LYSV)、10份样品检测到3种病毒/病毒组残留(样品5和24检测到GarCLV、LYSV 和 allexiviruses;样品 7、8、9、12、18和23检测到ShLV、GarCLV和LYSV;样品13和16检测到 GarCLV、LYSV和 OYDV)、6份样品检测到4种病毒/病毒组残留(样品2检测到ShLV、GarCLV、LYSV 和 allexiviruses;样品 3、11、14、15 和22检测到 ShLV、GarCLV、LYSV 和 OYDV)、1份样品 (样品19) 同时检测到 ShLV、GarCLV、LYSV、OYDV和allexiviruses残留。
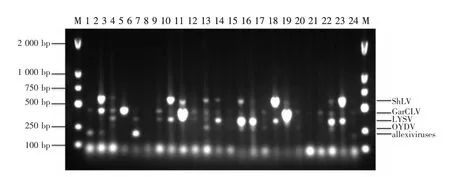
图5 应用多重RT-PCR检测大蒜组培苗样品Figure 5 Garlic tissue culture plantlets test using multiplex RT-PCR
大田样品病毒检测结果(图6a和图6b)表明,所有样品均受到至少2种病毒/病毒组的复合感染。其中,2种病毒/病毒组复合感染率仅为4.17%(2个样品)、3种病毒/病毒组复合感染率35.42%(17个样品)、4种病毒/病毒组复合感染率22.92%(11个样品)、5种病毒/病毒组复合感染率37.50%(18个样品)。另外,参试的48份大田样品中,ShLV检出率60.42%(29例)、GarCLV 检出率 47.92%(23例)、LYSV检出率89.58%(43例)、OYDV检出率95.83%(46例)、allexiviruses检出率100%。

图6 应用多重RT-PCR检测大田样品Figure 6 Garlic field sample test using multiplex RT-PCR
另外,本研究还利用单重RT-PCR对编号25~48的大田样品多重RT-PCR检测结果进行了验证(图7)。大蒜组培苗和大田样品病毒检测的应用,说明本研究建立的大蒜病毒多重RT-PCR检测方法准确、可靠,可以高效、特异的检测和鉴别感染我国大蒜的5种病毒/病毒组。
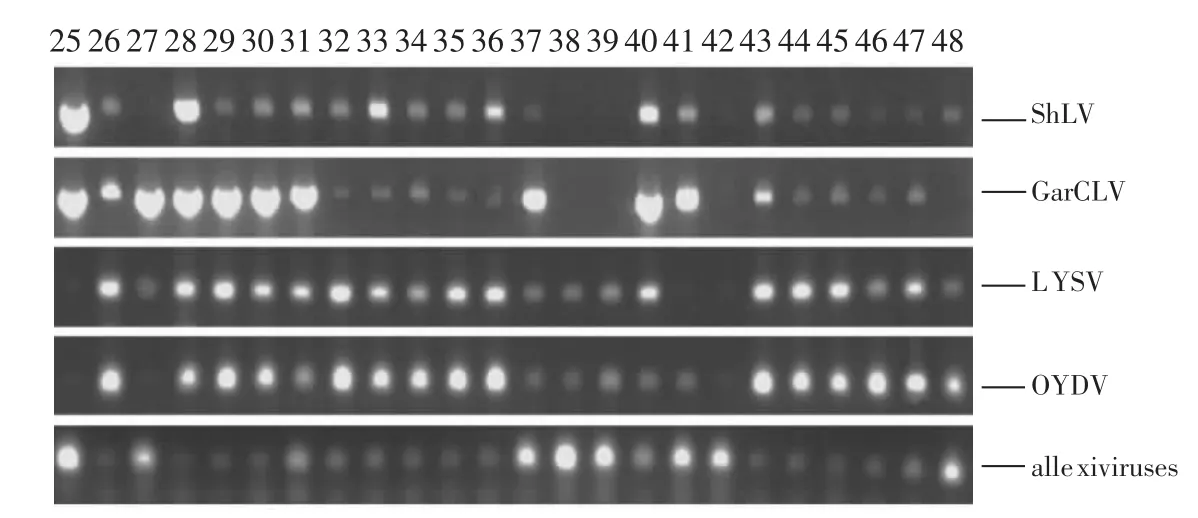
图7 应用单重RT-PCR检测大田样品Figure 7 Garlic field sample test using single RT-PCR
3 讨论
病毒病是最常见的大蒜病害,一旦染病很难有效治疗。防治大蒜病毒病最直接、最有效的方法是使用无病毒种植材料。CONCI等[13]研究表明,虽然无病毒大蒜种植材料在田间会很快受到病毒的再次感染,但是在第1个种植周期产量仍能增加66%~216%,鳞茎周长增加13%~37%;在第3年之前,产量逐渐下降,随后在第4年和第5年保持稳定,但仍高于常规大蒜种。
自20世纪70年代以来,国内外研究人员在利用植物组织培养技术脱除大蒜病毒方面进行了诸多研究[14-19]。但是由于繁殖系数低,导致大蒜脱毒组培和良种繁育等成本居高不下,脱毒大蒜良种难以广泛推广应用。在提高大蒜脱毒材料繁殖系数尚未取得突破性进展的情况下,进一步降低病毒检测等各环节成本有利于大蒜脱毒种植材料的推广应用。
多重RT-PCR技术是基于单重RT-PCR发展而来,该技术在一个反应体系中加入2对或2对以上引物,同时特异性扩增多个靶标,实现对多个靶标进行同时诊断的技术。由于多重RT-PCR技术的高效和低成本优势,目前已广泛应用于动植物病毒的检测[20-22]。为了进一步提高大蒜组培苗病毒检测效率、降低成本,从而推动大蒜脱毒种植材料的产业化应用,建立了一套能够同时检测和鉴定ShLV、GarCLV、LYSV、OYDV 和 allexiviruses 5 种病毒/病毒组的多重RT-PCR方法。该方法选择和设计的引物特异性强,病毒目的基因片段大小分布合理,不仅能够保证检测结果的准确性,还可以有效地鉴别侵染病毒的种类。
在多重RT-PCR体系中,引物扩增效率一致性是影响检测结果准确性的关键性因素。随着PCR反应体系内引物的增多,引物之间Tm相容难度增大,形成引物二聚体甚至多聚体的可能性也大幅增加,导致目的基因扩增效率降低,影响检测灵敏度和特异性[23]。本研究中,选用的5对引物在退火温度56.6℃都能获得最佳的扩增效果,具有较好的Tm相容性。然而,即使在最佳退火温度下,本研究选用的5对引物间仍存在扩增不平衡,通过引物比例的优化,在 ShLV、GarCLV、LYSV、OYDV 和 allexiviruses引物体积比为 10∶8∶3∶3∶16 时,能达到较为均衡的扩增效果,但是检测灵敏度相较于单重RT-PCR仍有一定程度的降低。
大蒜组培苗样品病毒检测结果表明,虽然保留两个茎尖叶原基脱毒成功率仅8.33%,但阳性苗的病毒载量仍显著低于大田样品,使得多重RT-PCR检测由于灵敏度降低而可能出现假阴性结果。因此,本研究建立的大蒜病毒多重RT-PCR检测方法虽然可以快速、有效地检测和鉴别5种病毒/病毒组,但应用于组培苗病毒检测尚有一定的灵敏度局限。另外,鉴于大田零星出现矮化、叶片皱缩的大蒜植株,本研究也通过大田样品的多重RT-PCR检测对其病毒感染情况进行了分析。结果发现,植株矮化、皱缩样品与花叶样品之间5种病毒/病毒组的感染情况并未出现明显差异,证明 ShLV、GarCLV、LYSV、OYDV 和allexiviruses 5种病毒/病毒组的侵染差异并非引起大蒜植株矮化、叶片皱缩的主要原因。

