细胞外热休克蛋白70在急性主动脉综合征中的表达研究
徐新兵 王靖 刘方汶 张宪静 岳茂奎 金亮
急性主动脉综合征(acute aortic syndrome,AAS)是一 种以破坏主动脉内膜和中膜为共同的生理病理表现的临床综合征[1],包括典型的主动脉夹层(acuye aortic dissection,AAD)、壁内血肿(intramural haematoma,IMH)、穿透性主动脉粥样硬化性溃疡(penetrating atherosclerotic aortic ulcer,PAU)以及主动脉破裂等。AAS 发病急,最佳救治时间窗口期极短,使患者病死率高居不下[2],给公共卫生健康带来了严重的威胁。流行病学显示主动脉夹层好发于冬季尤其高[3],提示冬季作为低温应激源可能参与了主动脉夹层的发生。热休克蛋白70(Heat Shock Protein70,HSP70)是一种机体在受到缺血、缺氧、寒冷等刺激因素下应激性表达的蛋白,可保护细胞免受应激性损伤[4]。HSP70 可以被细胞分泌到外周血浆中称为细胞外热休克蛋白(extracellular heat shok protein,eHSP70),可作为机体的一种危险信号而存在,其不仅可参与动脉粥样硬化的过程,同时可介导、激活机体炎症反应,加重心肌缺血、促进心肌纤维化、心肌凋亡等病理过程[5]。基于此,本研究拟通过检测急性主动脉综合征患者eHSP70 水平,探讨HSP70 在急性主动脉综合征发病机制中的作用。
1 临床资料
1.1 一般资料选择山东第一医科大学2 所附属医院2018 年1 月至2021 年1 月期间在急诊室经过CTA 确诊为AAS 的患者40 例作为AAS 组,选择同期于我院体检的一般资料匹配的40 例体检健康者作为对照组。纳入标准:所有患者均符合《主动脉疾病诊断和治疗指南》中AAS 的诊断标准,且经主动脉电子计算机断层扫描及血管造影确诊。排除标准:(1)慢性AD 或外伤性AD;(2)合并感染性疾病、结缔组织疾病、恶性肿瘤、肝肾功能不全、严重电解质紊乱、长期服用免疫抑制剂史、下肢静脉血栓病史、心肌梗死病史等慢性应激性疾病状态;(3)合并胸部外伤病及医源性主动脉疾病。本研究经山东第一医科大学第二附属医院伦理委员会批准(编号:202277)并取得受试对象的同意。
1.2 方法收集受试者的一般资料包括年龄、性别、随机血糖、吸烟史、体重指数、糖尿病史、高血压病史、发病季节和出院诊断等。AAS 组与对照组受试者分别与在进入急诊室后即刻、体检时收集静脉血3-5 ml 于EDTA 抗凝管中,离心后提取上层血浆,-80℃保存待检。样本eHSP70水平采用采用酶联免疫吸附法(Enzyme-Linked immunosorbent assy,ELISA),试剂盒由上海广锐生物科技有限公司提供,具体实验步骤参照试剂盒厂商生产商说明书进行,酶标仪(Thermo,Multiscan MK3)。
1.3 统计学方法应用SPSS17.0 统计软件进行统计学分析。计量资料采用(x±s)表示,两组间均数比较采用Mann-Whitney 秩和检验。计数资料两组间比较采用卡方检验,建立受试者工作曲线(receive operating charactoristic,ROC)分析eHSP70 对AAS 的早期诊断的敏感性和特异性。以P<0.05 为差异有统计学意义。
2 结 果
2.1 两组受试者一般资料比较见表1。
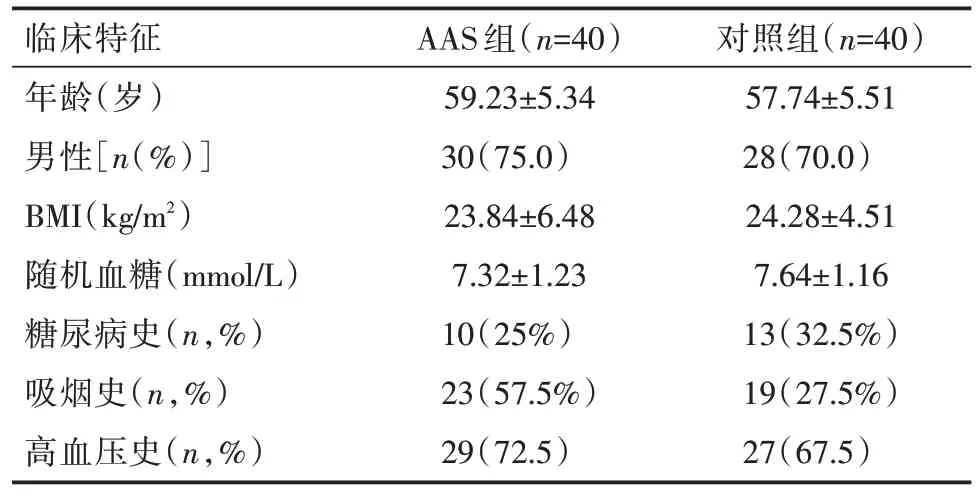
表1 AAS 组与HBP 组患者一般资料比较
2.2 AAS 发病季节分布见图1。

图1 AAS 患者组间发病季节分布
2.3 患者血浆eHSP70 的表达见图2、3。
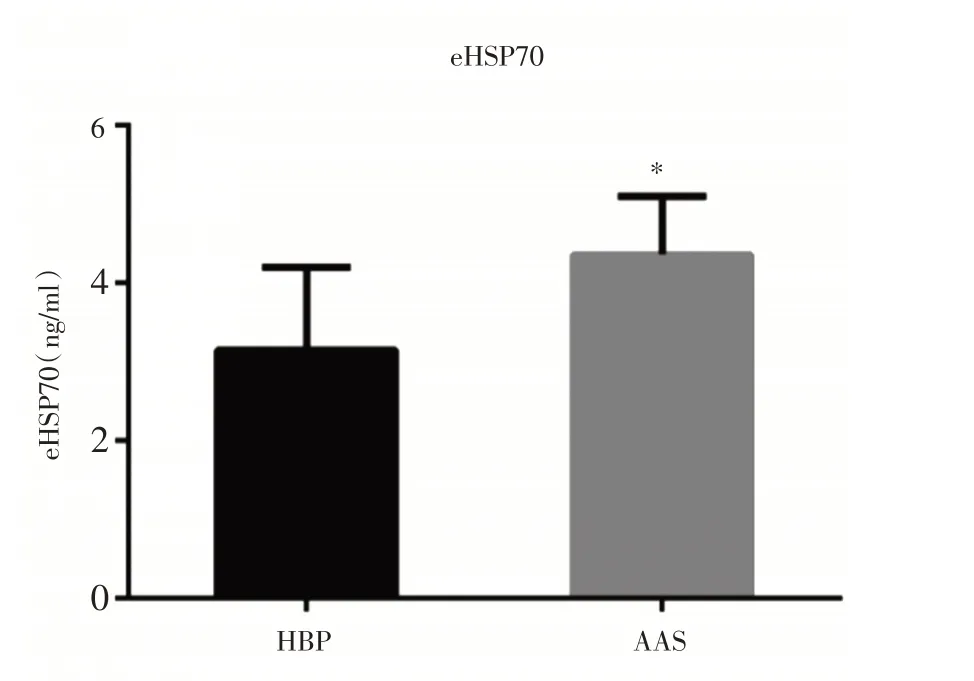
图2 AAS 组与HBP 组患者HSP70 水平比较
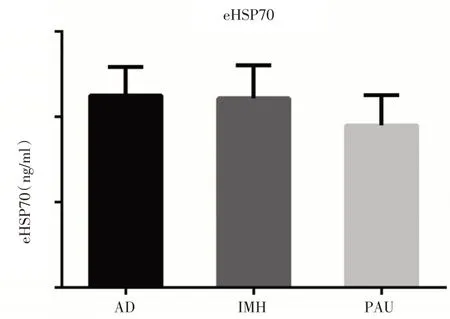
图3 AAS 患者组间eHSP70 水平比较
2.4 不同发病季节AAS 患者血浆eHSP70 的表达见表2。
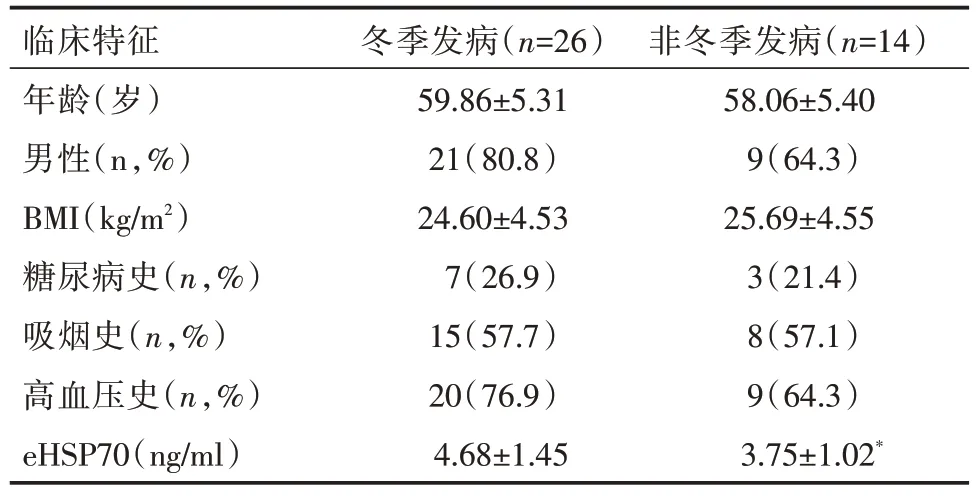
表2 不同发病季节AAS 患者一般资料比较
2.5 eHSP70 诊断AAS 的ROC 曲线见图4。
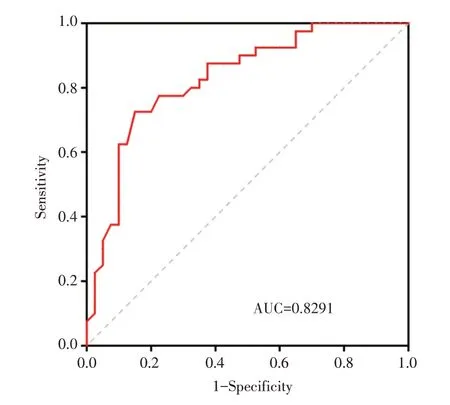
图4 eHSP70 对高血压合并急性主动脉综合征早期诊断的ROC 曲线
3 讨 论
AAS 是一组以主动脉内膜损伤和中膜退行性病变为特点的具有共同的病理生理学表现和临床特征的一组疾病,如不及早诊治可导致灾难性事件[2]。近年来,流行病学发现AAS 具有显著的季节和时间规律,即多发生在冬季[3],提示低温应激源可能参与了主动脉夹层的发生。热休克蛋白(heat shock protein,HSP)是机体在低温等多种应激因素的刺激作用下产生的一种非特异性的防御性产物,可保护机体免受高低温、创伤、感染等损伤。HSP 根据相对分子质量、同源程度分为多个家族,其中HSP70 在生物细胞中含量、可诱导性优于其他家族,且在心肌细胞保护中发挥着重要作用[4]。然而,在应激状态时HSP70 被分泌至外周血浆中时则变为eHSP70 成为一种机体危险信号[6]。
在本项研究中,AAS 冬季发病率高达65%,具有明显的季节依赖性,与既往研究相似[7],分析原因为低温会导致血小板聚集率增加,血液黏度增加,进而导致主动脉内血流动力学参数升高,当超过主动脉壁张力阈值时导致主动脉壁破裂。此外,AAS 组患者血清eHSP70 水平显著高于对照组,且ROC 曲线显示eHSP70 对AAS 的有一定诊断价值,提示eHSP70 可能参与了AAS 的发生、发展过程。eHSP70 来自于应激反应后细胞内生成的HSP70 主动分泌到循环中的细胞因子,具有免疫调节功能,可以与细胞表面MHC 抗原结合发挥呈递作用,诱发炎症反应[6]。本研究AAS 组eHSP70 水平上升提示这可能与AAS 组发生了过度应激反应有关。在存在慢性炎症反应的基础上,当细胞因低温应激再次合成和分泌eHSP70,必然会引起剧烈的炎症反应及抗原抗体反应,表现为促炎作用,分泌大量炎症因子,损伤血管内皮,引发动脉损伤。此外,既往研究发现主动脉平滑肌细胞在遭受炎症损伤会合成HSP70,对抗氧化应激导致的损伤[8],同时平滑肌细胞也会主动分泌少量HSP70 到细胞外,作为一个机体自救的一个危险信号。与细胞内HSP70 功能不同,eHSP70 作为机体的外来异物,有很强的免疫原性,可刺激机体产生相应的免疫抗体,同时诱导树突状细胞和补体活化以及促进细胞炎症因子的产生和分泌加剧内膜炎症损伤[6]。
本项研究进一步比较不同季节AAS 发病人群的eHSP70 水平,结果显示,冬季AAS 发病患者血清eHSP70显著高于非冬季,提示eHSP70 的释放与寒冷应激有关。既往研究相继证明了在热应激、癌症等刺激下,HSP70 可能通过某种分泌途径被释放到细胞外,因此血清eHSP70水平会升高。然而关于冷应激对eHSP70 的影响相关研究甚少。因此,未来可进一步进行探索冷应激对eHSP70 的作用机制,以及是否可通过降低患者eHSP70 水平减少AAS 的发生或病情严重程度。
综上所述,AAS 患者外周血存在高水平的eHSP70,这与寒冷应激为代表的应激原引发的应激反应相关,eHSP70可能通过加重AAS 的慢性炎症参与了AAS 的发生。然而本项研究纳入样本量较少,存在一定的偏倚,因此,未来需扩大样本量,进一步进行多中心的研究,深入探讨低温对于AAS 的影响。

