氯化镧对低磷胁迫下绿豆生理特性及相关基因表达的影响
秦成 申洁 祁茂冬 合展 连慧达




摘要:磷是植物体内第二大营养元素,土壤磷含量不足会引起植物生长发育缓慢。为探究氯化镧(LaCl3)对低磷胁迫下绿豆幼苗的缓解效应,以晋绿豆8号为供试材料,采用水培法,设置4个处理,分别为正常(CK)、低磷胁迫(LP)、正常条件喷施氯化镧(CK+La)、低磷胁迫喷施氯化镧(LP+La),对绿豆幼苗进行了光合特性及相关基因表达水平、抗氧化系统及渗透调节等方面的研究。结果表明,低磷胁迫导致绿豆活性氧积累、光合特性及叶绿素含量降低,显著抑制绿豆幼苗的生长;而低磷胁迫下喷施LaCl3能够有效激活参与光合作用过程的PsbO、PsbP、PsbQ、PsbY基因的表达,绿豆幼苗的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、叶绿素含量均提高,提升了抗氧化酶(SOD、CAT)活性、渗透保护物质(可溶性糖、脯氨酸)含量,降低了花青素含量、胞间CO2浓度(Ci)、丙二醛(MDA)、H2O2含量;同时绿豆幼苗大量元素(N、P、K)含量显著提高。综上所述,LaCl3可以增强绿豆幼苗耐低磷性,促进绿豆生长,可为镧肥的开发利用及绿豆栽培调控提供理论依据。
关键词:氯化镧;绿豆幼苗;低磷胁迫;光合特性;渗透保护物质;抗氧化酶活性
中图分类号:S522.01 文献标志码:A
文章編号:1002-1302(2023)08-0105-06
基金项目:山西省青年基础研究计划(编号:20210302124144、20210302124362);山西省高等学校科技创新项目(编号:2021L517);国家食用豆产业技术体系项目(编号:CARS-08-G10)。
作者简介:秦 成(1993—),女,山西长治人,博士,讲师,现主要从事植物逆境生理等研究工作。E-mail:qc332084910@163.com。
通信作者:连慧达,博士,副教授,现主要从事作物逆境栽培生理生态等研究工作。E-mail:lianhuidada@163.com。
绿豆(Vigna radiata L.)属豆科作物,作为中国主要的食用豆类之一,广泛种植于温带、亚热带、热带地区[1]。绿豆具有生育期短,适播期长,适应性广,耐旱、耐贫等生长优点,同时具有高蛋白、中淀粉、低脂肪的特点,含有丰富的维生素和矿物质及许多生物活性物质,其营养价值、药用价值和保健价值较高,被广泛应用于食品、酿造、医药、工业等领域[2]。但因绿豆属于小宗作物,多种植在土壤贫瘠的干旱、半干旱地区,土壤的质量和肥力严重制约了绿豆产量及产业的发展[3]。
磷作为植物生长发育过程所需的第二大矿质营养元素[4],参与生物体内许多重要的酶促反应及代谢调节过程,是目前绿豆产区制约产量和品质的主要限制因素之一[5]。磷肥的当季利用率只有15%左右,大部分的磷残留到土壤中,形成难溶化合物,使土壤中易被植物直接吸收的正磷酸盐处于较低水平,导致作物面临磷素摄入不足的现状[6]。磷摄入不足将影响植物细胞分裂,致使植株矮小、叶片暗绿、根系发育受阻等;同时植物体内光合色素合成减少,蛋白质合成受阻,酶活性也发生改变。前人研究发现,低磷胁迫显著提高了柱花草植株的丙二醛(MDA)、过氧化氢(H2O2)含量[7]。王月等研究结果表明,低磷条件下,番茄叶片超氧化物歧化酶、过氧化物酶、过氧化氢酶活性、光合能力和叶绿素含量显著降低[8]。陈洁等研究表明,低磷胁迫显著抑制了红豆草幼苗生长,增加其渗透调节物质含量(可溶性蛋白、脯氨酸)[9]。因此,探讨低磷胁迫对绿豆幼苗形态及其抗氧化系统和渗透调节物质的影响,减轻低磷胁迫对绿豆生长的抑制作用是生产上亟待解决的问题。
近年来,以含镧、铈等轻稀土为主的元素广泛应用于农林业,可达到促进植物生长和提高生产力的作用[10]。已有研究表明,适量的稀土镧元素可以增强植物的抗逆能力,提高作物的光合能力,增加作物对养分的吸收利用和转化,促进土壤释放氮、磷、钾等无机离子,从而提高作物的产量[6,11]。但尚未见喷施镧后对绿豆生理影响方面的报道。为此,本研究设置2个磷水平(正常供磷和低磷胁迫),通过叶面喷施氯化镧溶液,探究LaCl3对低磷胁迫下幼苗生长及渗透调节的作用,以期为镧肥在农业生产中的合理利用提供理论依据。
1 材料与方法
1.1 试验材料与设计
供试品种为晋绿豆8号,由山西农业大学种质资源平台提供。试验于2021年3—7月在长治学院智能温室(36°12′N,113°8′E)进行。挑选饱满一致的种子,经5% NaClO浸泡10 min后,用无菌水冲洗5次,置于内含2层滤纸的发芽盒中,放入2层滤纸(25 ℃,黑暗)内萌发。选取芽长一致的种子播种到含复合基质(蛭石、珍珠岩体积比为3 ∶1)的培养钵内(12 cm×15 cm),室内25 ℃/20 ℃(白天/夜晚),相对湿度为70%;每 2~3 d 用 1/2 Hoagland 营养液浇灌,待幼苗第4片叶展开后,选取长势健壮一致的绿豆幼苗(4株/每筐)移至水培筐中,缓苗 2 d 后,开始进行试验处理。
试验共分为4个处理:CK,正常磷营养液 (Hoagland营养液含磷量10 mg/L)+喷清水对照;LP,低磷胁迫 (含磷量为正常Hoagland营养液5%)+喷清水;CK+La,正常磷营养液+叶面喷施 100 μmol/L LaCl3;LP+La,低磷胁迫+叶面喷施100 μmol/L LaCl3。外源LaCl3采用叶面喷施的方式,通过预试验,筛选100 μmol/L为喷施浓度,于每天18:00喷施,以叶片湿润而不滴水为标准,每个处理重复3次,每次重复12株。处理12 d后,挑选长势一致的幼苗,进行相关指标测定。
1.2 测定项目与方法
1.2.1 植株形态指标及其干质量
绿豆幼苗的株高用直尺测定,叶面积采用方格法测定;将样品放到烘箱105 ℃杀青1 h后80 ℃烘干至恒质量,称量其地上地下部干物质量,各指标重复测定3次。
1.2.2 幼苗生理特性指标
自上而下选择第3张完全展开的叶片,用 Li-6400XT 便携式光合仪在09:00—11:30测定光合参数;叶绿素含量采用丙酮浸提法[12]测定,花青素含量参照李红艳等的方法[13]测定。丙二醛(MDA)含量采用硫代巴比妥酸法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定;可溶性糖含量、脯氨酸含量、过氧化氢酶(CAT)活性、过氧化氢(H2O2)含量参照高俊凤的方法[12]测定。凯氏定氮仪测定全氮;钒钼黄比色法测定全磷;火焰光度法[12]测定全钾。
1.2.3 基因表达分析
绿豆幼苗叶片用超纯水清洗 2~3 次,用滤纸吸干表面水分,迅速置于液氮中冷冻,用于RNA 提取。总 RNA 的提取依据 RNA 提取试剂盒(博日)说明书进行。cDNA参照TaKaRa公司的反转录试剂盒说明书制备。实时荧光定量 qRT-PCR(quantitative real-time PCR)使用BioEasy master Mix(博日)试剂盒进行反应。所有引物的序列均采用Primer 5.0软件进行设计(表1)。研究了4个参与光合作用的基因PsbO、PsbP、PsbQ、PsbY。以肌动蛋白为内参基因,并通過2-ΔΔCT方法计算相对表达[14]。
1.3 数据分析
采用Microsoft Excel 2010软件对数据进行整理,IBM SPSS Statistics 2软件进行统计分析,用Duncans新复极差测验法(α=0.05)进行单因素显著性方差分析,采用Origin 2019作图。数据结果展示均为平均数±标准差。
2 结果与分析
2.1 外源LaCl3对低磷胁迫下绿豆幼苗生长的影响
由表2可知,绿豆幼苗的株高、干质量及叶面积在低磷胁迫下均显著降低,与对照相比,LP处理导致株高、干质量、叶面积分别降低32.80%、48.37%、30.12%。与对照相比,CK+La处理后幼苗株高增加14.83%,差异达显著水平。LP+La处理比LP处理的株高、干质量、叶面积分别提高了21.02%、43.16%、16.96%,差异达显著水平。
2.2 外源LaCl3对低磷胁迫下绿豆幼苗光合参数及色素含量的影响
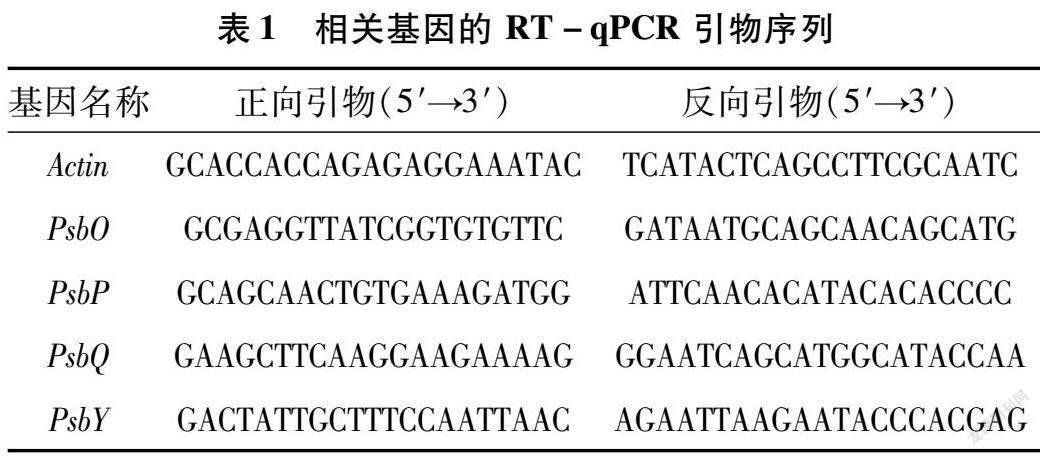
由图1可知,与CK相比,LP处理导致绿豆幼苗叶片的Pn、Tr、Gs均降低,分别降低23.31%、35.25%、47.64%,而Ci增加了28.97%。与CK处理相比,CK+La处理后绿豆幼苗叶片的Pn值提高39.87%,增幅较大。LP+La处理比LP处理的幼苗叶片Pn、Tr、Gs分别提高了15.42%、30.89%、77.21%,差异达显著水平;而幼苗叶片Ci降低了15.47%,表明LaCl3处理能有效缓解低磷胁迫对绿豆幼苗造成的光合损伤。
LP处理导致绿豆幼苗叶绿素含量降低,与CK组相比降低43.68%,差异达显著水平;而LP+La处理能够有效提高叶片叶绿素含量,相比LP处理增幅为36.03%,表明LaCl3处理可以明显增加低磷胁迫下绿豆幼苗叶片的叶绿素含量。LP处理使绿豆幼苗叶片的花青素含量显著增加,是CK处理的2.38倍;与LP处理相比,LP+La处理后叶片的花青素含量显著降低,降幅为25.75%,表明LaCl3能减缓低磷胁迫下绿豆叶片花青素含量的积累。
2.3 外源LaCl3对低磷胁迫下绿豆幼苗叶片MDA、H2O2含量的影响
由图2可知,与CK相比,LP处理后绿豆幼苗叶片的MDA、 H2O2含量均显著增加 增幅为1.05、1.03倍。CK+La处理后的MDA、H2O2含量较CK处理下降,均未达显著水平。与LP处理相比,LP+La处理后绿豆叶片的MDA、H2O2含量显著降低,分别降低27.81%、20.56%。
2.4 外源LaCl3对低磷胁迫下绿豆幼苗叶片渗透保护物质和抗氧化酶活性的影响
由图3可知,与CK处理相比,LP处理下绿豆叶片的可溶性糖、脯氨酸含量分别增加了1.07、0.93倍,差异达显著水平,LaCl3处理可显著提高绿豆叶片的可溶性糖、脯氨酸含量。与LP处理相比,LP+La处理后叶片的可溶性糖、脯氨酸含量显著增加了13.34%、12.77%。与CK相比,LP处理下绿豆幼苗SOD、CAT活性均升高,其中SOD增幅较大,为74.33%。与LP处理相比,LP+La处理后叶片的SOD活性增加28.81%,差异达显著水平。表明LaCl3可显著提高低磷胁迫下渗透保护物质的含量及抗氧化酶活性。
2.5 外源LaCl3对低磷胁迫下绿豆幼苗大量元素N、P、K含量的影响
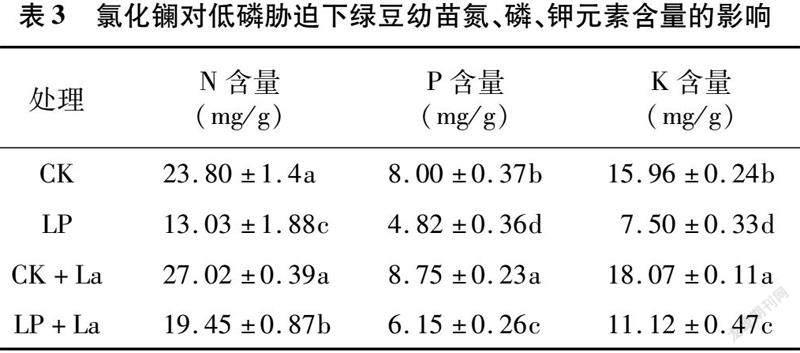
由表3可知,与CK处理相比,LP处理下绿豆幼苗的N、P、K含量均显著降低,降幅分别为45.25%、39.75%、53.01%。CK与CK+La处理间绿豆幼苗N、P、K含量同样存在差异,P、K含量差异达显著水平。与LP处理相比,LP+La处理后绿豆幼苗的N、P、K含量显著提高,分别为49.27%、27.60%、48.27%;说明低磷条件下LaCl3能有效缓解大量元素不足而引起的绿豆幼苗生长缓慢。
2.6 外源LaCl3对低磷胁迫下绿豆幼苗参与光合相关基因表达的影响
由图4可知,与对照相比,LP处理显著下调PsbO、PsbP、PsbQ、PsbY的表达,分别下调了39.63%、49.6%、26.27%、39.57%。与LP处理相比,LP+La处理后显著上调PsbO、PsbP、PsbQ、PsbY的表达,分别上调了32.41%、59.52%、22.61%、32.43%。与对照相比,CK+La处理上调了PsbO、PsbP、PsbQ、PsbY的表达,但仅PsbO、PsbQ、PsbY呈显著上调,分别上调了20.37%、22.6%、19.63%。
3 讨论
镧能够调节植物的生长发育,提高植物抵御环境胁迫的能力,如干旱[15]、低温[16]、盐碱[17]及重金属[18]等。而镧能否缓解植物响应营养胁迫尚不明确。
本研究发现,低磷胁迫下绿豆幼苗的株高、叶面积、整株干质量明显低于对照,这与前人的研究结论一致[19]。喷施外源LaCl3有效缓解低磷胁迫对绿豆幼苗的损害,显著提高株高、叶面积、整株干质量。叶片光合速率(Pn)是植物积累生物量的重要的决定因素之一[20]。本研究中,低磷胁迫导致绿豆幼苗Pn、Tr、Gs显著降低;而喷施LaCl3可有效缓解低磷胁迫时叶片气孔的闭合程度,促进植物对CO2的吸收,从而提高植物的光合能力。Wang等研究表明,低浓度的La3+会通过激活核酮糖1,5-二磷酸羧化酶活性进而提高植物的光合速率[21-22] 。总叶绿素含量下降是色素光氧化和叶绿素降解的典型迹象,植物叶绿素代谢生物合成的调节取决于环境胁迫的强度和类型。喷施LaCl3可有效缓解低磷胁迫导致的绿豆叶绿素含量降低,这可能是因为镧能够控制植物光合色素的降解,保护了光反应系统,进而提高了低磷胁迫下绿豆幼苗的光合能力。PsbO、PsbP、PsbQ蛋白一起形成类囊体管腔,是高等植物的氧气进化复合体的一部分,起到稳定PSⅡ光抑制产生ROS的至关重要的作用[23]。PsbY是对原核复合体组装和光保护至关重要的蛋白[24]。本研究中,与低磷胁迫植株相比,叶面喷施氯化镧效果显著,4个PSⅡ相关基因(PsbO、PsbP、PsbQ、PsbY)的表达上调,这表明,LaCl3通过调控光合作用相关基因表达的增加,导致PSⅡ光化学效率的提高。缺磷胁迫后的植物通常会积累花青素。缺磷条件下,叶片的光合速率变小、花青素积累增加、叶片呈紫色[25]。花青素的积累可以保护核酸和叶绿体免受磷饥饿引起的损害[26]。本研究结果表明,低磷胁迫导致绿豆幼苗叶片的花青素含量显著增加,而喷施LaCl3处理能减缓低磷胁迫下绿豆叶片花青素含量的积累。
逆境胁迫下,过量的ROS积累会导致脂质过氧化损伤和细胞死亡。MDA含量可以作为自由基损伤细胞膜的指标。在本研究中,由于ROS的产生,缺磷胁迫下,H2O2、MDA含量显著增加。然而,喷施LaCl3可有效抑制H2O2、MDA的累积。这一发现与其他研究的结果一致,如镧处理可降低冷胁迫下的蚕豆植株的MDA含量,并增加植物抗氧化防御系统的活性[27]。植物通过合成积累渗透调节物质来抵御不良环境,此外,抗氧化防御能力是植物适应缺磷的重要机制之一。喷施LaCl3可增加可溶性糖和脯氨酸含量,提高抗氧化酶SOD、CAT的活性。Pang等研究指出,镧可增强氧自由基的清除能力,并最终提高小麦的耐铅性[28]。说明LaCl3起到抗氧化剂的作用,不仅可以刺激抗氧化系统,降低绿豆幼苗在低磷胁迫下H2O2的累积,还可以提高低磷胁迫下抗氧化酶的活性和抗氧化潜力。
许多研究表明,稀土元素可以刺激植物吸收、转移、同化养分的能力,而且稀土元素在植株体外对磷酸根离子具有很强的亲和力[29]。本试验结果表明,低磷胁迫下喷施LaCl3可显著提高绿豆幼苗N、P、K的含量。含稀土元素的肥料可以起到调控磷吸收的作用,与前人研究结果[30]一致。
4 结论
外源LaCl3 可促进低磷胁迫下绿豆幼苗对N、P、K元素的吸收并增加绿豆的株高、叶面积、整株干质量,同时提高绿豆幼苗的叶绿素含量及光合能力,上调PsbO、PsbP、PsbQ、PsbY光合作用相關蛋白基因的表达和活性;提高渗透保护物质(可溶性糖、脯氨酸)含量,并诱导抗氧化酶(SOD、CAT)活性的增加,降低叶片的花青素、MDA、H2O2的含量,以清除活性氧积累,降低膜质过氧化程度,缓解低磷胁迫对绿豆植株造成的伤害。
参考文献:
[1]柴 岩,冯佰利. 中国小杂粮产业发展现状及对策[J]. 干旱地区农业研究,2003,21(3):145-151.
[2]高小丽,高金锋,冯佰利,等. 西部有机特色小杂粮产业发展战略研究[J]. 干旱地区农业研究,2006,24(6):227-230.
[3]程须珍,王素华,田 静,等. 绿豆优异种质综合评价[J]. 中国农业科学,1999,32(增刊1):36-39.
[4]张福锁,王激清,张卫峰,等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报,2008,45(5):915-924.
[5]Vance C P,Uhde-Stone C,Allan D L. Phosphorus acquisition and use:critical adaptations by plants for securing a nonrenewable resource[J]. The New Phytologist,2003,157(3):423-447.
[6]Chen Q,Qu Z M,Li Z L,et al. Coated diammonium phosphate combined with humic acid improves soil phosphorus availability and photosynthesis and the yield of maize[J]. Frontiers in Plant Science,2021,12:759929.
[7]王金鹏,廖 丽,刘国道,等. 低磷胁迫对柱花草生长及抗氧化系统的影响[J]. 热带作物学报,2021,42(10):2875-2880.
[8]王 月,王鲁鑫,李浩天,等. 不同磷水平下CO2浓度升高对番茄光合特性和抗氧化酶活性的影响[J]. 江苏农业科学,2022,50(12):163-167.
[9]陈 洁,魏少萍,梁鹏飞,等. 不同红豆草材料耐低磷性评价及种质筛选[J]. 中国草地学报,2022,44(3):72-80.
[10]Lian H D,Qin C,Zhang C,et al. Foliar-applied lanthanum chloride increases growth and phosphorus acquisition in phosphorus-limited adzuki bean seedlings[J]. Plant and Soil,2019,442(1):385-399.
[11]任红玉,王 亮,赵慧莉,等. 稀土对东北大豆叶片脯氨酸含量的影响[J]. 中国稀土学报,2015,33(4):480-486.
[12]高俊凤. 植物生理学试验指导[M]. 北京:高等教育出版社,2006.
[13]李红艳,李洁雅,李 响,等. 过表达LrAN2基因对马铃薯中花青素和糖苷生物碱含量的影响[J]. 作物学报,2023,49(4):988-995.
[14]Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research,2001,29(9):e45.
[15]王宇辰,陈孟起,李耀光,等. 镧处理对干旱胁迫下烟草根系形态与生理特征的影响[J]. 中国稀土学报,2018,36(3):319-327.
[16]段晓宇,唐 敏,汪维双,等. 三氯化镧对一品红组培苗抗寒性的影响[J]. 北方园艺,2013(9):73-77.
[17]付英杰,刘月帅,李艳芝,等. 氯化镧对不同浓度盐、碱胁迫条件下不同种薄荷抗逆性的影响[J]. 中国药房,2017,28(31):4376-4380.
[18]吴文杰,张意萍. 镧对铜胁迫红豆幼苗和根尖生长的影响[J]. 作物杂志,2012(1):96-98.
[19]索炎炎,张 翔,司贤宗,等. 施用磷和钙对花生生长、产量及磷钙利用效率的影响[J]. 作物杂志,2021(1):187-192.
[20]林郑和,陈荣冰,郭少平. 植物对缺磷的生理适应机制研究进展[J]. 作物杂志,2010(5):5-9.
[21]Wang E L,Bell M,Luo Z K,et al. Modelling crop response to phosphorus inputs and phosphorus use efficiency in a crop rotation[J]. Field Crops Research,2014,155:120-132.
[22]Pang J Y,Zhao H X,Bansal R,et al. Leaf transpiration plays a role in phosphorus acquisition among a large set of chickpea genotypes[J]. Plant,Cell & Environment,2018,41(9):2069-2079.
[23]von Sydow L,Schwenkert S,Meurer J,et al. The PsbY protein of Arabidopsis Photosystem Ⅱ is important for the redox control of cytochrome b559[J]. Biochimica et Biophysica Acta-Bioenergetics,2016,1857(9):1524-1533.
[24]Zhang H H,Xu Z S,Guo K W,et al. Toxic effects of heavy metal Cd and Zn on chlorophyll,carotenoid metabolism and photosynthetic function in tobacco leaves revealed by physiological and proteomics analysis[J]. Ecotoxicology and Environmental Safety,2020,202:110856.
[25]孫丽超. 拟南芥PHL2和PHR1共同调控对低磷胁迫的转录响应[D]. 北京:清华大学,2015.
[26]杜宇倩,于国康,王梦怡,等. 氮磷钾肥对马铃薯新品种黑美人产量、淀粉及花青素含量的影响[J]. 天津农业科学,2020,26(7):75-77,85.
[27]Wang C R,Lu X W,Tian Y,et al. Lanthanum resulted in unbalance of nutrient elements and disturbance of cell proliferation cycles in V. faba L.seedlings[J]. Biological Trace Element Research,2011,143(2):1174-1181.
[28]Pang X,Wang D H,Xing X Y,et al. Effect of La3+ on the activities of antioxidant enzymes in wheat seedlings under lead stress in solution culture[J]. Chemosphere,2002,47(10):1033-1039.
[29]Ding S M,Liang T,Zhang C S,et al. Accumulation and fractionation of rare earth elements (REEs) in wheat:controlled by phosphate precipitation,cell wall absorption and solution complexation[J]. Journal of Experimental Botany,2005,56(420):2765-2775.
[30]Lian H D,Qin C,Zhang L,et al. Lanthanum nitrate improves phosphorus-use efficiency and tolerance to phosphorus-deficiency stress in Vigna angularis seedlings[J]. Protoplasma,2019,256(2):383-392.

