乙腈和甲酸含量对猪肉和鸡蛋中兽药残留回收率的影响
李晓芹 方志娟 王伟 金萍 张玲 丁洪流
摘要[目的]探索提取液中不同含量的乙腈、甲酸对猪肉、鸡蛋中磺胺类、四环素类和喹诺酮类兽药残留回收率的影响。[方法]采用70%、80%、90%、100%乙腈溶液及含0.1%、0.2%、0.5%、1.0%甲酸的90%乙腈溶液分别进行提取,比较共提物含量差别;通过外源加标回收试验,评价不同含量的乙腈和甲酸对猪肉和鸡蛋样品中兽药残留回收率的影响。[结果]增加乙腈比例和降低甲酸含量可以减少共提取量,但100%乙腈溶液会容易造成样品结块,建议采用90%乙腈溶液作为提取液。酸化的乙腈溶液利于磺胺类药物的提取,90%乙腈利于四环素类藥物的提取,对部分喹诺酮类药物具有明显的基质增强作用。[结论]在选择提取条件时,应根据检测需求选择合适的提取溶液,应注意可能存在基质作用,需进一步净化以准确定量。
关键词乙腈;甲酸;提取;猪肉;鸡蛋;兽药残留;回收率
中图分类号S851.34+7文献标识码A
文章编号0517-6611(2023)08-0190-04
doi:10.3969/j.issn.0517-6611.2023.08.044开放科学(资源服务)标识码(OSID):
Effects of Acetonitrile and Formic Acid Contents on the Recovery Rate of Veterinary Drug Residues in Pork and Eggs
LI Xiao-qin, FANG Zhi-juan, WANG Wei et al(Suzhou Inspection for Food and Testing Center, Suzhou, Jiangsu 215104)
Abstract[Objective]To explore the effects of different acetonitrile and formic acid contents on the recovery rate of veterinary drug residues of sulfonamides, tetracyclines and quinolones in pork and eggs. [Method]Pork and egg samples were extracted with acetonitrile-water ratios of 70%, 80%, 90%, 100% and 90% acetonitrile solution containing 0.1%, 0.2%, 0.5%, 1.0% formic acid, respectively.Differences in co-extraction contents were compared. Spike recovery test to evaluate the effect of different ratios of acetonitrile and formic acid on the recovery of veterinary drug residues in pork and egg samples.[Result] Increasing the proportion of acetonitrile and reducing the content of formic acid could reduce the co-extraction amount of impurities, but 100% acetonitrile was easy to cause agglomeration. It was recommended to use 90% acetonitrile solution as the extraction solution. The acidified acetonitrile solution was beneficial to the extraction of sulfonamides, 90% acetonitrile was beneficial to the extraction of tetracyclines, and had obvious matrix enhancement effect on some quinolones. [Conclusion]When selecting extraction conditions, an appropriate extraction solution should be selected according to the detection requirements.There may be matrix effects during multi-residue detection. Further purification is required to accurate quantificate.
Key wordsAcetonitrile;Formic acid;Extraction;Pork;Egg;Veterinary drug residues;Recovery rate
近年来市场监管局对动物源性农产品质量安全的监管力度不断加大。动物源性农产品基质复杂,富含蛋白质、脂肪、糖等成分,干扰兽药残留物的提取和净化。而兽药残留量含量甚微、极性差别大[1-2]。无论是蛋白质或脂肪的分离去除过程,还是待测液的定性和定量,都给实验室痕量检测提出了更高要求[3]。目前,动物源性农产品中兽药残留检测多依托于液质联用分析技术[4-5]。液质联用仪对待测液清洁度要求较高,需要杂质含量尽量低,因为共提物很容易对检测结果造成干扰[6],影响结果的准确性,同时也会缩短设备使用寿命。批量性的检测任务也促使兽药残留检测技术不断向前处理简单、高通量、自动化方向发展。因此,样品制备既需要能获得好的回收率、较少引入杂质的提取方式,减轻样品净化的难度,又需要该方法具备通用性、简单易操作[7-8]。甲酸和乙腈是目前高通量检测技术较为常用的提取溶液[9-10]。
目前关于兽药残留方法有效性验证的研究较多[11-13],专门针对提取环节考察的相对较少[14]。笔者比较了猪肉、鸡蛋样品中采用不同比例的乙腈和甲酸溶液进行提取时引入的杂质即共提物量[15],同时考察了对磺胺类、四环素类和喹诺酮类药物回收率的影响,以期为实验室在选取试验条件时提供参考。
1材料与方法
1.1仪器超高效液相色谱仪UPLC I-Class(沃特世);QTrap6500+四级杆-线性离子阱质谱仪(AB SCIEX);全自动均质器(睿科);数显型涡旋仪(IKA);超声清洗仪(科导);超纯水仪RiOsTM(密理博);恒温干燥箱(赛默飞)。
1.2试剂乙腈(质谱级,默克);甲醇(质谱级,默克);甲酸(质谱级,TCI)。标准物质混合标准溶液购自天津阿尔塔科技有限公司,含量均为100 μg/mL,包括22种磺胺类[磺胺嘧啶、磺胺噻唑、磺胺吡啶、磺胺甲基嘧啶、磺胺二甲(基)嘧啶、磺胺-6-(间)甲氧嘧啶、磺胺甲噻二唑、磺胺对甲氧嘧啶、磺胺氯哒嗪、磺胺甲氧哒嗪、磺胺邻二甲氧嘧啶、磺胺间二甲氧嘧啶、磺胺甲基异恶唑、磺胺二甲异恶唑、苯酰磺胺、磺胺喹恶啉、磺胺醋酰、甲氧苄啶、磺胺苯吡唑、磺胺脒、磺胺二甲异嘧啶、磺胺恶唑]、7种四环素类(四环素、土霉素、金霉素、强力霉素、甲烯土霉素、4-差向四环素、去甲金霉素)、9种喹诺酮类(恩诺沙星、诺氟沙星、培氟沙星、环丙沙星、氧氟沙星、沙拉沙星、萘啶酸、恶喹酸、氟甲喹)。
1.3标准溶液配制
1.3.1混合标准储备液。分别准确移取适量标准物质混合标准溶液,用甲醇定容,配制成2 000 ng/mL混合标准储备液,棕色储液瓶存储,-18 ℃保存。
1.3.2混合标准工作液。分别移取适宜量的混合标准储备液,配制成100 ng/mL的混合标准工作液,现配现用。
1.4试验方法
1.4.1样品前处理方法优化。准确称取试样2 g(精确至0.01 g),置于50 mL带盖塑料离心管中,加混合标准工作液200 μL(即加标量10 μg/kg)。分为2组,第一组分别加入10 mL乙腈水溶液,其中乙腈含量分别为70%、80%、90%、100%。第二组分别加入10 mL 90%乙腈溶液[即乙腈∶水=9∶1(v∶v)],其中甲酸含量分别为0.1%、0.2%、0.5%、1.0%。均质器均质提取30 s,超声提取2 min,8 000 r/min离心3 min。取2 mL提取液40 ℃以下氮吹至近干,1 mL 10%水乙腈溶液复溶,10 000 r/min离心5 min后取清液,供UPLC-MS/MS分析。每种提取方式做3个重复试验,扣除空白后取3次加标回收结果的平均值。
1.4.2共提物测定。准确移取5 mL上述提取液至预称重(精确至0.000 1 g)的玻璃试管中,50 ℃氮吹至干,105 ℃烘箱烘干过夜,称重。每种提取方式做3个重复试验,扣除空白后取3次共提物百分比结果的平均值。共提物百分比的计算公式如下:
共提物百分比=试管最终重量-试管初始重量/5 mL提取液对应样品重量×100%
1.4.3色谱条件。色谱柱为Waters BEH C(2.1 mm×100 mm,1.7 μm);柱温45 ℃,进样体积2 μL,流速0.30 mL/min。A相为0.1%甲酸水溶液,B相为甲醇,梯度洗脱:0 min 98%A,0.5 min 98%A,13.0 min 1%A,15.0 min 1%A,15.1 min 98%A,17.0 min 98%A。
1.4.4质谱条件。电喷雾(ESI)离子源,分段多反应监测采集模式,扫描窗口60 s。雾化电压(IS)5 500 V(正),气帘气(CUR)206.8 kPa,离子源温度(TEM)500 ℃,雾化气(GS1)344.7 kPa,辅助加热气(GS2)413.7 kPa。
2结果与分析
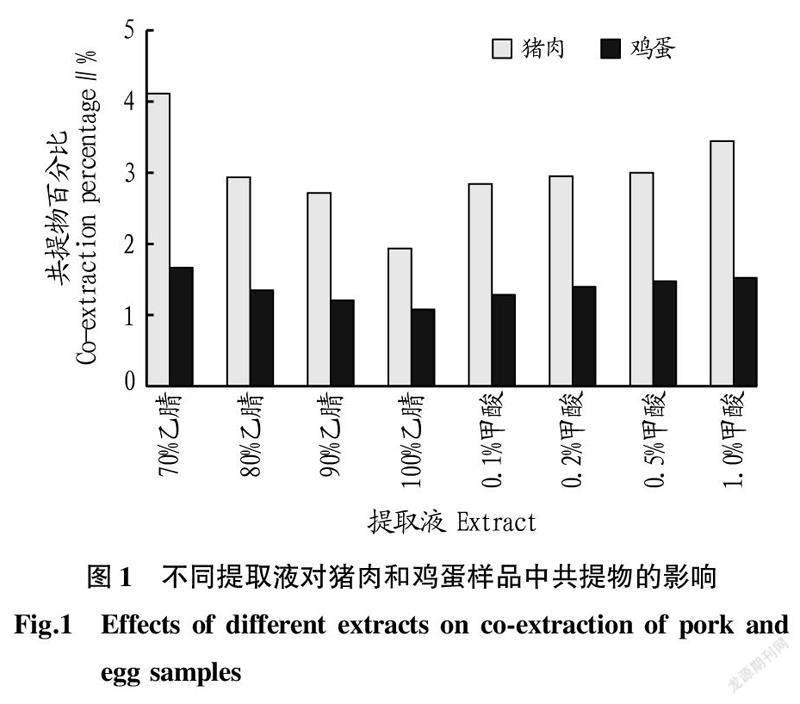
2.1共提物比较提取过程中难以避免地会将样品中的蛋白质、脂肪等杂质带入提取液,这些杂质对目标物的响应信号会产生一定的基质效应,对仪器也会造成污染。通过重量分析法测定提取液中共提物的重量,来比较不同比例的乙腈和甲酸可能带来的杂质。
从猪肉和鸡蛋样品在70%、80%、90%、100%乙腈以及0.1%、0.2%、0.5%、1.0%甲酸含量的条件下共提物百分比的變化(图1)可以看出,在猪肉样品中,乙腈比例由70%升至100%,共提物百分比从4.11%降至1.94%;甲酸比例由0.1%升至1.0%,共提物百分比从2.84%升至3.44%。在鸡蛋样品中,乙腈比例由70%升至100%,共提物百分比从1.67%降至1.08%;甲酸比例由0.1%升至1.0%,共提物百分比从1.29%升至1.52%。
乙腈具有良好的沉淀蛋白质的作用。通过试验发现,猪肉样品在100%乙腈中结块现象严重,不利于样品在提取液中的分散。酸性条件下样品本身的溶出物也会受到影响,在该试验条件下,随着酸性增强,溶出物增多,共提物增加。但酸性条件可能会促使质子化的兽药与样品基质的吸附作用减弱,利于药物释放。因此考察90%乙腈溶液条件下不同兽药残留物的回收率。
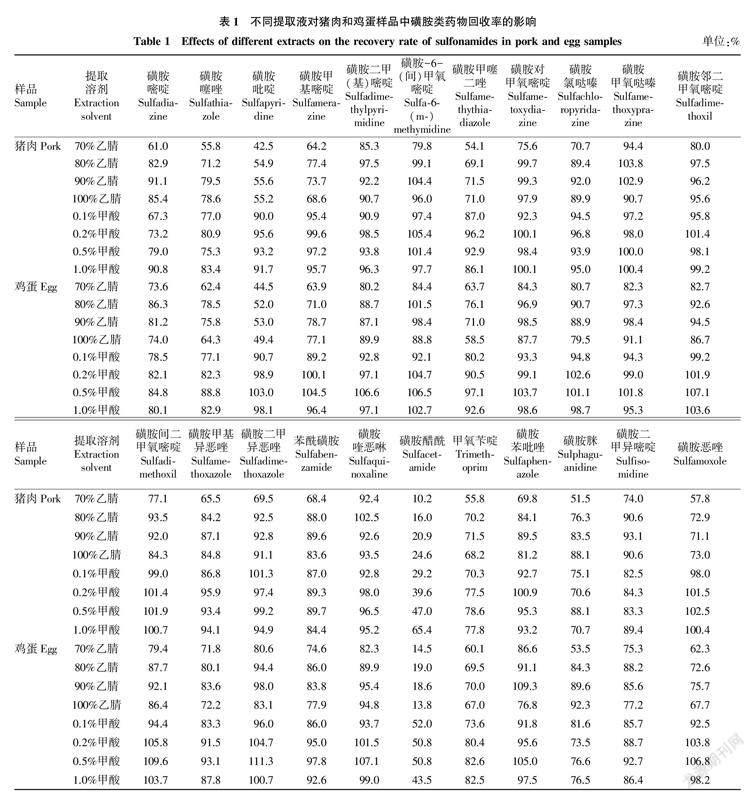
2.2对磺胺类兽药回收率的影响磺胺类药物具有较高的极性,易溶于极性有溶剂,除磺胺脒呈碱性,其他多为酸碱两性物质,在酸性条件下更易溶于有机相中。不同含量乙腈和甲酸对猪肉中磺胺类药物回收率的影响见表1。整体而言,除去磺胺吡啶和磺胺醋酰,80%、90%、100%乙腈和0.1%、0.2%、0.5%、1.0%甲酸(乙腈∶水=9∶1,v/v)作为提取液均能满足回收率要求,10 μg/kg的加标量回收率均在60%~120%。相较于90%乙腈,提取液中加入一定量的甲酸,能够显著提高磺胺吡啶、磺胺甲基嘧啶、磺胺甲噻二唑、磺胺恶唑的回收率。对于磺胺醋酰,回收率比较低,1.0%甲酸-90%乙腈溶液可将回收率提高至65.4%。
在鸡蛋样品中,除去磺胺吡啶和磺胺醋酰,80%、90%乙腈和0.1%、0.2%、0.5%、1.0%甲酸作为提取液均能满足回收率要求,10 μg/kg的加标量回收率均在60%~120%。磺胺甲噻二唑在100%乙腈作为提取溶液时,回收率下降至58.5%。相较于90%乙腈,提取液中加入一定量的甲酸,能够显著提高磺胺吡啶、磺胺甲基嘧啶、磺胺甲噻二唑、磺胺醋酰、磺胺恶唑的回收率。结合共提物百分比,0.1%甲酸-90%乙腈水溶液或0.5%甲酸-90%乙腈水溶液较适合猪肉和鸡蛋22种磺胺类药物的提取。
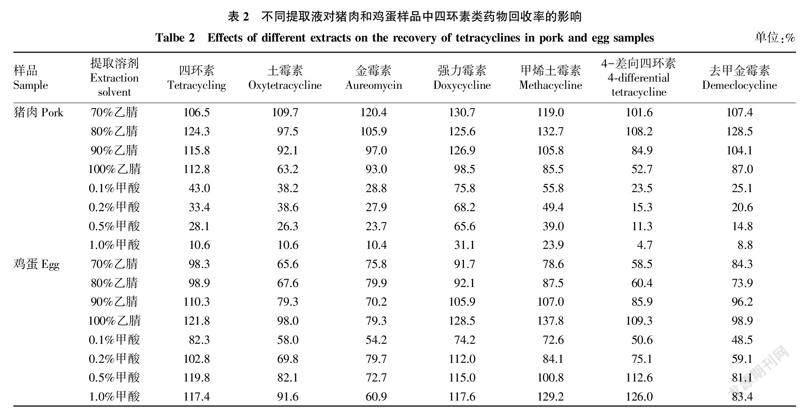
2.3对四环素类兽药回收率的影响四环素类药物含有若干亲水的羟基,易溶于水,在中性和酸性溶液中较稳定。表2显示了不同含量乙腈和甲酸对猪肉中四环素类药物回收率的影响。从整体趋势而言,随着乙腈和甲酸含量的增加,四环素类药物回收率逐渐降低。70%、80%乙腈时,四环素类药物回收率明显偏高,可能存在基质增强作用。在鸡蛋样品中,四环素、土霉素、强力霉素、甲烯土霉素、4-差向四环素随着乙腈含量的增加回收率升高,在90%乙腈溶液中,随着甲酸含量的升高,回收率升高。相同的提取液对猪肉和鸡蛋2种不同基质进行提取时,呈现出了2种不同的回收率趋势。庞国芳等[3]采用pH 3.0~5.5的提取液对蜂蜜中的四环素类药物进行回收率试验时,发现在pH 3.0~5.0时四环素类药物回收率呈先增大后降低的趋势。可见,提取液酸度对四环素类药物回收率的影响是比较复杂的。除样品性状对提取效率的影响,基质效应也是很大的影响因素。从试验数据上看,90%乙腈溶液较适合猪肉和鸡蛋7种四环素类药物的提取。
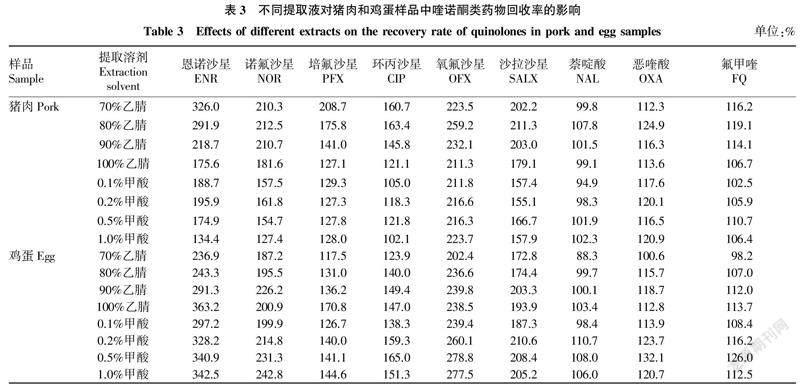
2.4对喹诺酮类兽药回收率的影响在猪肉和鸡蛋样品中,恩诺沙星、诺氟沙星、氧氟沙星、沙拉沙星回收率均在150%以上,说明存在明显的基质增强作用,不同含量的乙腈和甲酸对萘啶酸、恶喹酸、氟甲喹的回收率影响不明显,具体见表3。庞国芳等[3]采用1%乙酸-乙腈溶液和乙腈进行鳗鱼及其制品中喹诺酮类药物的提取效率比较,发现这2种溶液在提取效率上无明显差异。
3结论与讨论
该研究探索了不同乙腈、甲酸含量对猪肉、鸡蛋中常见的磺胺类、四环素类、喹诺酮类兽药回收率的影响,结果发现增加乙腈比例和降低甲酸含量可以减少共提取百分比,但100%乙腈容易造成结块,建议采用90%乙腈溶液作为提取液。酸化的乙腈溶液利于磺胺类药物的提取,90%乙腈利于四环素类药物的提取,对喹诺酮类药物回收率影响不明显,但对部分喹诺酮类药物具有明显的基质增强作用。猪肉样品中酸化乙腈降低四环素类药物的回收率,但能提高鸡蛋样品中四环素的回收率。
不同种类的兽药在提取时对乙腈和甲酸最适含量要求有差异,在选择提取条件时,应根据检测需求选择合适的提取溶液。另外,在液质联用技术中,回收率不仅与提取效率相关,受基质作用影响也很大,需要进一步净化或基质配标等手段以准确定量。从仪器维护保养角度,需要必要的净化措施去除提取液中的共提物。而进一步的净化能够消除一定的基质作用,使得最终的回收率也出现变化。
参考文献
[1] DASENAKI M E,THOMAIDIS N S.Multi-residue determination of 115 veterinary drugs and pharmaceutical residues in milk powder,butter,fish tissue and eggs using liquid chromatography-tandem mass spectrometry [J].Analytica chimica acta,2015,880:103-121.
[2] ORTELLI D,SPRRI A S,EDDER P.Veterinary drug residue in food of animal origin in Switzerland:A health concern? [J].Chimia,2018,72(10):713-717.
[3] 庞国芳.兽药多组分残留分析技术[M].北京:科学出版社,2016.
[4] 周炜,陈慧华,应永飞,等.高效液相色谱-四级杆/线性离子阱质谱法筛查兽药中非法添加物的研究[J].中国兽药杂志,2014,48(4):24-28.
[5] 张科明,梁飞燕,邓鸣,等.QuEChERS结合液相色谱-串联质谱法快速测定猪肉中多类兽药残留[J].色谱,2016,34(9):860-867.
[6] MANIMEKALAI M,RAWSON A,SENGAR A S,et al.Development,optimization,and validation of methods for quantification of veterinary drug residues in complex food matrices using liquid-chromatography:A review[J].Food analytical methods,2019,12(8):1823-1837.
[7] SCHNEIDER M J,LEHOTAY S J,LIGHTFIELD A R.Evaluation of a multi-class,multi-residue liquid chromatography-tandem mass spectrometry method for analysis of 120 veterinary drugs in bovine kidney [J].Drug testing and analysis,2012,4(S1):91-102.
[8] CHEN J,WEI Z,CAO X Y.QuEChERS pretreatment combined with ultra-performance liquid chromatography-tandem mass spectrometry for the determination of four veterinary drug residues in marine products[J].Food analytical methods,2019,12(5):1055-1066.
[9] 方志娟,葉湖,王伟,等.4种不同净化方法在猪肉兽药残留检测中的应用比较研究[J].食品安全质量检测学报,2021,12(19):7637-7645.
[10] 李锋格,苏敏,李晓岩,等.分散固相萃取-超高效液相色谱-串联质谱法测定鸡肝中磺胺类、喹诺酮类和苯并咪唑类药物及其代谢物的残留量[J].色谱,2011,29(2):120-125.
[11] 方从容,高洁,王雨昕,等.QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中125种兽药残留[J].色谱,2018,36(11):1119-1131.
[12] 尹志强.动物源性食品中多族药物高通量筛查确证技术研究[D].北京:中国农业科学院,2017.
[13] 李文杰,倪建秀,丁春晖,等.QuEChERS-UPLC-MS/MS法同时测定青虾中27种兽药残留[J].安徽农业科学,2021,49(24):197-200,212.
[14] 王杰,裴斐,李彭,等.不同前处理方法对猪组织中喹诺酮类兽药残留检测效果对比[J].食品科学,2018,39(18):309-314.
[15] ANUMOL T,LEHOTAY S J,STEVENS J,et al.Comparison of veterinary drug residue results in animal tissues by ultrahigh-performance liquid chromatography coupled to triple quadrupole or quadrupole-time-of-flight tandem mass spectrometry after different sample preparation methods,including use of a commercial lipid removal product[J].Analytical and bioanalytical chemistry,2017,409(10):2639-2653.

