Pik3ip1通过抑制PI3K/AKT/mTOR信号通路促进牛MDSCs分化
严云勤,滕怀昕,佟慧丽,李树峰,李 爽
(东北农业大学细胞与发育生物学实验室,哈尔滨 150030)
骨骼肌是人体重要器官,其强大的再生能力依赖于骨骼肌卫星细胞。肌肉卫星细胞是位于肌纤维膜和基底膜之间的肌源性干细胞[1]。在正常生理条件下,肌肉卫星细胞处于静息状态。当受到生理刺激时,如体育锻炼、急性肌肉损伤或病理条件等,静息的肌肉卫星细胞被激活,发生增殖、迁移、分化、融合等行为,形成新的多核肌管进而形成肌纤维[2]。其中转录调节因子家族(Muscle regulatory factors,MRFs)对细胞分化至关重要,肌细胞生成素(Myogenin,MyoG)基因[3],一种转录因子家族成员,在肌肉卫星细胞分化早期表达。肌球蛋白重链(Myosin heavy chain,MHC)是细胞终末分化标志基因,是骨骼肌发育关键调节因子[4]。
PI3K、Wnt、Notch 及许多信号通路均影响骨骼肌发育[5]。PI3K/AKT/mTOR信号通路是调控骨骼肌分化的重要信号转导通路,参与肌肉生长发育、蛋白质合成、稳态维持等生物学过程[6]。磷脂酰肌醇3激酶(PI3K)是组成磷脂酰肌醇激酶的重要组分,PI3K由两部分组成:调节亚基p85和催化亚基p110,调节亚基p85具有SH2和SH3结构域。蛋白激酶B(PKB,即AKT)是PI3K 主要下游靶点,AKT 磷酸化从而激活PI3K/AKT 信号通路[7]。已有研究表明,PI3K/AKT 信号通路促进肌肉卫星细胞增殖,抑制该途径后促使肌肉卫星细胞相互融合进而分化[8]。
PI3K相互作用蛋白1(Pik3ip1)被认为是一种与PI3K 调 节 亚 基p85 同 源 的 跨 膜 蛋 白[9]。Pik3ip1 是PI3K负调控因子,Li等研究表明,Pik3ip1在C2C12细胞分化过程中表达升高,促进C2C12 细胞分化[10]。新生大鼠细胞免疫共沉淀结果显示Pik3ip1与心肌细胞中p110 亚单位相互作用,Pik3ip1 敲低35%即可诱导心脏肥大[11]。Song等表明Pik3ip1缺陷导致PI3K/AKT/mTOR 信号通路激活,蛋白质合成增加,细胞变大。腺病毒介导的Pik3ip1 过度表达可减轻PI3K 介导的心肌肥大[12]。PI3K/AKT/mTOR信号通路在细胞增殖中发挥重要作用[13]。
本研究旨在探讨Pik3ip1 在牛MDSCs 分化过程中的表达,进一步将CRISPR/Cas9技术应用于上调和下调Pik3ip1表达,以探究Pik3ip1对牛MDSCs分化的影响,依赖Pik3ip1 与p110α 相互作用,并通过PI3K/AKT/mTOR 信号通路影响牛MDSCs 分化,为提高牛肉品质提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用牛骨骼肌取自新生犊牛后腿部肌肉,在无菌条件下分离出细胞,培养出的细胞在液氮中冻存备用。
1.2 主要试剂
大肠杆菌(E.coli)DH5α 购自南京诺唯赞生物科技有限公司;pSPg-RNA、SP-dCas9-VPR、SPdCas9质粒购自美国Addgene公司。高糖DMEM 培养液、opti-MEM 购自Gibco 公司;胎牛血清、马血清、青霉素、链霉素购自Biological Industries 公司;胶原酶Ⅰ、胰蛋白酶、DMSO 构自Sigma 公司;PEI 转染试剂购自Yeasen Biotechnology 公司(40816ES02);去内毒素质粒提取试剂盒购自OMEGA 公司;BbsⅠ、T4DNA Ligase 内切酶购自NEB 公司;抗荧光猝灭封片剂、RIPA 裂解液、DAPI、免疫沉淀兔IgG抗体购自碧云天生物技术公司;胶回收试剂盒购自北京全式金生物技术有限公司(EG101-01);兔源GAPDH 抗体购自Abcam公司(ab9485);兔源MyoG 抗体购自Santa Cruz 公司(SC-52903),兔源p110α 抗体、辣根过氧化物酶标记的羊抗兔IgG、FITC的羊抗兔荧光二抗购自北京Bioss 公司;兔源MHC 抗体购自Proteintech公司;Co-IP 实验所用磁珠购自美国MCE 公司(HY-K0202);PVDF 膜(0.45 μm)购自Millipore Corporation 公司;25 mL 细胞培养瓶、六孔细胞培养板购自NEST 公司;引物序列合成、基因测序由上海生工生物工程有限公司完成。
1.3 细胞分离、培养及分化
本研究中使用的细胞是从新生犊牛(n=3)腿部肌肉中分离获得。将获得的腿部肌肉在无菌操作台中剪成肉糜状,用0.1%胶原酶Ⅰ和0.25%胰蛋白酶处理消化,采用差速贴壁方法纯化牛MDSCs。将上述分离获得的牛MDSCs 用10%FBS 的DMEM 培养基于37 ℃、5%CO2恒温培养箱中培养。细胞密度达到60%~70%后进行传代,用0.1%胰蛋白酶消化,接种到六孔板中。培养24 h后,细胞密度达到70%,用于细胞分化或细胞转染。分化时,使用含2%马血清的DMEM培养基诱导分化。
1.4 激活和抑制Pik3ip1
针对Pik3ip1(NCBI 基因ID:512082)基因,设计三个靶向Pik3ip1 启动子预测区的sgRNAs 序列,每个靶序列5′端添加BbsⅠ酶切位点“CACC”,合成后对其进行退火并连接到pSPgRNA 表达载体,并将表达载体命名为pSPgRNA-P1、pSPgRNA-P2、pSPgRNA-P3。
转染前,将牛MDSCs 接种到六孔板中。当贴壁细胞密度达到约70%时,将三个sgRNA 载体和2 μg SP-dCas9-VPR质粒共转染至牛MDSCs以激活Pik3ip1 基因表达,或将三个sgRNA 载体和2 μg SP-dCas9质粒共转染,抑制Pik3ip1基因表达。
1.5 免疫荧光
将牛MDSCs于4 ℃下冷甲醇中固定20 min,去除冷甲醇,用PBST(含0.5%Triton X-100的PBS)洗涤3 次。细胞在37 ℃下与封闭溶液(含5%BSA 的PBST)孵育60 min。将细胞在4 ℃下用Pik3ip1 一抗(1∶100)或结蛋白一抗(1∶50)孵育过夜。在一抗孵育过后,PBST 摇床清洗细胞3 次,每次5 min,然后用FITC 标记的二抗在37 ℃下孵育1 h,滴加二抗后的所有步骤均需在避光条件下进行。二抗孵育完成后,PBST 摇床清洗细胞3 次,每次5 min。最后,在室温下用DAPI 染色3~5 min,用PBST摇床清洗细胞3次,每次3 min,然后采集图像。
1.6 免疫印迹检测蛋白含量
将含有蛋白酶抑制剂的RIPA 裂解液滴入细胞中进行裂解,收取细胞总蛋白。使用BCA 蛋白质测定法测定蛋白质浓度。SDS-PAGE凝胶电泳用于蛋白质分离,在冰浴条件下将目的蛋白转移至PVDF膜。用5%脱脂奶粉37 ℃封闭1 h,在4 ℃条件下一抗孵育过夜。一抗包括Pik3ip1(1∶500)、MyoG(1∶500)、MHC(1∶1 000)和GAPDH(1∶1 000)。一抗孵育完成后,PBST 摇床清洗4 次,每次5 min。随后,将膜与HRP标记的二抗(1∶2 000)在37 ℃下孵育1 h,用PBST 摇床清洗4 次,每次5 min。使用Super ECL Plus 检测试剂盒检测目的蛋白,用化学发光成像获得图像,分析系统为Minichemi Sagecreation 发光成像系统。最后,使用Image J软件分析条带。
1.7 免疫共沉淀
将牛MDSCs 诱导分化48 h,PBS洗涤2次。含有蛋白酶抑制剂的RIPA 裂解液裂解细胞,取出100 μL 蛋白裂解物作为阳性对照,将剩余蛋白裂解物平分。用p110α(2 μg)抗体和Protein A/G 磁珠结合形成抗体-磁珠复合体。用兔IgG抗体(2 μg)和Protein A/G 磁珠作为阴性对照,在4 ℃下摇床2 h。然后将样品12 880 r·min-1,10 min 在4 ℃下离心,去除抗体,样品加入磁珠,形成抗原-抗体-磁珠复合体,在4 ℃下摇床孵育2 h。最后加入SDS上样缓冲液,煮沸样品以洗脱结合蛋白,进行Western blot检验。Pik3ip1免疫沉淀方法同上。
1.8 统计分析
所有结果均以平均值±标准差表示。从独立实验中选择具有代表性的免疫蛋白印迹,当数据接近正态分布时,两组之间使用t 检验统计评估。NS:无显著性差异,*P<0.05 代表显著性差异,**P<0.01 代表极显著性差异,被认为具有统计学显著性。使用Prism软件分析所有统计测试。
2 结果与分析
2.1 Pik3ip1在牛MDSCs分化过程中的表达
利用免疫荧光和Western blot 检测Pik3ip1在牛MDSCs 分化过程中的表达。诱导牛MDSCs 分化,于分化第0、1、3和5天固定细胞,进行免疫荧光染色,结果如图1A所示,当牛MDSCs在增殖培养基(0 d)中培养时,无肌管形成,Pik3ip1 特异荧光非常弱。随分化天数增加,细胞逐渐融合形成肌管,Pik3ip1 荧光强度逐渐增强。使用Western blot检测Pik3ip1在牛MDSCs 分化过程中的表达。随分化天数增加,Pik3ip1表达(见图1B和1C)及肌分化标志基因MyoG和MHC表达均显著升高(见图1D和1E)。结果表明,Pik3ip1 表达随牛MDSCs 分化而增加。
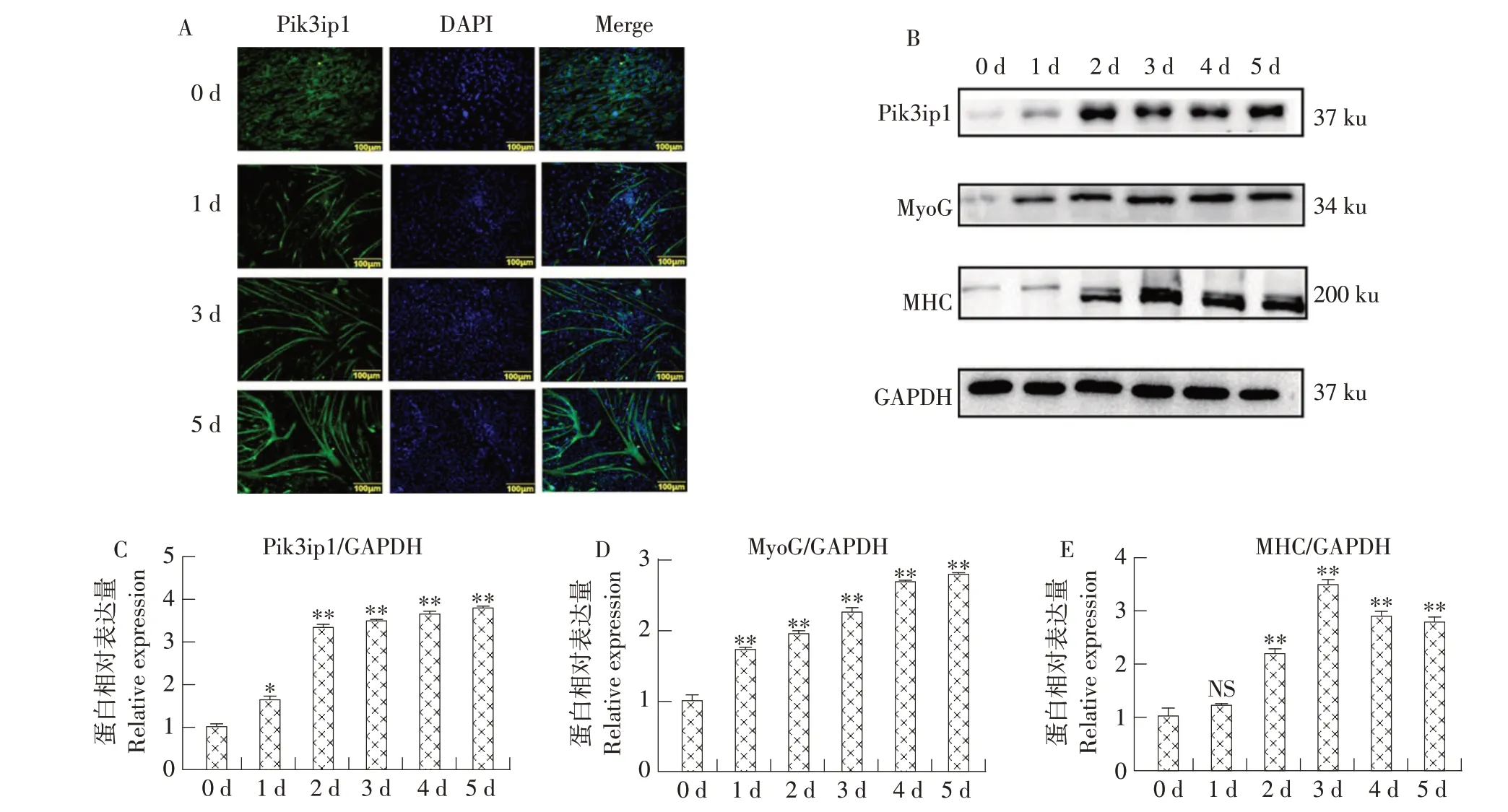
图1 Pik3ip1在牛MDSCs分化过程中的表达Fig.1 Expression of Pik3ip1 during bovine MDSCs differentiation
2.2 Pik3ip1对牛MDSCs分化的影响
2.2.1 激活Pik3ip1对牛MDSCs分化的影响
为研究Pik3ip1 对牛MDSCs 分化的影响,使用CRISPR/dCas9 方法激活Pik3ip1 表达。首先,构建靶向Pik3ip1启动子的sgRNA载体。将重组后sgRNA载体与SP-dCas9-VPR载体共转染牛MDSCs,分化培养48 h。利用Western blot 检测选择Pik3ip1 激活后表达效果最好的载体。对照组为sgRNA 空载与SP-dCas9-VPR 载体共转染牛MDSCs,与对照组相比pSPgRNA-P3 组具有最显著的激活效果(见图2A和2B)。因此,选择pSPgRNA-P3用于后续相关试验。
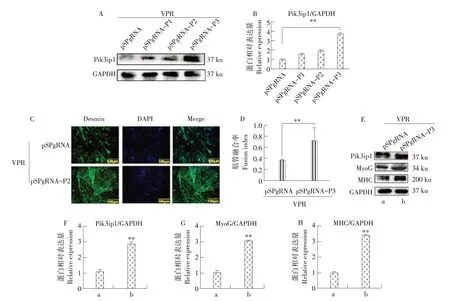
图2 激活Pik3ip1对牛MDSCs分化的影响Fig.2 Activation of Pik3ip1 affectted differentiation of bovine MDSCs
将对照组sgRNA载体和pSPgRNA-P3载体分别与SP-dCas9-VPR 载体共转染,转染后分化48 h。免疫荧光和免疫印迹法检测细胞分化情况。免疫荧光结果表明,Pik3ip1 被激活后,肌管数量显著增加(见图2C),肌管融合率提高42.32%,差异极显著(见图2D)。激活Pik3ip1 后,MyoG 和MHC 表达显著增加(见图2E~2H)。上述结果表明,激活Pik3ip1表达促进牛MDSCs分化。
2.2.2 抑制Pik3ip1对牛MDSCs分化的影响
将SP-dCas9 和pSPgRNA 或pSPgRNA-Pn 共转染牛MDSCs,通过Western blot 检测Pik3ip1蛋白表达量,筛选出抑制效果最显著的载体。结果如图3所示,pSPgRNA与SP-dCas9载体共转染牛MDSCs作为对照组,pSPgRNA-P2抑制载体组中Pik3ip1表达显著低于对照组(见图3A 和3B)。因此,选择pSPgRNA-P2抑制载体进行后续相关试验。
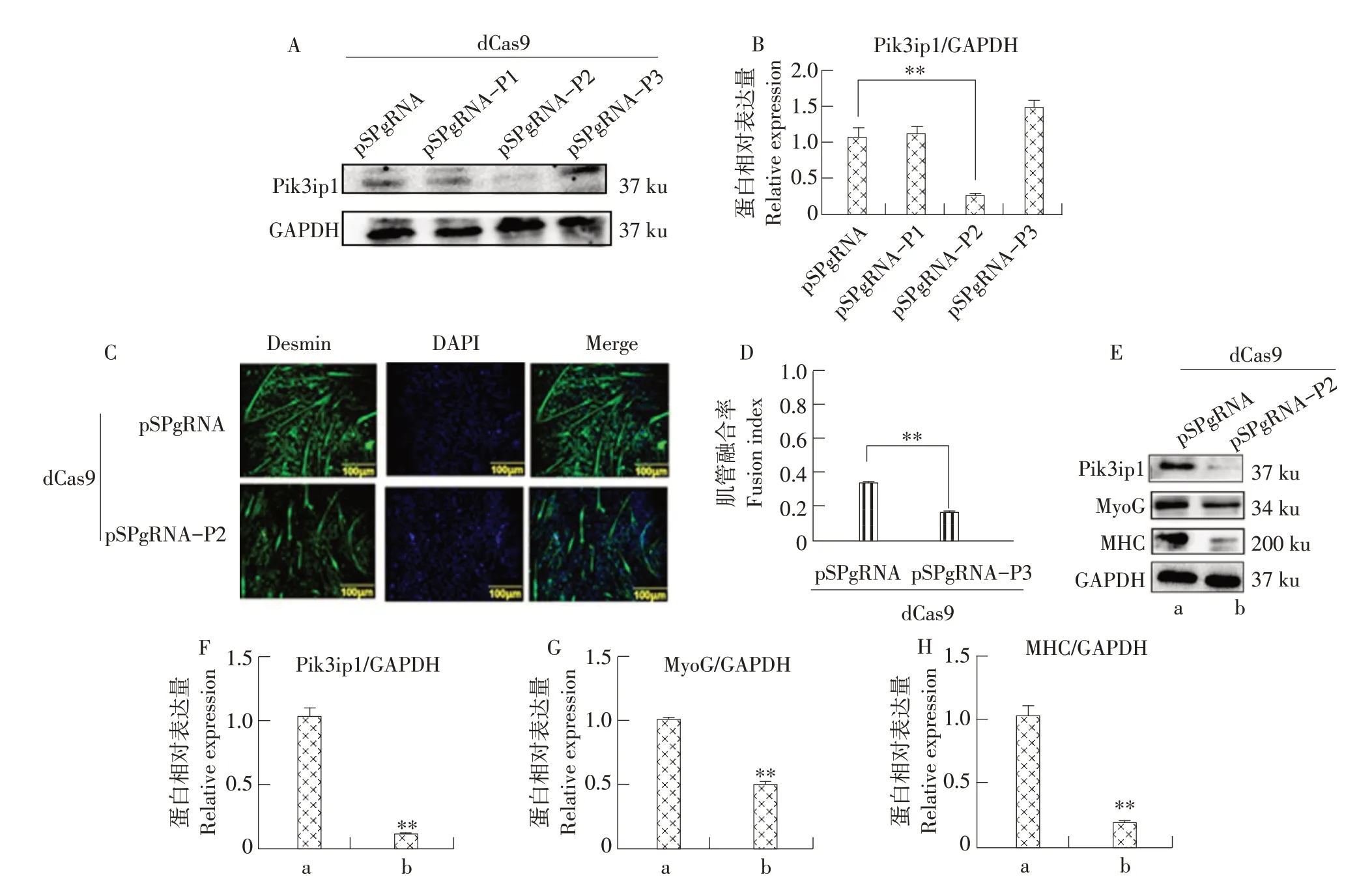
图3 抑制Pik3ip1对牛MDSCs分化的影响Fig.3 Inhibition of Pik3ip1 affectted differentiation of bovine MDSCs
在牛MDSCs 中抑制Pik3ip1 表达,使用免疫荧光和Western blot 检测细胞分化情况。免疫荧光结果显示,抑制Pik3ip1表达后,肌管显著减少(见图3C)。统计结果显示,与对照组相比肌管融合率下降21.67%,差异极显著(见图3D)。Western blot 结果表明,Pik3ip1被抑制后,MyoG和MHC表达显著降低(见图3E~H)。以上结果表明,抑制Pik3ip1的表达导致牛MDSCs分化减少。
2.3 Pik3ip1与p110α相互作用
为进一步明确Pik3ip1 与PI3K 亚单位p110α 之间关系,将牛MDSCs 诱导分化48 h 收集蛋白样品进行免疫共沉淀。用Pik3ip1 抗体和p110α 抗体分别免疫沉淀并进行Western blot 检测,结果显示,使用Pik3ip1 抗体进行免疫沉淀后,收集的样品中可检测出p110α 蛋白(见图4A);使用p110α 抗体进行免疫沉淀后,所得样品中可检测到Pik3ip1 蛋白(见图4B)。表明Pik3ip1在牛MDSCs 分化过程中与p110α蛋白相互作用。
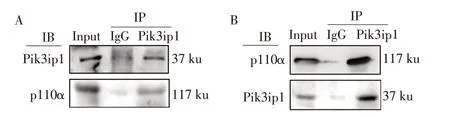
图4 Pik3ip1与p110α在牛MDSCs分化过程中结合Fig.4 Pik3ip1 binds to p110α during bovine MDSCs differentiation
2.4 Pik3ip1通过PI3K/AKT/mTOR信号通路影响牛MDSCs的分化
为研究Pik3ip1与PI3K/AKT/mTOR 信号通路对肌肉分化的影响,本试验激活或抑制Pik3ip1 后诱导牛MDSCs分化48 h,Western blot检测PI3K、AKT和mTOR 磷酸化状态以及分化标志基因MyoG 和MHC 表达。结果如图5 所示,当Pik3ip1 被激活,信号通路中PI3K、AKT 和mTOR 磷酸化水平显著降低(见图5A~E),MyoG和MHC表达量均增加(见图5F 和G),表明激活Pik3ip1 使PI3K/AKT/mTOR信号通路被抑制,促进牛MDSCs分化。
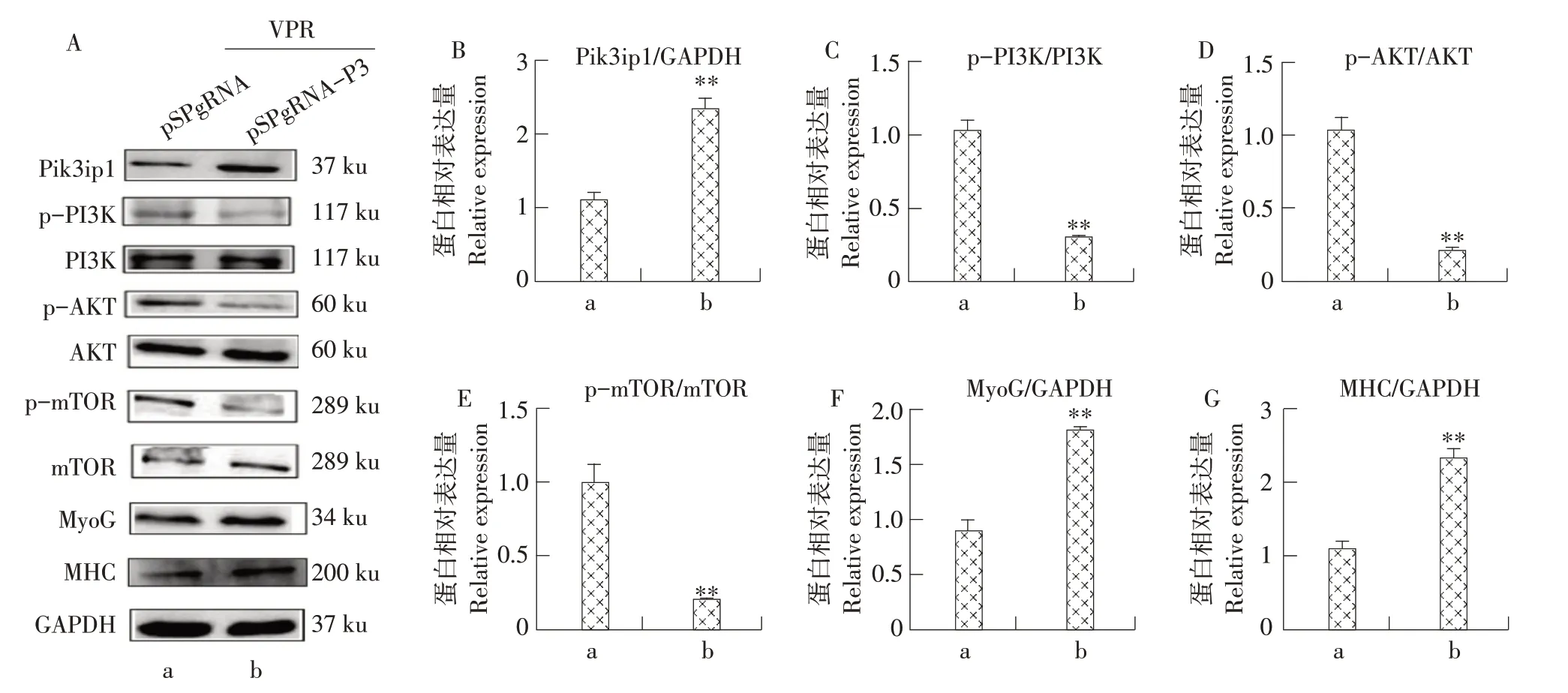
图5 激活Pik3ip1对PI3K/AKT/mTOR信号通路及牛MDSCs分化的影响Fig.5 Activation of Pik3ip1 affectted PI3K/AKT/mTOR signaling pathway and bovine MDSCs differentiation
相反,当Pik3ip1 表达受到抑制,PI3K、AKT和mTOR 磷酸化水平升高(见图6A~E),MyoG 和MHC 表达量均显著增加(见图6F 和G)。研究结果表明,Pik3ip1通过抑制PI3K/AKT/mTOR 信号通路促进牛MDSCs分化。
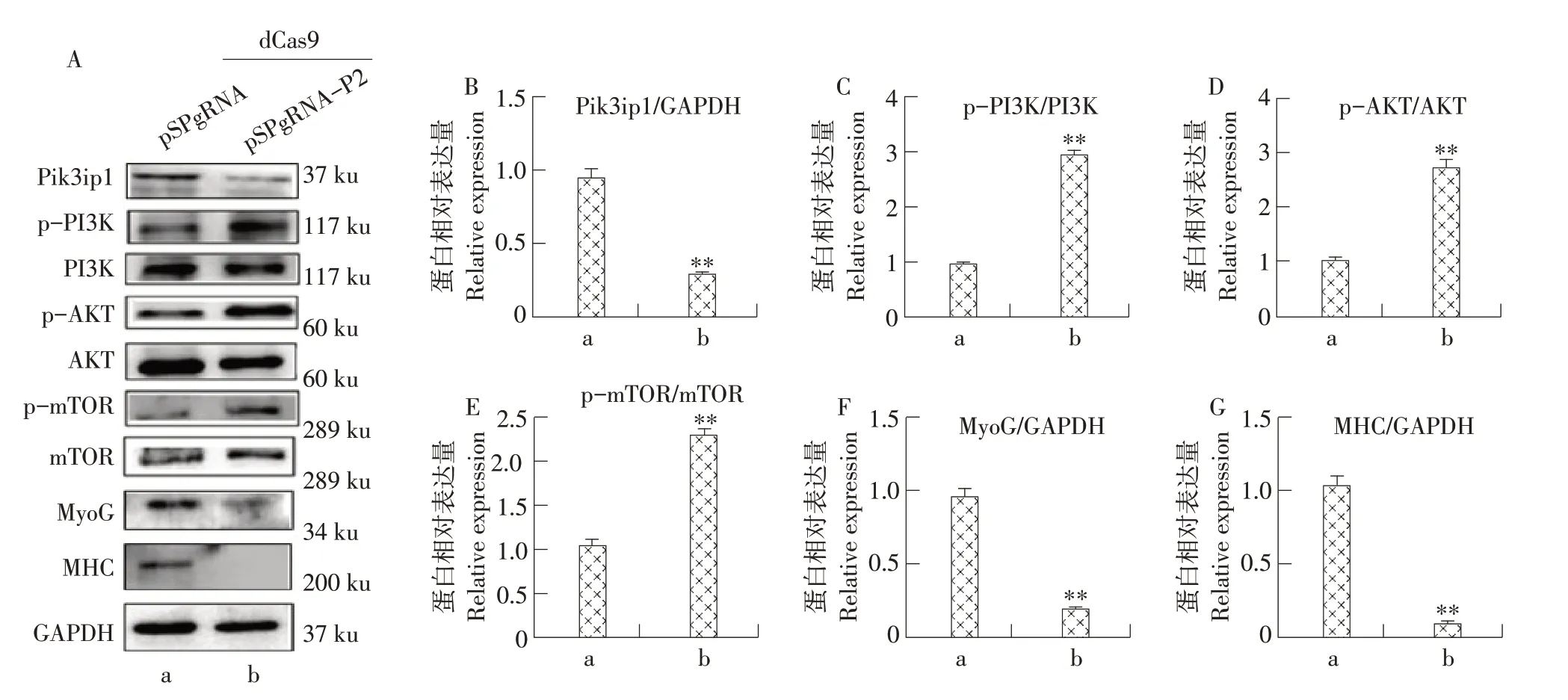
图6 抑制Pik3ip1对PI3K/AKT/mTOR信号通路及牛MDSCs分化的影响Fig.6 Inhibition of Pik3ip1 affectted PI3K/AKT/mTOR signaling pathway and bovine MDSCs differentiation
3 讨 论
本研究首次描述Pik3ip1作为牛MDSCs 分化负调控因子的功能及表达。本试验室前期研究结果表明,牛MDSCs 分化中RNA 高通量测序结果显示,分化 第3 天牛MDSCs 中Pik3ip1 的mRNA 水平显著高于未分化牛MDSCs 的mRNA 表达[14]。因此,推测Pik3ip1与牛MDSCs 分化密切相关。为明确Pik3ip1对牛MDSCs 分化的影响,本研究分离牛MDSCs 并诱导分化,结果显示,Pik3ip1 蛋白随牛MDSCs 分化过程表达增加。表明Pik3ip1 与牛MDSCs 分化存在一定关联。与Li 等发现Pik3ip1 随小鼠C2C12细胞分化表达增加的研究结果相似[10]。
为明确Pik3ip1对牛MDSCs 分化的影响,采用CRISPR/dCas9 系统达到调控Pik3ip1 表达目的,根据前期研究该系统可有效激活或抑制基因表达[15]。结果表明转染Pik3ip1 表达载体后,Pik3ip1 表达可被体外激活或抑制。表达载体的成功构建为后续试验提供参考。此外,激活Pik3ip1 促进牛MDSCs分化,抑制该基因后分化程度降低,说明Pik3ip1正向调控牛MDSCs 分化,在牛MDSCs 发育过程中发挥重要作用。
研究表明,Pik3ip1 通过其细胞内p85 结构域与PI3K的p110催化亚单位结合,下调人类肝癌细胞和小鼠心肌细胞中PI3K 活性,抑制AKT 活性[16-17]。免疫共沉淀结果显示,Pik3ip1在牛MDSCs分化过程中与p110α相互作用,与其他物种细胞中Pik3ip1 研 究 结 果 一 致。Pik3ip1 在 牛MDSCs 中 对PI3K/AKT/mTOR 信号通路的调控作用目前尚无相关研究,本研究通过激活和抑制Pik3ip1 表达,发现Pik3ip1对PI3K/AKT/mTOR 信号通路发挥负向调控作用。PI3K/AKT/mTOR 信号通路是最重要的细胞内途径之一,在细胞增殖、黏附、迁移、蛋白质合成以及细胞存活过程中发挥关键作用,同样可被视为癌症主要调节因子[18]。PI3K/AKT/mTOR信号通路上调,在肌肉发育过程中促进C2C12 细胞增殖且抑制分化[10];Oh 等研究表明,韭菜中分离的化合物可促进小鼠骨骼肌生长分化并上调PI3K/AKT/mTOR 信 号 通 路[19],PI3K/AKT/mTOR 信号通路在骨骼肌细胞分化过程中的作用目前存在争议。然而,该信号通路对牛MDSCs分化的影响尚不清楚。激活Pik3ip1 表达后,抑制PI3K/AKT/mTOR信号通路并促进牛MDSCs分化,反之亦然。本研究推测PI3K/AKT/mTOR 信号通路可能抑制牛MDSCs分化过程,这与C2C12 细胞在骨骼肌发育过程中部分结论一致。为进一步探讨PI3K/AKT/mTOR 信号通路在牛MDSCs 发育中功能,需在后续试验中添加信号通路激活剂或抑制剂深入研究。
本研究表明,Pik3ip1通过抑制PI3K/AKT/mTOR信号通路,促进牛MDSCs 分化。本研究加深对肌肉发育机制的了解,为改善牛肉品质提供新视角。
4 结 论
本研究发现Pik3ip1和PI3K/AKT/mTOR 信号通路在牛MDSCs 分化过程中发挥重要作用。Pik3ip1通过抑制PI3K/AKT/mTOR 信号通路促进牛MDSCs分化,为今后研究和改善牛肉品质提供理论基础。

