茶香螺烷对草莓灰霉病菌(Botrytis cinerea)抑菌活性研究
张艳菊,程旭楠,刘 东,毛鑫琪,张元一,董良旭,栾信哲,张星哲
(东北农业大学农学院,哈尔滨 150030)
由灰葡萄孢(Botrytis cinerea)侵染引起的灰霉病是草莓主要真菌病害,种植期和采后均可发生[1]。尤其在储藏、运输过程中,轻者造成草莓腐烂、品质降低及保存时限缩短,严重时失去营养和商品价值,造成严重经济损失[2-3]。目前,生产上防治草莓灰霉病以化学防治为主[4],但会引起农药残留、环境污染等一系列问题,加重病原菌抗药性,不符合绿色安全要求[5]。因此,开发安全环保、对人类和环境友好的高效杀菌保鲜产品和技术是目前亟待解决的研究课题。
生物熏蒸是植物有机物在分解过程中产生具有杀生性的挥发性气体,抑制或杀灭病原菌的方法。该技术与化学杀菌剂相比可减少化学农药残留,减少环境污染,适合有机蔬菜种植。储运期间应用植物源挥发性物质熏蒸处理果蔬,不直接接触食品,无毒、无害、无残留,安全环保,可提高水果品质,延长保鲜期。芸薹属(Brassica L.)植物分解后产生异硫氰酸酯类化合物,具有高效的生物熏蒸作用,可有效防治植物土传病害,同时改善土壤质量,提高作物产量[6-7]。此外,百里香酚、肉桂醛等植物精油[8]、生防菌挥发气体[9]以及丁香等植物源提取物[10]均具有杀菌活性。本课题组前期研究发现,醉蝶花提取物茶香螺烷对黄瓜、辣椒、番茄和大豆等多种植物土传病菌具有良好熏蒸作用,效果优于十字花科植物。多数采后和田间病害是同一个病原菌,茶香螺烷对采后病害是否具有抑制效果尚无研究报道。
醉蝶花(Cleome spinosa)是白花菜科醉蝶花属植物,除具有观赏价值外,还具有抗菌、镇痛、消炎、驱虫等药理作用[11],Megil 等研究表明,醉蝶花挥发性物质对沙门氏菌(Salmonella spp.)、蜡样芽孢杆菌(Bacillus cereus)、绿脓假单胞菌(Psuedonomas aeruginosa)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、痢疾杆菌(Shigella spp.)具有中等抑菌活性,对化脓性链球菌A组具有显著抑菌活性[12]。醉蝶花在农业上用于防治植物病害的报道较少。本课题组对醉蝶花挥发性物质作鉴定,共鉴定出21 种成分,包括13 种杂环、1 种色烯、1 种酯、1 种酸、1 种醇和4 种长链烷烃[13],研究21 种成分抑菌活性发现,牡丹酚、芳樟醇和茶香螺烷对辣椒疫霉病菌(Phytophthora capsici)、大豆疫霉病菌(Phytophthora sojae)、番茄灰霉病菌(Botrytis cinerea)、小麦雪腐病菌(Gerlachia nivalis)、大豆根腐病菌(Rhizoctonia solani)和腐皮镰孢菌(Fusarium solani)具有良好抑菌活性[14-15]。茶香螺烷又称螺环氧化物,是用途最广泛的高档香料之一,因具有红茶芳香而得名。常用于饮料、化妆品、香烟中,也是调味品香精香源。本课题组前期研究发现,茶香螺烷对尖镰孢菌(Fusarium oxysporum)、疫霉菌(Phytophthora sojae)、葡萄孢菌(Botrytis cinerea)等多种植物土传病菌具有抑菌作用,在此基础上,本文研究茶香螺烷对草莓灰霉病菌的熏蒸及抑菌作用,探讨茶香螺烷对草莓灰霉病菌抑菌效应,可为新型果蔬防腐保鲜剂开发及其机理研究提供借鉴和参考。
1 材料与方法
1.1 材料
草莓灰霉病病原菌(Botrytis cinerea)菌株HRB6,分离自草莓,由东北农业大学植物病理实验室保存。
茶香螺烷为分析纯,购自上海麦克林生化科技有限公司。
1.2 方法
1.2.1 茶香螺烷对草莓灰霉病菌的抑菌活性
1.2.1.1 茶香螺烷对草莓灰霉病菌的熏蒸作用
将适量融化的PDA 培养基加入至培养皿中制成均匀平板,取活化好的草莓灰霉病菌,用直径为0.90 cm 打孔器沿边缘打取菌饼,接种在平板中心,在培养皿盖中心加入10%DMSO溶解的茶香螺烷5 μL。试验设计茶香螺烷浓度分别为200、400、600、800、1 000 μL·L-1,以加入5 μL 10%DMSO 为空白对照,每处理5次重复。用封口膜封口,在26 ℃恒温黑暗条件下倒置培养5 d,采用十字交叉法测量菌落直径,计算抑菌率。通过DPSv 9.01 软件,作药剂浓度与抑菌率之间线性回归分析,将抑菌率转化为机率值(Y),药剂浓度转化为对数(X),求出毒力回归方程Y=A+BX,相关系数R2,并根据方程计算不同药剂浓度对草莓灰霉病菌有效抑制中浓度EC50。
1.2.1.2 茶香螺烷对草莓灰霉病菌的直接抑菌作用
在融化好的50 mL 定量PDA 培养基中分别加入200、400、600、800、1 000 μL·L-1茶香螺烷5 μL。将直径0.90 cm 灰霉病菌菌饼接种在含有不同浓度茶香螺烷PDA 培养基上,每处理5 次重复,用封口膜封口,5 d 后采用十字交叉法测量菌落直径,计算抑菌率。作出毒力回归方程、相关系数R2,计算EC50值。
1.2.2 最小抑菌浓(MIC)与最小杀菌浓度(MBC)测定
采用平板稀释法测定茶香螺烷对草莓灰霉病菌最小抑菌浓度和最小杀菌浓度。在融化的PDA培养基中分别加入茶香螺烷,药剂最终浓度为2、1、0.5、0.25、0.125 和0.0625 μL·mL-1,以加入无菌水为对照。将直径0.90 cm 灰霉病菌菌饼接种于含有药剂PDA 平板上,每处理5 次重复,26 ℃恒温黑暗培养48 h 后观察菌丝生长情况。菌落无生长状态处理的最低浓度为最小抑菌浓度(MIC),继续培养3 d后,菌落无生长状态处理的最低浓度为最小杀菌浓度(MBC)。
1.2.3 茶香螺烷对草莓灰霉病菌菌丝表面结构的影响
在融化的PDA 培养基中加入茶香螺烷,调整至浓度为0.5 μL·mL-1,不含药剂处理为对照。将灰霉病菌菌饼接种在培养基上,26 ℃恒温黑暗培养5 d 后,采用扫描电镜观察菌丝结构。在培养基上取5个取样点,切成2 mm×5 mm小块,放置在2.5%、pH 7.2 戊二醛中固定并置于4 ℃冰箱过夜。用0.1 mol·L-1、pH 7.2 磷酸缓冲液冲洗3 次,每次10 min。分别用浓度50%、70%、90%乙醇脱水各一次,每次10 min;100%乙醇脱水2 次,每次10 min。100%乙醇∶叔丁醇=1∶1;纯叔丁醇各置换一次,每次15 min。放入-20 ℃冰箱冷冻室30 min,冷冻干燥仪对样品干燥4 h。样品表面镀一层金属膜,扫描电子显微镜观察拍照。
1.2.4 茶香螺烷处理草莓灰霉病菌菌丝胞外电导率的测定
无菌水冲洗PDA培养基上培养7 d的草莓灰霉病菌,无菌纱布过滤后得到孢子悬浮液,取100 μL孢子悬浮液加入含有50 mL PDB 培养基的三角瓶中,在26 ℃、180 r·min-1摇床培养48 h,将得到的菌丝过滤后用无菌水清洗。称取0.50 g菌丝,加入到含有5 mL 无菌水离心管中,在管中加入茶香螺烷,使最终浓度为MIC、MBC,以无菌水为对照,在26 ℃、180 r·min-1摇床中培养。处理1、2、3、4 h后分别取上清液测定电导率。
1.2.5 茶香螺烷处理草莓灰霉病菌麦角固醇含量的测定
菌丝获取方式同1.2.4。参考Tian[16]、王江来[17]等测定麦角固醇方法。取一定量菌丝,测量湿重,将25%乙醇KOH 溶液与菌丝充分混合,在85 ℃水浴皂化4 h,冷却至室温,再加入正庚烷剧烈涡旋5 min,放置在室温静置2 h分层。取上层溶液测定230和282 nm处吸光度,根据公式计算麦角固醇含量。
1.2.6 茶香螺烷处理草莓灰霉病菌丙二醛(MDA)含量的测定
采用硫代巴比妥酸比色法测定菌丝中丙二醛(MDA)含量[18]。菌丝获得方式同1.2.4。用液氮将菌丝研磨成粉状,加入4 mL 0.6%TBA 和10%TCA混合溶液,充分混匀后置于沸水浴中水浴20 min,取出后立即冰浴冷却,经4 ℃、10 000 r·min-1离心10 min,取上清液用酶标仪测定450、532和600 nm处吸光值,计算丙二醛(MDA)含量。
1.2.7 茶香螺烷处理对草莓灰霉病菌致病力相关基因表达量的影响
将灰霉菌接种在PDA 培养基中央,26 ℃恒温黑暗培养3 d,再向培养皿盖上加入10%DMSO稀释的茶香螺烷10 μL,药剂最终浓度为0.5 μL·mL-1,以加入10%DMSO 为对照。分别在加入药剂12、24、36、48 h 后,Trizol 法提取菌丝总RNA,反转录获取cDNA(Integrated First-strand cDNA Synthesis Kit),草莓灰霉病菌调控致病力相关基因引物见表1。利用实时荧光定量PCR检测致病力基因BcPDR1、细胞壁降解酶基因Bcpg5 和过氧化物酶基因BccatA 表达量变化。qPCR 反应体系为20 μL:2×Fast qPCR Master Mixture(Green)10 μL,上、下游引物各0.5 μL,cDNA 模版1 μL,DEPCddH2O 8 μL。qPCR 反应程序为:94 ℃预变性2 min,94 ℃变性15 s,56 ℃退火15 s,72 ℃延伸30 s,40次循环,数据采用2-ΔΔCt方法处理。
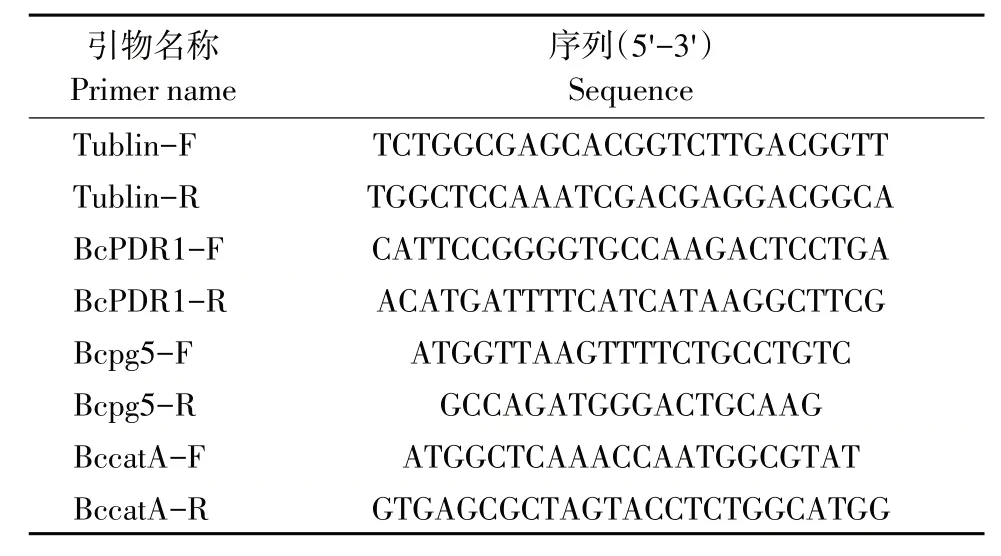
表1 灰葡萄孢内参基因、目的基因引物序列Table 1 Primer sequence of internal reference gene and target gene of Botrytis cinerea
1.3 数据处理与分析
利用Excel 2016 和SPSS 26 软件对数据结果作方差分析,计算毒力回归方程和显著性检验(Duncan法、独立样本t检验,P<0.05具有显著性)。
2 结果与分析
2.1 茶香螺烷对草莓灰霉病菌的抑菌活性
表2为茶香螺烷对草莓灰霉病菌熏蒸及直接抑菌活性。从表中可看出,无论采用熏蒸或直接接触,茶香螺烷对草莓灰霉病菌均有一定抑制作用,随着茶香螺烷浓度增加,其对草莓灰霉病菌抑菌活性逐渐升高。茶香螺烷浓度为1 000 μL·L-1时,熏蒸及直接接触对草莓灰霉病菌抑菌率分别为89.11%和80.95%。茶香螺烷对草莓灰霉病菌熏蒸毒力回归方程为:y=3.4024x+2.6422,EC50为4.93 μL·L-1;直接接触毒力回归方程为:y=2.7148x-2.5372,EC50为597.50 μL·L-1。从抑制中浓度EC50可看出,茶香螺烷处理草莓灰霉病菌的两种方法中熏蒸处理的抑菌活性优于直接接触的抑菌活性。
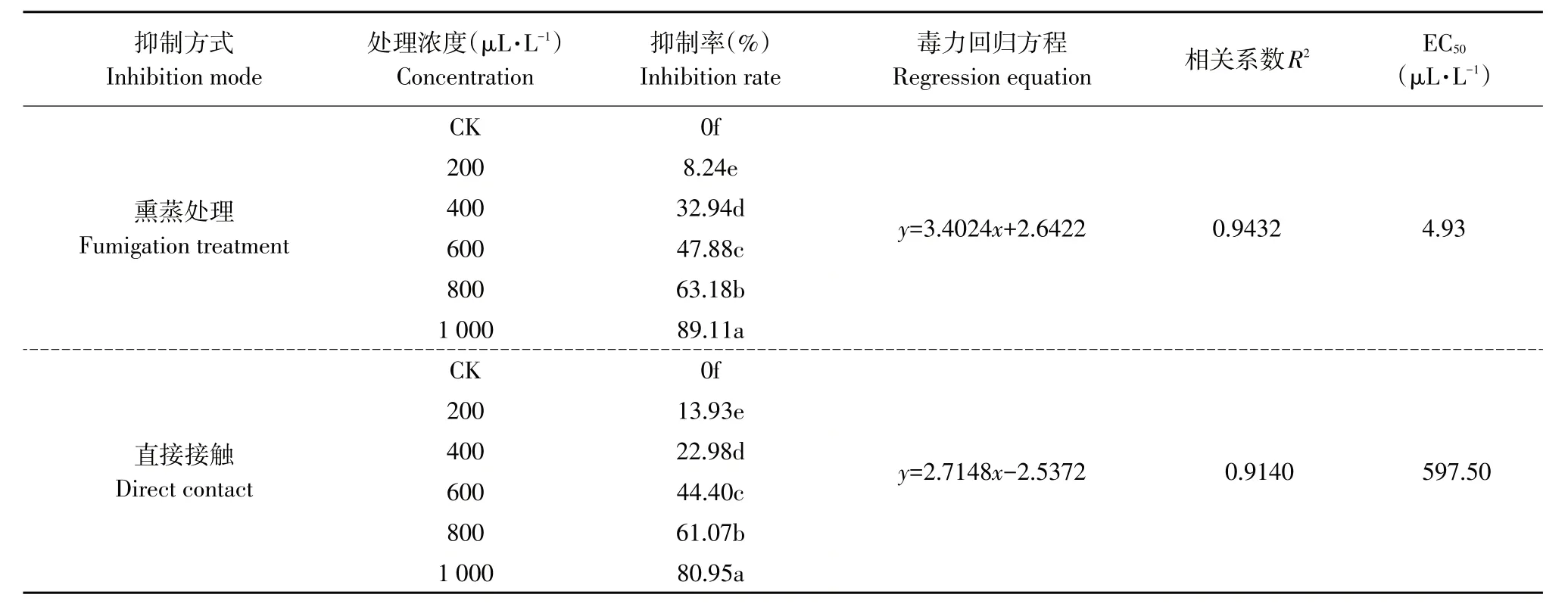
表2 茶香螺烷对草莓灰霉病菌的抑菌活性Table 2 Inhibitory activity of theospirane against Botrytis cinerea in strawberry
2.2 最小抑菌浓度(MIC)与最小杀菌浓度(MBC)
茶香螺烷处理草莓灰霉病菌48 h后,茶香螺烷对草莓灰霉病菌最小抑菌浓度MIC为1.0 μL·mL-1。继续培养3 d后,茶香螺烷在最小抑菌浓度MIC 下菌丝有生长,2.0 μL·mL-1浓度下菌丝无任何生长,为最小杀菌浓度MBC。
2.3 茶香螺烷处理对草莓灰霉病菌菌丝形态的影响
在扫描电镜下观察发现茶香螺烷处理草莓灰霉病菌后菌丝形态与对照相比变化明显。图1A 为正常生长在PDA 培养基上未经处理的草莓灰霉病菌菌丝,菌丝圆润饱满,形态完整,光滑平整,粗细均一;图1B 为茶香螺烷处理后草莓灰霉病菌菌丝形态。图中可观察到茶香螺烷处理后草莓灰霉病菌菌丝受到破坏,表面粗糙,表皮有翘起。

图1 茶香螺烷处理草莓灰霉病菌菌丝变化Fig.1 Change of mycelium surface of Botrytis cinerea in strawberry treated by theospirane
2.4 茶香螺烷处理对草莓灰霉病菌菌丝胞外电导率的影响
图2为茶香螺烷处理草莓灰霉病菌后菌丝胞外电导率变化情况。未经茶香螺烷处理的草莓灰霉病菌0~4 h 电导率几乎无变化。茶香螺烷处理后,电导率明显上升,与茶香螺烷浓度呈正相关。在1 h时,对照组电导率为91.1 μs·cm-1,茶香螺烷最小抑菌浓度MIC 为101.4 μs·cm-1、最小杀菌浓度MBC 为108.4 μs·cm-1。在0~4 h内,茶香螺烷处理组电导率均为上升趋势,4 h 时达到最大值,茶香螺烷MIC、MBC 与对照相比电导率分别升高31.20%和44.66%。

图2 茶香螺烷对草莓灰霉病菌胞外电导率的影响Fig.2 Effects of theospirane on extracellular conductivity of Botrytis cinerea in strawberry
2.5 茶香螺烷处理对草莓灰霉病菌麦角固醇含量的影响
图3为茶香螺烷处理草莓灰霉病菌后菌丝麦角固醇含量变化。从图3可见,草莓灰霉病菌经茶香螺烷处理后麦角固醇含量与未经处理空白对照相比显著降低(P<0.05),且与加入的浓度呈负相关。相比对照在最小抑菌浓度MIC 下麦角固醇合成量降低8.18%,在最小杀菌浓度MBC 下,麦角固醇合成量降低12.58%。
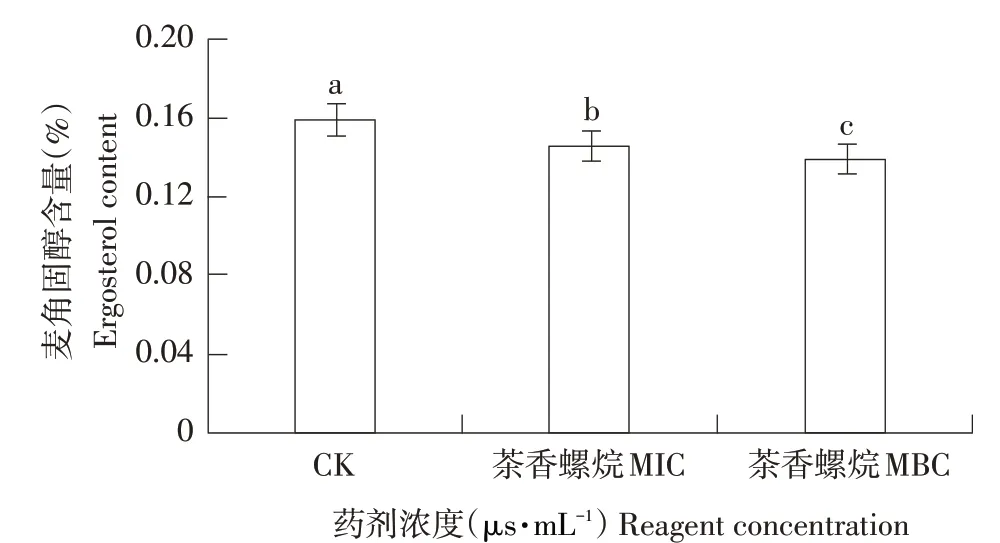
图3 茶香螺烷对草莓灰霉病菌麦角固醇含量的影响Fig.3 Effects of theospirane on ergosterol content ofBotrytis cinerea in strawberry
2.6 茶香螺烷处理对草莓灰霉病菌丙二醛(MDA)含量的影响
由图4 可见,茶香螺烷处理后草莓灰霉病菌菌丝丙二醛含量与未经处理对照丙二醛含量相比显著升高(P<0.05)。空白对照丙二醛含量为0.283 μmol·L-1,相比对照在最小抑菌浓度MIC 下丙二醛含量升高0.335 μmol·L-1,在最小杀菌浓度MBC下,丙二醛含量升高0.373 μmol·L-1。
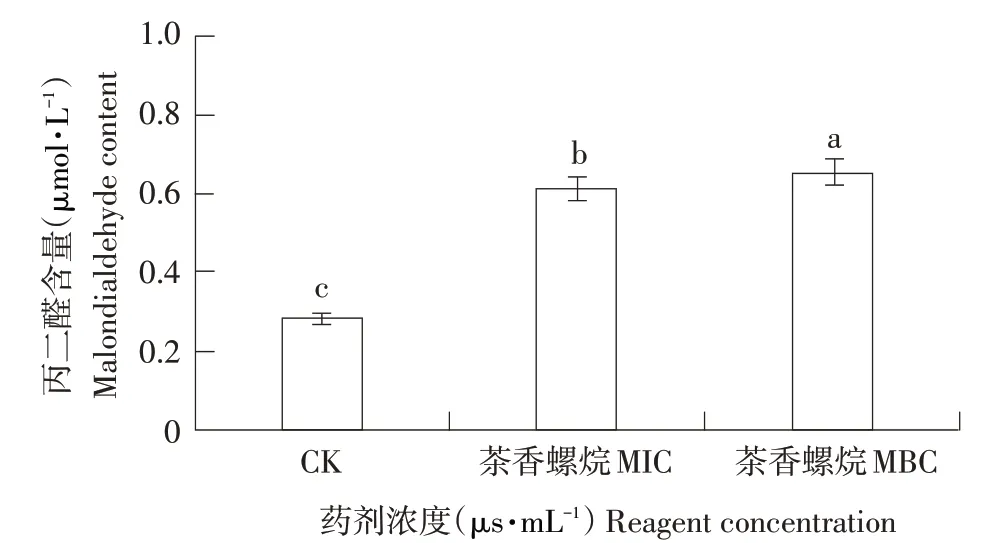
图4 茶香螺烷对草莓灰霉病菌丙二醛含量的影响Fig.4 Effects of theospirane on malondialdehyde content of Botrytis cinerea in strawberry
2.7 茶香螺烷处理对草莓灰霉病菌致病力相关基因表达量的影响
从图5 可看出,茶香螺烷处理不同时间草莓灰霉病菌致病力相关BcPDR1 基因、过氧化物酶BccatA基因和细胞壁降解酶Bcpg5基因表达量与对照相比差异显著。与对照相比,茶香螺烷处理后草莓灰霉病菌BcPDR1基因表达先下调后上升,表达量在12 和24 h 分别下调61%和74%,之后36 h与对照差异不显著,48 h 表达量为初始1.26 倍;Bcpg5 基因表达量在12 h 达到最高,为对照17.34倍,之后表达量下降,24 h时是对照2.29倍,36 h与对照差异不显著,48 h 表达量为初始1.14 倍;BccatA基因表达量在12、24 和36 h 均显著下调,48 h与对照组差异不显著。
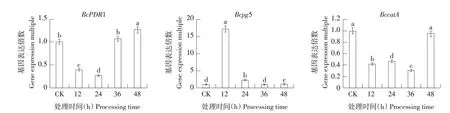
图5 茶香螺烷处理对草莓灰霉病菌致病力相关基因表达量的影响Fig.5 Effects of theospirane treatment on the expression of pathogenicity related genes of Botrytis cinerea in strawberry
3 讨 论
生物熏蒸是一种绿色环保且具有良好发展前景的技术,常用于防治植物土传病害。通过分解植物源体内代谢物质,产生挥发性气体,抑制或杀灭土壤中病原菌[19]。茶香螺烷又称螺环氧化物,是用途最广泛的高档香料之一,因具有红茶芳香而得名。常用于饮料、化妆品、香烟中,也是调味品香精的香源。本文研究茶香螺烷对草莓灰霉病菌的抑菌活性,结果表明茶香螺烷通过熏蒸与直接接触两种方法处理草莓灰霉病菌,均可抑制草莓灰霉病菌菌丝的生长,其中熏蒸处理抑菌效果更好,原因可能是菌丝在生长过程中,药剂挥发状态下与其表面接触面积更大,环境分布更均匀,药效发挥更好[20]。与马稳霞等报道黄花蒿精油的活性成分体外熏蒸法抑菌更具优势一致[21]。本研究发现,茶香螺烷对菌丝细胞膜有一定损伤,细胞膜透性改变,溶液环境中电导率不断升高且与药剂浓度有关。原因可能是茶香螺烷与膜上的蛋白和脂质发生作用,加大膜通透性,随着渗透作用一些胞内内含物泄漏,提高溶液导电性[22]。与刘琼等研究发现茼蒿提取物破坏西瓜枯萎病菌细胞膜,加大膜透性,引起电导率上升的结果一致[23]。
麦角固醇对真菌细胞膜的完整性具有重要作用,是细胞膜重要组成部分。麦角固醇是真菌膜上物质运输、流动性、完整性等正常生理生化活动必不可缺的物质[24]。本试验中,茶香螺烷对草莓灰霉病菌的麦角固醇合成途径产生抑制作用,对膜的完整性也有一定负面影响。Zhao 等报道过丁香酚处理立枯丝核菌后,菌体质壁分离,细胞膜成分遭到破坏,下调C-4 甲基甾醇氧化酶表达,麦角固醇合成途径受阻[25]。丙二醛是膜脂过氧化主要降解产物,反映细胞膜膜脂过氧化程度,含量过高会对细胞膜产生毒害。本试验得出,茶香螺烷处理后菌丝中丙二醛含量显著升高,与浓度呈正相关。上述研究结果表明,茶香螺烷处理草莓灰霉病菌后,麦角固醇含量降低与丙二醛积累共同作用下加速对菌丝细胞膜的损伤,达到抑制病原菌生长的效果。BcPDR1、BccatA、Bcpg5 是草莓灰霉菌致病力相关基因,分别对应调控致病力、过氧化物酶和细胞壁降解酶表达。BcPDR1在敲除和突变情况下,不产生菌核和分生孢子,且菌丝生长速率变慢,致病力完全丧失[26]。在茶香螺烷熏蒸后灰霉病菌BcPDR1表达量下降,表明病原菌致病力和侵染能力降低。36 和48 h 表达量恢复,可能与药剂挥发结束,新生菌丝致病力恢复有关;BccatA下调,过氧化物酶合成受阻,菌丝细胞清除活性氧能力降低,过氧化物不断在菌丝细胞中积累,对其产生毒害作用,与MDA 含量升高相对应;Bcpg5表达量在短时间内急剧升高,细胞壁降解酶大量合成,菌丝无法正常产生细胞壁,对于菌丝细胞支撑与保护能力下降,导致细胞膜更易遭到破坏。综上,茶香螺烷处理后,草莓灰霉病菌膜结构受损,致病力降低,对草莓灰霉病菌具有良好抑菌活性,且无毒,对环境不造成污染,为草莓保鲜提供新途径。
本课题组前期采用水蒸汽蒸馏法提取醉蝶花挥发性物质,通过GC-MS 检测出茶香螺烷占比为2.51%。因所提取的醉蝶花挥发性物质为多种挥发性物质混合物,为明确茶香螺烷对草莓灰霉病菌抑菌活性,本文选择茶香螺烷化学分析纯开展试验。茶香螺烷熏蒸和抑菌试验所用剂量是根据前期试验中醉蝶花挥发性物质最佳抑菌浓度及茶香螺烷在醉蝶花挥发性物质中占比而确定。茶香螺烷是一种无色透明状液体,广泛应用于食品增香剂,具有安全、无毒等特点。本试验明确茶香螺烷对草莓灰霉菌抑菌活性,为今后在草莓灰霉菌防腐保鲜中应用奠定基础,但茶香螺烷易挥发,果蔬病害防治方面直接应用具有一定局限性。今后可进行缓释微胶囊剂等剂型开发,在草莓运输贮藏期间,茶香螺烷浓度达到最小杀菌浓度,可发挥抑菌保鲜作用。

