从甜味受体的角度探讨玉竹治疗阴虚证“补而不腻”作用机制
欧阳征海,吴 璐,李 婷,邓碧莲,肖 音,杨华生
从甜味受体的角度探讨玉竹治疗阴虚证“补而不腻”作用机制
欧阳征海,吴 璐,李 婷,邓碧莲,肖 音,杨华生*
江西中医药大学,江西 南昌 330004
从甜味受体的角度阐明玉竹治疗阴虚证“补而不腻”作用机制。基于甜味受体,确定补阴药的“滋补”作用是对阴虚指标的逆转,而逆转过度即为“滋腻”;采用热性中药制备阴虚模型,模型成功后随机分为模型组、多糖组、醇提取物组和总提取物组,另取未造模大鼠为正常组,测定体质量、体温、摄食量、摄水量、粪便含水率、皮肤含水率、胃排空率、小肠推进率、胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)、胆囊收缩素(cholecystokinin,CCK)、胃动素(motilin,MTL)、血管活性肠肽(vasoactive intestinal peptide,VIP)、Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶、水通道蛋白(aquaporin,AQP)、味觉受体第一家族成员(taste receptor family 1 member,T1R)、α-味导素(α-gustducin)等阴虚指标“量”的变化,并采用细胞模型进一步探索上述指标的变化规律。玉竹多糖对摄水量、胃排空率、小肠推进率、GLP-1、MTL、Ca2+, Mg2+-ATP酶、AQP3、T1R3等17个指标有明显的“逆转”作用(<0.05),醇提取物则“顺应”阴虚动物摄水量、GLP-1、MTL、Ca2+, Mg2+-ATP酶、AQP3、T1R3等阴虚指标的变化规律(<0.05);与多糖比较,玉竹总提取物对阴虚动物的胃排空率、小肠推进率、GLP-1、Na+, K+-ATP酶、AQP1、AQP3、T1R3等阴虚指标有明显“回调”作用(<0.05),同时总提取物对细胞中GLP-1、AQP3、T1R2也有明显“回调”作用(<0.05)。玉竹基于含有的成分对甜味受体及其相关指标施加“相反”作用,故玉竹总体上呈现“补而不腻”的作用特点。
玉竹;多糖;补而不腻;甜味受体;阴虚;胰高血糖素样肽-1
中医认为,具有静止、凝聚、寒冷、抑制等特性的事物和现象,都属于阴[1],故“阴液(水)”属阴,而“热”则具有与“阴”相对的特性。因此,阴虚证具有“阴液亏少,阳亢内热”的临床表现。研究表明,“阴液亏少”与水通道蛋白(aquaporin,AQP)有关,而“阳亢内热”则与Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶有密切联系[2]。“虚则补之”,治疗阴虚证自然使用补阴药。补阴药不仅可使阴虚动物的AQP表达,以及Na+, K+-ATP酶的活性发生逆转,还能使阴虚动物的体质量、体温、摄食量、摄水量、皮肤含水量、粪便含水量也发生逆转[3]。一定程度上说,这就是补阴药的“滋补”效应。需要指出的是,补阴药在发挥“滋补”效应的同时,还具有“滋腻”作用。
然而,典型补阴药玉竹的功效却呈现“补而不腻”的特点。玉竹为百合科黄精属植物玉竹(Mill.) Druce的干燥根茎,其发挥药效的形式主要有玉竹多糖、玉竹醇提取物、玉竹总提取物3种[4],其中玉竹醇提取物主要含有总黄酮[5]、总皂苷等[6]。玉竹“补而不腻”的特点,古籍及教材均有相关描述。《本草便读》云:“……而养阴之药,又易碍邪,唯玉竹甘平滋润,虽补而不碍邪……”;《中药学》在玉竹“性能特点”项下对玉竹的作用特点描述为:“本品……养肺胃之阴而不滋腻……”[7]。然而,玉竹“补而不腻”的深层作用机制目前尚不清楚。玉竹微寒,味甘,甘能补。甘味,也称甜味,研究表明,表达于味蕾细胞的甜味受体介导“甘(甜)味”的形成与传递。甜味受体属于味觉受体第一家族成员(taste receptor family 1 member,T1R),T1R由T1R1、T1R2、T1R3构成,T1R2和T1R3以二聚体的形式构成甜味受体;甜味物质与T1R2/T1R3结合后,α-味导素(α-gustducin)活化,再经过一系列过程,最终导致膜去极化和神经递质释放,传递甜味[8]。近年研究还发现,甜味受体在肠道也有表达,激活肠道甜味受体可促进胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的分泌[9]。GLP-1是一种胃肠激素,能促进胰岛素分泌降低血糖,进而调节细胞内、外渗透压,调控机体“水液”分布。因此,甜味受体与“滋补”作用有关联;同时,GLP-1还具有延迟胃排空、抑制胃窦运动等作用[10]。因此,甜味受体与“滋腻”也有联系。
可见,GLP-1既“滋补”,又“滋腻”,GLP-1含量适中,发挥“滋补”作用,含量太高,出现“滋腻”现象,这可能是特殊的“量效关系”。GLP-1是激活甜味受体的主要效应,故可从甜味受体的角度探讨玉竹治疗阴虚证“补而不腻”作用机制。同时,研究表明,甜味受体还与AQP[11]、Na+, K+-ATP酶[12]以及胃动素(motilin,MTL)、血管活性肠肽(vasoactive intestinal peptide,VIP)、胆囊收缩素(cholecystokinin,CCK)等胃肠激素也有联系[13]。因此,本研究基于补阴药的作用及GLP-1的“量效关系”,首先将补阴药对阴虚动物体质量、体温、摄食量、摄水量、粪便/皮肤含水率、胃排空率、小肠推进率以及Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶、GLP-1、CCK、MTL、VIP、AQP、T1R2、T1R3、α-gustducin等阴虚证指标的“逆转”作用,确定为“滋补”作用,而“逆转”超过一定程度,确定为“滋腻”作用;然后采用热性中药制备阴虚证模型,研究玉竹多糖、醇提取物、总提取物对上述阴虚指标的影响;在此基础上,以人十二指肠腺癌HuTu-80细胞为细胞模型进一步验证玉竹各成分/部位对上述指标的作用。
1 材料
1.1 动物与细胞
SPF级SD雄性大鼠,体质量180~220 g,由江西中医药大学动物实验科技中心提供,许可证号SYXK(赣)2020-0003。大鼠饲养于12 h光照/12 h黑暗交替的环境中,室温20~25 ℃,相对湿度为40%~60%,自由饮水与进食。动物实验经江西中医药大学实验动物伦理委员会批准(批准号JZSYDWLL-20201215)。
HuTu-80细胞购自上海富衡生物科技有限公司。
1.2 药材
玉竹购自安徽道源堂中药饮片有限公司,附子、肉桂、干姜购自江西吁江生态科技有限公司,经江西中医药大学付小梅教授鉴定分别为百合科植物玉竹(Mill.) Druce的干燥根茎、毛茛科植物乌头Debx.的子根、樟科植物肉桂Presl的干燥树皮以及姜科植物姜Rosc的干燥根茎。
1.3 药品与试剂
GLP-1、MTL、CCK、VIP试剂盒(批号20201019)购自上海恒远生物科技有限公司;RNA提取试剂盒(批号R1200)购自北京索莱宝科技有限公司;M5 Sprint qPCR RT kit with gDNA remover(批号MF949-01)、Realtime PCR Super mix SYBR green with anti-Taq(批号MF013-01)购自北京聚合美生物科技有限公司;Na+, K+-ATP酶试剂盒(批号A070-2-2)、Ca2+, Mg2+-ATP酶试剂盒(批号A070-3-2)购自南京建成生物工程研究所;引物由上海生工生物工程技术服务有限公司合成;AQP1抗体(批号ET1703-34)、AQP3抗体(批号HA500247)、β-actin抗体(批号EM21002)、二抗(批号HA1006)购自杭州华安生物技术有限公司;T1R2抗体(批号Ab-DF10279)购自Affinity Biosciences公司;T1R3抗体(批号A10157)购自武汉爱博泰克生物科技有限公司;α-gustducin抗体(批号bs-6149R)购自北京博奥森生物科技有限公司。
1.4 仪器
Multiskan GO全波长酶标仪(美国Thermo公司);Light Cycler 96型qRT-PCR仪(罗氏集团);Chemidoc XRS+高灵敏度化学发光成像系统(美国Bio-Rad公司);752型紫外-可见分光光度计(上海菁华科技仪器有限公司);MC-347型欧姆龙电子体温计(欧姆龙大连有限公司);Allegra 64R型高速冷冻离心机(美国贝克曼库尔特公司);DYCZ-24DN型双垂直电泳仪(北京六一仪器厂)。
2 方法
2.1 药物的制备
取玉竹,加水浸泡1.0 h后,加热至100 ℃,回流提取2次,同时收集挥发油,备用(得率0.98%);合并提取液,浓缩,加乙醇至含醇80%,冷藏,过滤,沉淀干燥,即得玉竹“多糖”,质量分数为73.25%,得率21.19%,且符合《中国药典》2020年版要求[14];滤液浓缩,干燥,粉碎,与上述挥发油混合均匀,即得玉竹“醇提取物”,得率12.30%,其中含总黄酮2.93%、总皂苷6.50%;合并玉竹“多糖”与玉竹“醇提取物”,即得玉竹“总提取物”。
取附子适量,加水100 ℃提取60 min后,再加入干姜、肉桂提取,滤过,药渣再提取1次,合并2次滤液,浓缩至生药质量浓度2 g/mL,即得“热性中药”提取液,4 ℃储存,备用。
2.2 基于整体动物模型阐释玉竹“补而不腻”机制
2.2.1 动物造模、分组及给药 取大鼠50只,ig热性中药(10 mL/kg)制备阴虚证模型,以体质量、活动状态、毛发光泽、爪色、尿液颜色、粪便质地为模型评价指标[15]。造模成功后随机分为模型组、多糖(267 mg/kg,根据临床剂量及浸膏得率换算,下同)组、醇提取物(155 mg/kg)组和总提取物组(422 mg/kg)组,每组10只;另取10只大鼠作为正常组,正常组及模型组ig等体积的0.9%生理盐水,1次/d,连续28 d。
2.2.2 体质量、体温、摄食量、摄水量、粪便含水率、皮肤含水率的检测 参照文献方法[16],分别于给药前及给药后7、14、21、28 d进行体质量、体温、摄食量、摄水量测定。同天收集大鼠24 h的粪便,称定,记为湿质量,然后在90 ℃的烘箱中烘干3 h,称定,记为干质量,计算粪便含水率[17];取皮肤约1 cm2,称定质量,记为湿质量,随即放入80 ℃烘箱中干燥2 h,称定质量,记为干质量,计算皮肤含水率[18]。
粪便含水率=(湿质量-干质量)/湿质量
皮肤含水率=(湿质量-干质量)/湿质量
2.2.3 胃排空率与小肠推进率的测定 末次给药后,禁食不禁水12 h,ig酚红溶液,30 min后ip戊巴比妥钠麻醉,取胃并切开,以蒸馏水冲出内容物并收集,定容,加NaOH溶液混匀,室温放置后取上清液加入20%三氯乙酸溶液,离心后取上清液测定其吸光度()值,记为实测酚红;另取0.04%酚红-明胶溶液,按上述方法,依次加蒸馏水、NaOH、三氯乙酸溶液,混匀配成标准溶液,测定值,记为标准酚红,计算胃排空率[19]。同时分离小肠,直铺于冰上,量取小肠全长及酚红在小肠内的推进的距离,计算小肠推进率[20]。
胃排空率=1-实测酚红/标准酚红
小肠推进率=幽门至酚红染成红色末端的距离/幽门至回盲瓣的距离
2.2.4 取样 在完成“2.2.3”项下实验后,取皮肤、肺、肝、胃、肾、十二指肠,放入−80 ℃超低温冰箱,备用;另腹主动脉取血,静置,离心,取上清,得血清,备用,同时收集下层红细胞,备用。
2.2.5 GLP-1、CCK、MTL、VIP含量的测定 取血清,按试剂盒说明书,采用ELISA法测定血清中GLP-1、CCK、MTL、VIP的含量。
2.2.6 Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶活性测定 取肝、肾组织适量,按1∶9加生理盐水,匀浆,4 ℃离心,取上清测定酶的活性;取红细胞于离心管,加PBS及PMSF,置冰上破溶,离心,得红细胞膜,备用;取细胞膜,加裂解液,反复冻融3次,离心,取上清测定酶的活性。
2.2.7 qRT-PCR测定、、、和mRNA表达 取肺、胃、肾、十二指肠适量,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。

表1 引物序列
2.2.8 Western blotting测定AQP1、AQP3、T1R2、T1R3和α-gustducin蛋白表达 取肺、胃、肾、十二指肠适量,匀浆,加裂解液提取蛋白,测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭,加入一抗,4 ℃孵育过夜,洗膜,加入二抗孵育,洗涤,显色。
2.3 基于细胞模型阐释玉竹“补而不腻”机制
2.3.1 Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶活性测定 取对数生长期的HuTu-80细胞,以4×105个/孔接种于6孔板,贴壁后吸去培养基,设置正常组、多糖(200 μg/mL)组、醇提取物(100 μg/mL)组和总提取物(300 μg/mL)组,正常组加入细胞培养液2 mL,给药组加入同体积的相应提取液,继续培养24 h后,消化后离心收集细胞,加缓冲液,匀浆破碎细胞,测定Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶的活性。
2.3.2 GLP-1含量的测定 按“2.3.1”项下进行分组和给药,培养24 h后吸去培养基,再加入3 mmol/L葡萄糖,孵育5 min,小心吸取细胞培养液于EP管内,4 ℃离心10 min,取上清测定GLP-1含量。
2.3.3 qRT-PCR和Western blotting测定、、、mRNA和蛋白表达 按“2.3.1”项下进行分组和给药,培养24 h后吸去培养基,按“2.2.7”项下方法测定细胞中、、、mRNA表达,按“2.2.8”项下方法测定细胞中AQP1、AQP3、T1R2、T1R3蛋白表达。
2.4 统计学分析
3 结果
3.1 玉竹对阴虚大鼠体质量、体温、摄食量、摄水量、粪便含水率和皮肤含水率的影响
如图1-A所示,“阴虚”会导致大鼠体质量下降(<0.05);与模型组比较,给予玉竹多糖、总提取物干预14 d后,大鼠体质量明显增加(<0.05),而“阴虚”动物的体温并未见明显升高(图1-B)。如图1-C所示,“阴虚”会导致动物的摄水量增加(<0.05),而玉竹醇溶性成分则“顺应”这种规律,给予醇提取物干预7、14 d,大鼠的摄水量进一步增加(<0.05),这可能与醇溶性提取物中含有挥发油有关[21];然而给予玉竹多糖14 d后,摄水量显著下降(<0.05)。如图1-D所示,多糖组大鼠在给药前期(7、14 d)摄食量显著上升(<0.05),而给药21 d后呈下降趋势,给药28 d摄食量明显下降(<0.05);这一结果表明,玉竹多糖可能对阴虚动物具有“治疗”作用而出现摄食量增加,但久服多糖可能出现了“滋腻碍胃”效应,降低了大鼠的食欲而致摄食量下降。如图1-E所示,与模型组比较,给予玉竹多糖、总提取物组21 d后,大鼠粪便含水率明显上升(<0.05);如图1-F所示,与模型组比较,多糖组、总提取物组大鼠皮肤含水率显著升高(<0.05)。

与正常组比较:#P<0.05;与模型组比较:*P<0.05;与多糖组比较:△P<0.05,下图同
3.2 玉竹对阴虚大鼠胃排空率、小肠推进率和胃肠激素的影响
如图2-A所示,与正常组比较,模型组大鼠胃排空率、小肠推进率显著上升(<0.05);与模型组比较,多糖组大鼠胃排空率和小肠推进率明显减慢(<0.05);与多糖组比较,总提取物组大鼠胃排空率和小肠推进率显著增加(<0.05)。如图2-B所示,与正常组比较,模型组大鼠血清中GLP-1、CCK和VIP含量明显降低(<0.05),MTL含量显著升高(<0.05);与模型组比较,多糖组大鼠GLP-1、CCK和VIP含量明显上升(<0.05),MTL含量显著下降(<0.05);醇提取物组大鼠GLP-1含量进一步降低(<0.05),MTL含量却进一步明显升高(<0.05);与多糖组比较,总提取物组大鼠GLP-1含量明显下降(<0.05)。
3.3 玉竹对阴虚大鼠肝、肾、红细胞膜中Na+, K+-ATP酶和Ca2+, Mg2+-ATP酶活性的影响
如图3-A所示,与正常组比较,模型组大鼠肝、肾组织中Na+, K+-ATP酶活性明显上升(<0.05);与模型组比较,多糖组、总提取物组大鼠肝、肾组织中Na+, K+-ATP酶明显下降(<0.05);与多糖组比较,总提取物组大鼠肝组织中Na+, K+-ATP酶明显上升(<0.05)。如图3-B所示,与正常组比较,模型组大鼠肝、肾、红细胞膜中Ca2+, Mg2+-ATP酶活性明显上升(<0.05);与模型组比较,多糖组肝组织中Ca2+, Mg2+-ATP酶活力明显下降(<0.05),而醇提取物组大鼠肝、肾、红细胞膜中Ca2+, Mg2+-ATP酶活性进一步上升(<0.05)。

图2 玉竹对阴虚大鼠胃排空率、小肠推进率(A) 及胃肠激素水平(B) 的影响(, n = 10)
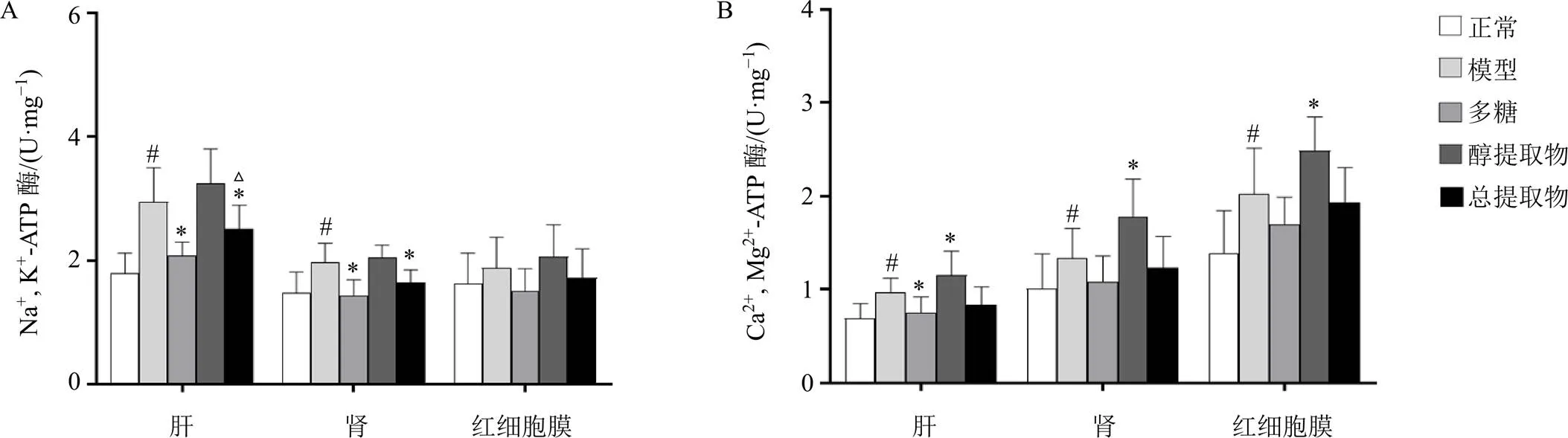
图3 玉竹对阴虚大鼠肝、肾、红细胞膜中Na+, K+-ATP酶(A)和Ca2+, Mg2+-ATP酶 (B) 活性的影响(, n = 10)
3.4 玉竹对阴虚大鼠肺、胃、肾组织中AQP1、AQP3 mRNA和蛋白表达的影响
如图4-A、D所示,与正常组比较,模型组大鼠肺、胃、肾中、mRNA表达水平均显著降低(<0.05);与模型组比较,多糖组肺、肾中、mRNA表达水平明显上升(<0.05),醇提取物组胃mRNA表达水平却显著下降(<0.05);与多糖组比较,总提取物组大鼠肺、胃中mRNA表达水平显著下降(<0.05)。如图4-B、C、E、F所示,与模型组比较,多糖组肺、胃、肾AQP1、AQP3蛋白表达水平均明显上升(<0.05),总提取物组肾AQP1、AQP3蛋白表达水平明显上升(<0.05);与多糖组比较,总提取物组肺、胃中AQP1、AQP3蛋白表达水平明显下降(<0.05)。
3.5 玉竹对阴虚大鼠十二指肠组织中T1R2、T1R3、α-gustducin mRNA和蛋白表达的影响
如图5-A所示,与正常组比较,模型组大鼠、和mRNA表达均显著降低(<0.05);与模型组比较,多糖组大鼠、、mRNA表达均明显升高(<0.05),而醇提取物组mRNA的表达则“顺应”阴虚动物的变化规律,表达进一步下降(<0.05);与多糖组比较,总提取物组mRNA表达明显下降(<0.05)。如图5-B、C所示,与正常组比较,模型组T1R2、T1R3、α-gustducin蛋白表达显著降低(<0.05);与模型组比较,多糖组T1R2、T1R3、α-gustducin蛋白表达明显升高(<0.05),醇提取物组T1R3表达进一步下降(<0.05);与多糖组比较,总提取物组T1R3蛋白表达明显下降(<0.05)。
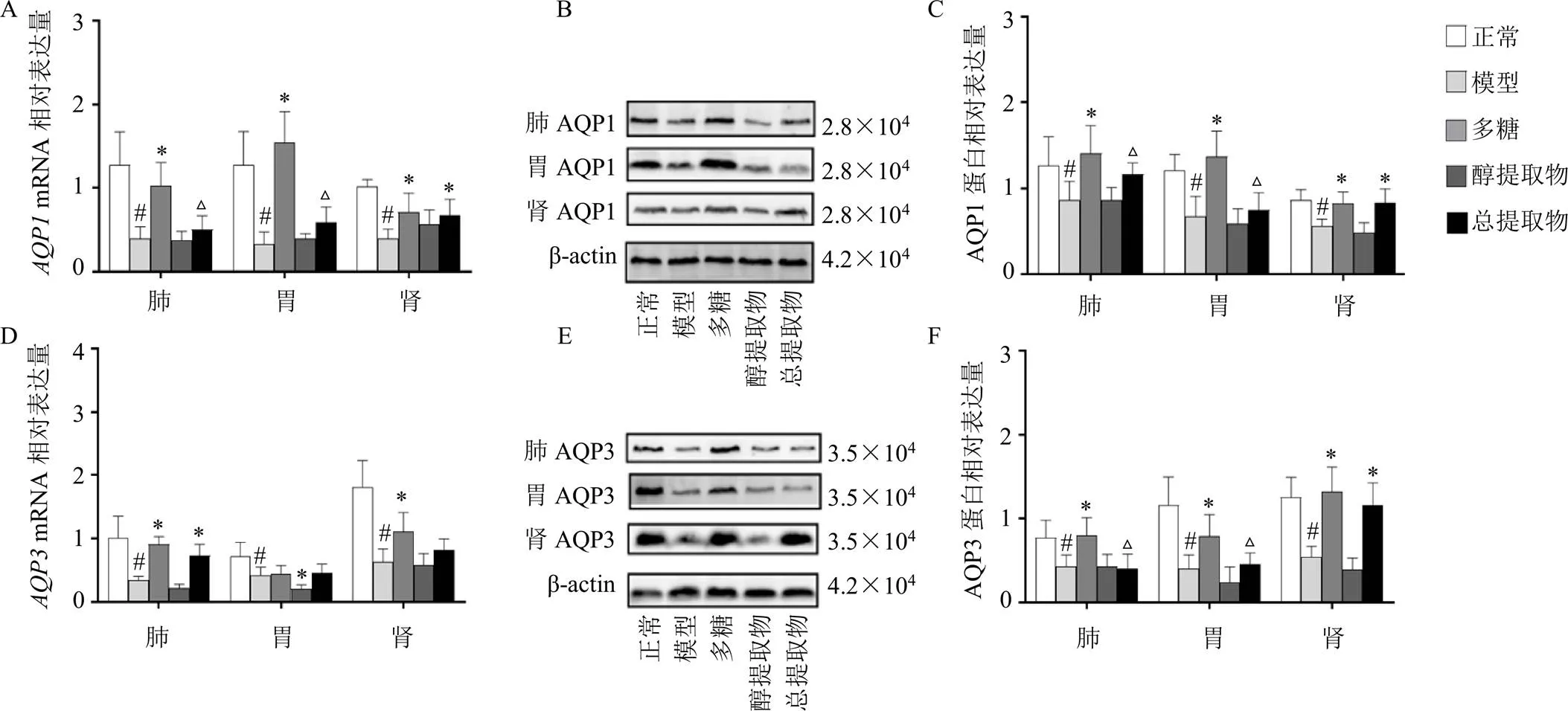
图4 玉竹对阴虚大鼠肺、胃、肾组织中AQP1、AQP3 mRNA (A、D) 和蛋白(B、C、E、F) 表达的影响(, n = 6)
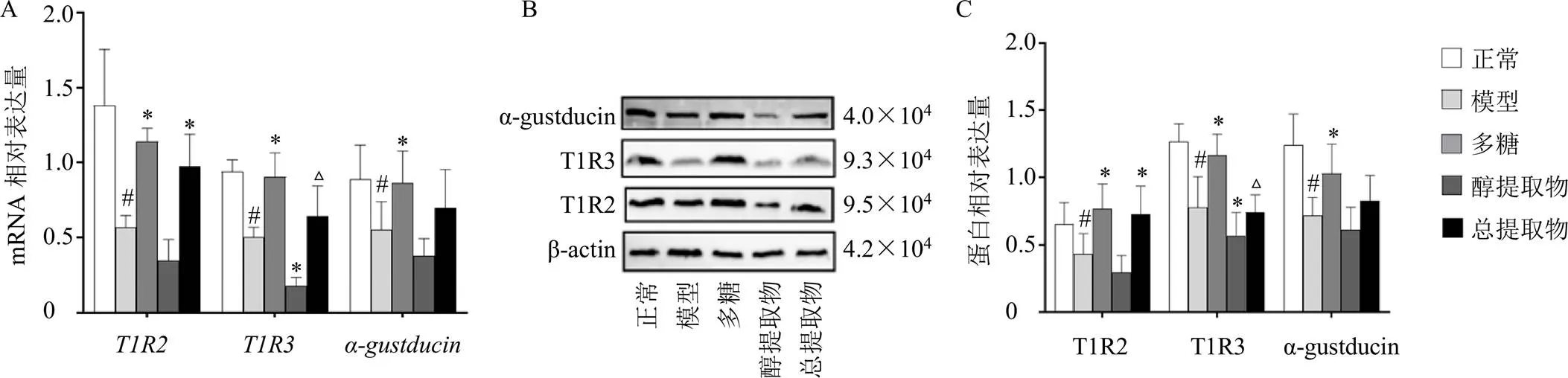
图5 玉竹对阴虚大鼠十二指肠组织中T1R2、T1R3、α-gustducin mRNA (A) 和蛋白(B、C) 表达的影响(, n = 6)
3.6 玉竹对HuTu-80细胞中Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶、GLP-1、AQP1、AQP3、T1R2、T1R3的影响
如图6-A所示,与正常组比较,多糖组Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶活性明显下降(<0.05)。图6-B显示,多糖可明显促进GLP-1的分泌(<0.05),而醇提取物则可显著抑制GLP-1分泌(<0.05);与多糖组比较,总提取物组GLP-1含量明显下降(<0.05)。如图6-C所示,与正常组比较,多糖组、、mRNA表达水平明显上升(<0.05),而醇提取物组、mRNA表达水平明显降低(<0.05);与多糖组比较,总提取物组mRNA表达水平明显降低(<0.05)。如图6-D、E所示,与正常组比较,多糖组AQP1、T1R2蛋白表达水平明显升高(<0.05),醇提取物组T1R2、T1R3蛋白表达水平则明显下降(<0.05);与多糖组比较,总提取物组T1R2蛋白表达水平明显降低(<0.05)。
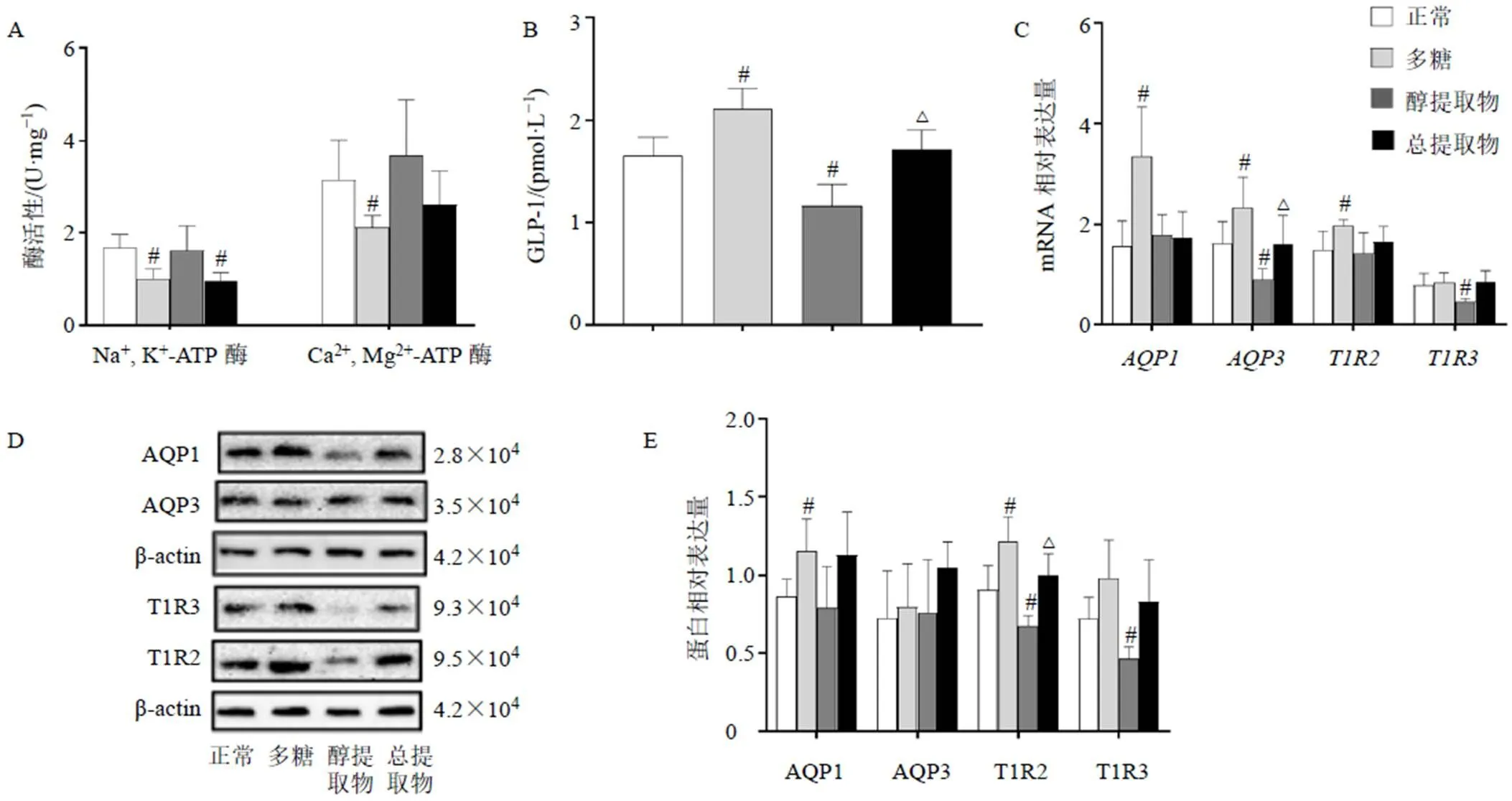
图6 玉竹对HuTu-80细胞中Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶活性(A)、GLP-1含量 (B)、AQP1、AQP3、T1R2、T1R3 mRNA (C) 及蛋白(D、E)表达的影响(, n = 6)
4 讨论
补阴药味“甘”,既具“滋补”之效,又有“滋腻”之弊,正如《医学源流论》所云:“补益滋腻之药”。《中医诊断学》认为,阴虚证是指人体阴液亏少,其滋润、濡养功能减退,或阴不制阳,阳气偏亢,以口咽干燥、五心烦热、潮热盗汗为主要表现的虚热证[22]。因此,补阴的“滋补”效应可看作是补阴药对阴液亏少、潮热盗汗等“症状”的缓解作用。本研究将“阴虚”动物的体质量、体温、摄食量、摄水量、粪便含水率、皮肤含水率、胃排空率、小肠推进率、Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶、GLP-1、CCK、MTL、VIP、AQP1、AQP3、T1R2、T1R3、α-gustducin作为“阴虚指标”。在这些指标中,体质量等15个指标与阴虚均有直接联系[3,23-24],而GLP-1、T1R2、T1R3、α-gustducin 4个指标与阴虚的直接关联,还有待进一步挖掘;但研究发现GLP-1、T1R2、T1R3、α-gustducin等指标与糖尿病有关联[9,25],而糖尿病常有“阴虚”表现。在确定“阴虚指标”的基础上,将补阴药对阴虚模型动物阴虚指标的“逆转”作用确定为“滋补”作用,如“逆转”超出一定程度,即为“滋腻”作用。因此,“滋腻”不只是与胃肠蠕动减慢有关,还与其他因素有关,如AQP蛋白的表达超出一定范围,水湿停滞,也易“滋腻”。
动物模型的合理性、可重复性是中医药研究科学性、可靠性的重要保障。目前“阴虚证”动物模型的构建主要包括“模拟阴虚证临床表现、模拟阴虚证病因病机、模拟阴虚临床高发病”3种方法[26]。采用甲状腺素激素构建阴虚证即属于“模拟阴虚证临床表现”的造模方法,而采用四氯化碳导致肝炎进而出现“阴虚”,即属于“模拟阴虚临床高发病”的造模方法。本研究采用热性中药制备阴虚模型,属于“模拟阴虚证病因病机”的造模方法。《素问·阴阳应象大论》云:“阳盛则阴病”,且玉竹是典型的补阴药,主要用于胃阴虚、肺阴虚,因此ig热性中药,易导致“胃阴虚”。实验中发现,大鼠长期ig热性中药后“阴虚”症状明显,无死亡现象,重复性较好。需要指出的是,ig热性中药可能是“实热”,也可能是“阴虚(内热)”。本研究发现,造模前期,大鼠出现烦躁、易怒等“实热”症状,但“久服”热性中药后,大鼠摄水量增加,皮肤干燥,而体温却未见明显变化,表明出现了“阴虚(内热)”。
甜味受体分布广泛,激动肠道甜味受体可促进肠道L细胞分泌GLP-1。GLP-1不仅可促进胰岛素分泌,还能抑制食欲减缓胃排空[27]。因此,GLP-1体现了“滋补”、“滋腻”2种相反效应。本研究中,阴虚大鼠GLP-1的分泌下降,胃肠道蠕动能力增强,这也与胃排空与小肠推进率实验结果一致;给予玉竹多糖干预后,GLP-1分泌明显增加,而与多糖组比较,总提取物组大鼠GLP-1明显下降。从GLP-1的效应分析,服用玉竹多糖后GLP-1的分泌量明显增加,在发挥“滋补”作用的同时,也必然出现胃肠蠕动减慢等“滋腻”效应;服用由多糖、醇提取物组成的玉竹总提取物,其中的多糖促进GLP-1的分泌,而其中的醇提取物则抑制GLP-1的分泌。这可能是玉竹治疗阴虚证“补而不腻”的主要机制。同时,本研究还发现,阴虚会导致T1R2、T1R3的表达降低,玉竹多糖、玉竹醇提取物对T1R2、T1R3的表达均有作用,但作用相反;在细胞实验中T1R2、T1R3的表达也有相似的规律。可见,玉竹醇提取物可部分抵消玉竹多糖对甜味受体表达的作用,这可能是玉竹“补而不腻”主要物质基础。
课题组前期研究玉竹多糖对糖尿病大鼠甜味受体的影响,结果显示,玉竹多糖对甜味受体T1R2、T1R3的表达有促进作用[28];结合本实验结果推测,玉竹多糖可能通过上调甜味受体的表达,并在内源性甜味剂——葡萄糖的参与下,促进GLP-1的分泌;换句话说,玉竹多糖可能是甜味受体的诱导剂,而非激动剂,因此本实验未考察玉竹多糖与甜味受体激动剂/抑制剂合用后的效应;与玉竹多糖不同,玉竹醇提取物中含有的物质可能是甜味受体抑制剂,能下调甜味受体的表达;还可能既是抑制剂又是拮抗剂,在下调甜味受体表达的同时还能阻断激动剂与之结合。课题组已从玉竹醇提取物中分离纯化了“玉竹皂苷”(质量分数为63.5%),并考察了玉竹皂苷单用及与甜味受体抑制剂Lactisole合用时对GLP-1分泌的影响;接下来,将进一步研究“玉竹醇提取物”中另一种成分——玉竹黄酮对甜味受体及GLP-1的作用。
研究表明,甜味受体与AQP、Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶存在关联,AQP的功能主要是是介导水的转运[29]。研究发现,皮肤中的AQP3表达与阴虚皮肤干燥存在一定联系[30];本实验中,阴虚大鼠肺、胃、肾中AQP1、AQP3表达降低,给予多糖后,AQP1、AQP3表达升高,而给予醇提取物后,胃、肾AQP3的表达在模型组的基础上进一步降低;细胞实验中的玉竹多糖、醇提取物对AQP1、AQP3表达也呈现与整体动物相似的规律。研究还发现,甲状腺功能亢进、糖尿病等“阴虚”证Ca2+, Mg2+-ATP酶的活性也会发生相应改变[31]。本研究中,与模型组比较,多糖组大鼠肝Ca2+, Mg2+-ATP酶活力明显下降,醇提取物组大鼠肝、肾、红细胞膜Ca2+, Mg2+-ATP酶活力明显上升。本实验结果表明,玉竹多糖与玉竹醇溶性成分对Ca2+, Mg2+-ATP酶活力的影响也可能存在“相反”效应,即玉竹醇溶性成分可在一定程度上“抵消”了玉竹多糖对Ca2+, Mg2+-ATP酶活性的“抑制效应”。以上研究表明,玉竹多糖、玉竹醇溶性成分对AQP、Ca2+, Mg2+-ATP酶的作用的方向“相反”,这可能也是玉竹“补而不腻”的机制之一。
进一步分析发现,玉竹对GLP-1、T1R2、T1R3、AQP、Ca2+, Mg2+-ATP酶等阴虚指标具有“双向调节”作用;事实上,玉竹“既能滋阴又能增长阳气”[32],这就是玉竹的“双向调节”作用的中医表述。双向调节是指当机体处于失衡状态时,采用同一药物或方剂治疗后,既能使机体从亢进状态向正常状态转化,亦可使机体从低下状态向正常状态转化[33]。需要注意的是,机体从“失衡状态”到“正常状态”的转变,也可能是基于机体的“自然恢复性”。本文结果表明,模型组与给药组的阴虚指标在“数值”上存在较大的差别。因此推断,玉竹对GLP-1、T1R2、T1R3、AQP、Ca2+, Mg2+-ATP酶等阴虚指标具有“双向调节”作用,其机制可能与玉竹同时含有多糖、醇提取物等“多成分”有关。
综上,玉竹多糖通过上调甜味受体的表达,促进GLP-1分泌,“逆转”了AQP、Na+, K+-ATP酶等阴虚指标,从而发挥“滋补-滋腻”正反效应,而醇提取物则部分抵消多糖对GLP-1、T1R2、T1R3、AQP、Ca2+, Mg2+-ATP酶等指标的逆转效应,故玉竹总体上呈现“补而不腻”。由于目前尚无公认的用于治疗阴虚证的药物,且基于“甜味受体”治疗阴虚证的药物缺乏,本研究未设置阳性对照组。本研究从“成分”出发,分析比较玉竹中各成分对“阴虚指标”的作用方向及作用强度,从“甜味受体”一个角度,同时阐明玉竹“滋补-滋腻-不腻”,即“补而不腻”的作用机制,为玉竹、补阴药、甘味药的功效阐释提供新思路,丰富并助推了五味理论的传承与发展。
利益冲突 所有作者均声明不存在利益冲突
[1] 郑洪新. 中医基础理论 [M]. 第4版. 北京: 中国中医药出版社, 2016: 28.
[2] 瞿领航, 涂济源, 曹国胜, 等. 基于燥胜则干和燥性伤阴理论的苍术燥性效应研究 [J]. 中国中药杂志, 2018, 43(13): 2705-2712.
[3] 甘江华, 黄玙璠, 彭代银, 等. 3种石斛对脾阴虚型大鼠便秘的治疗作用及其机制初步研究 [J]. 中国中药杂志, 2019, 44(12): 2600-2606.
[4] 张智敏, 胡玉珍, 熊苏慧, 等. 玉竹水提醇沉上清液对甲亢阴虚型大鼠干预的GC-MS代谢组学研究 [J]. 中国药学杂志, 2017, 52(23): 2092-2097.
[5] 李婷, 邓碧莲, 欧阳征海, 等. 基于甜味受体整合中药“效味”和“滋味”探索玉竹甘味药性物质基础[J]. 中草药, 2023, 54(3): 849-858.
[6] 张海燕. 蒙药玉竹的研究进展 [J]. 中国民族医药杂志, 2021, 27(11): 74-75.
[7] 陈蔚文. 中药学 [M]. 第2版. 北京: 人民卫生出版社, 2012: 401
[8] Suzuki T. Cellular mechanisms in taste buds [J]., 2007, 48(4): 151-161.
[9] 田巧基, 夏凯, 刘义凤, 等. 功能糖通过甜味受体信号通路促进GLP-1的分泌 [J]. 中国食品学报, 2021, 21(5): 108-116.
[10] Park J, Jang H J. Anti-diabetic effects of natural products an overview of therapeutic strategies [J]., 2017, 13(1): 1-20.
[11] Agre P. Aquaporin water channels: From atomic structure to clinical medicine [J]., 2006, 2(4): 266-267.
[12] Liu J, Yan Y L, Liu L J,. Impairment of Na/K-ATPase signaling in renal proximal tubule contributes to Dahl salt-sensitive hypertension [J]., 2011, 286(26): 22806-22813.
[13] Sutherland K, Young R L, Cooper N J,. Phenotypic characterization of taste cells of the mouse small intestine [J]., 2007, 292(5): G1420-G1428.
[14] 中国药典 [S]. 一部. 2020: 86.
[15] 白茹, 刘欣欣, 李凤金, 等. 阴虚证动物模型的造模方法 [J]. 中华中医药学刊, 2020, 38(2): 69-71.
[16] Zhang Y B, Liu D F, Xue F,. Anti-malignant ascites effect of total diterpenoids fromis attributable to alterations of aquaporins via inhibiting PKC activity in the kidney [J]., 2021, 26(4): 942.
[17] 谢昌营, 余绪超, 葛巍, 等. 麻元通便止痛汤调控AMPK/eNOS信号通路改善大鼠慢传输型便秘的作用机制 [J]. 中国药房, 2022, 33(13): 1617-1623.
[18] 李伟, 陈冉, 欧美凤, 等. 基于生物电阻抗评价大鼠脾虚水湿内停模型 [J]. 中国实验方剂学杂志, 2019, 25(22): 49-54.
[19] 袁培培, 侯颖, 李潘营, 等. 基于痰饮停聚哮喘模型及主成分分析的葶苈子化学拆分组分沉降药性归属研究 [J]. 中草药, 2022, 53(2): 449-460.
[20] 贺凤娥, 万全荃, 林亚平, 等. 电针对糖尿病性胃轻瘫模型大鼠INS水平和CCK含量的影响 [J]. 上海针灸杂志, 2016, 35(1): 81-84.
[21] 秦华珍, 钟贵, 何瑞坤, 等. 3味山姜属中药挥发油对胃溃疡寒证大鼠的药效机制研究 [J]. 中华中医药学刊, 2022, 40(3): 19-23.
[22] 李灿东. 中医诊断学 [M]. 第4版. 北京: 中国中医药出版社, 2016: 7.
[23] 孙晓霞, 任威铭, 崔荣兴, 等. 阴虚证动物模型的建立与评价 [J]. 中医杂志, 2021, 62(13): 1156-1163.
[24] 陈丽, 信建军, 陈鹏. 益胃汤合麦门冬汤对胃阴亏虚型慢性胃炎患者的临床疗效 [J]. 中成药, 2022, 44(7): 2157-2161.
[25] 麦威, 范郁山, 苗芙蕊. 电针联合壮医药线点灸对糖尿病胃轻瘫大鼠胃窦组织凋亡相关蛋白表达的影响 [J]. 针刺研究, 2022, 47(9): 801-808.
[26] 史莹, 过建春, 荀运浩. 阴虚证动物模型的建立方法及造模思路评析 [J]. 中华中医药学刊, 2017, 35(3): 725-727.
[27] Drucker D J. Evolving concepts and translational relevance of enteroendocrine cell biology [J]., 2016, 101(3): 778-786.
[28] 柳婷. 基于甜味受体的玉竹多糖降血糖作用机理研究 [D]. 南昌: 江西中医药大学, 2022.
[29] 梁灿璨, 吴诗华, 魏羽, 等. 补骨脂盐炙前后对肾阳虚大鼠肝肾功能及水通道蛋白表达的影响 [J]. 中草药, 2017, 48(22): 4713-4718.
[30] 赵乐, 李艳彦. 黄芪桂枝五物汤对-半乳糖联合右旋糖酐-40致小鼠衰老皮肤瘙痒模型AQP3的影响 [J]. 中国实验方剂学杂志, 2015, 21(7): 148-154.
[31] 苏发智, 白晨曦, 张文森, 等. 基于正常及寒热证模型大鼠物质能量代谢的天南星与胆南星的药性研究 [J]. 中国中药杂志, 2022, 47(17): 4682-4690.
[32] 李婉, 赵海潞. 什么是中药双向调节? [J]. 医学争鸣, 2020, 11(5): 56-58.
[33] 王小强, 李双阳, 白雪, 等. 中药双向调节作用的临床与研究进展 [J]. 中药药理与临床, 2020, 36(6): 215-221.
Mechanism of “tonifying but not cloying” effect ofin treatment ofdeficiency from perspective of sweet taste receptors
OU YANG-zheng hai, WU Lu, LI Ting, DENG Bi-lian, XIAO Yin, YANG Hua-sheng
Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
To elucidate the mechanism of “tonifying but not cloying” effect ofin treatment ofdeficiency from the perspective of sweet taste receptors.Based on sweet taste receptors, it was determined that the “tonifying” effect oftonics was a reversal ofdeficiency indicators, and that excessive reversal was “cloying”. The model ofdeficiency was prepared by using hot Chinese medicine, and was randomly divided into model group, polysaccharide group, alcoholic extract group and total extract group after the model was successful, the unmodeled rats were also taken as the normal group. “Quantitative” changes ofdeficiency indicators such as body weight, body temperature, food intake, water intake, fecal water content, skin water content, gastric emptying rate, small intestine propulsion rate, glucagon-like peptide-1 (GLP-1), cholecystokinin (CCK), motilin (MTL), vasoactive intestinal peptide (VIP), Na+, K+-ATPase, Ca2+, Mg2+-ATPase, aquaporin (AQP), taste receptor family 1 member (T1R), α-gustducin were measured. And the cellular model was used to further explore the change pattern of the above indexes.Polysaccharide had a significant “reversal” effect on 17 indicators including water uptake, gastric emptying rate, small intestine propulsion rate, GLP-1, MTL, Ca2+, Mg2+-ATPase, AQP3 and T1R3 (< 0.05), alcoholic extract “conformed” to the pattern of changes indeficiency indicators such as water intake, GLP-1, MTL, Ca2+, Mg2+-ATPase, AQP3 and T1R3 indeficient animals (< 0.05). Compared with polysaccharides, total extract had a significant “back-regulating” effect on gastric emptying rate, small intestine propulsion rate, GLP-1, Na+, K+-ATPase, AQP1, AQP3, T1R3 and otherdeficiency indexes indeficient animals (< 0.05), while total extract also had a significant “back-regulating” effect on cellular GLP-1, AQP3, T1R2 (< 0.05). Total extract also had a significant “back-regulating” effect on GLP-1, AQP3 and T1R2 in cells (< 0.05).The overall effect ofis “tonifying but not cloying” because of its components that exert “opposite” effects on sweet taste receptors and their related indicators.
(Mill.) Druce; polysaccharide; tonifying but not cloying; sweet taste receptor;deficiency; glucagon-like peptide-1
R285.5
A
0253 - 2670(2023)10 - 3179 - 10
10.7501/j.issn.0253-2670.2023.10.015
2022-11-28
国家自然科学基金资助项目(81960724);校级研究生创新专项(JZYC22S66)
欧阳征海(1997—),男,硕士研究生。E-mail: 1174118351@qq.com
杨华生(1974—),男,博士,教授,研究方向为中药制剂及传统中药理论。E-mail: 652477071@qq.com
[责任编辑 李亚楠]

